扩展功能
文章信息
- 韩茜, 冯云, 杨卫红, 张婧, 潘虹, 杨丽芬, 王娟
- HAN Xi, FENG Yun, YANG Wei-hong, ZHANG Jing, PAN Hong, YANG Li-fen, WANG Juan
- 云南省蛛蝇和蝠蝇感染沃尔巴克氏体初步调查研究
- A preliminary study of Wolbachia infection in Nycteribiidae and Streblidae in Yunnan province, China
- 中国媒介生物学及控制杂志, 2019, 30(1): 18-24
- Chin J Vector Biol & Control, 2019, 30(1): 18-24
- 10.11853/j.issn.1003.8280.2019.01.004
-
文章历史
- 收稿日期: 2018-08-23
- 网络出版时间: 2018-12-6 20:43
沃尔巴克氏体(Wolbachia)是一类在节肢动物体内广泛存在、能经卵传播、呈母系遗传的革兰阴性胞内共生菌, 属于变形菌门(Proteobacteria)变形菌纲α亚群(Alphaproteobacterial)立克次体目(Rickettsiales)立克次体科(Rickettsiaceae)沃尔巴克氏体属(Wolbachia)[1]。1924年, Hertig和Wolbach[2-3]在尖音库蚊(Culex pipiens)的生殖细胞中发现沃尔巴克氏体。既往研究表明, 约40%的节肢动物和65%的昆虫中自然携带沃尔巴克氏体[4-5], 且沃尔巴克氏体能够参与节肢动物宿主的生殖调控[6-8]。
蛛蝇科(Nycteribiidae)和蝠蝇科(Streblidae)昆虫属于节肢动物门(Arthropoda)、昆虫纲(Insecta)、双翅目(Diptera)、虱蝇总科(Hippoboscoidae), 是蝙蝠体表寄生的重要吸血昆虫, 体内有共生菌的存在[9-11], 且是疟疾[12-14]和巴尔通体[15-17]潜在的传播媒介, 还在蛛蝇标本中检测到弹状病毒科病毒核酸(RNA)[18], 分离到Mahlapitsi virus(MAHLV)[19]和肯科伊病毒(Kuang Koih virus, KKV)[20]。蛛蝇科和蝠蝇科昆虫可携带多种病原体, 是一种与疾病控制相关的重要媒介生物。目前国内外关于沃尔巴克氏体的研究主要在蚊虫、果蝇和白蚁等昆虫, 对于蛛蝇和蝠蝇感染沃尔巴克氏体的研究较少, 仅Wilkinson等[21]研究证实马达加斯加蛛蝇和蝠蝇体内携带沃尔巴克氏体。本研究对采集到的蛛蝇和蝠蝇感染沃尔巴克氏体的情况进行调查, 对16S rRNA和细菌表皮蛋白(wsp)基因进行扩增, 并对其进行系统进化分析研究, 为进一步深入研究蝙蝠体表蛛蝇和蝠蝇感染沃尔巴克氏体奠定基础。
1 材料与方法 1.1 标本采集于2012-2017年在云南省芒市、腾冲、畹町、孟连、勐腊、祥云、墨江、永德县和保山市共9个采样点采集蝙蝠体表蛛蝇和蝠蝇, 在果园附近或洞穴中利用网捕法, 将捕获到的蝙蝠从挂网取下, 用无菌镊子捕捉蛛蝇和蝠蝇后将蝙蝠放生, 然后进行形态学分类并记录其种类、数量、采集地点和时间等信息, 装至灭菌冻存管内做好标记, 保存在液氮罐中运回实验室, 于-80℃冰箱贮存。
1.2 样本处理将采集的蛛蝇和蝠蝇按照采集时间、地点和种类的不同进行分批研磨(每批1~26只不等)。从液氮罐中取出冻存管, 记录标本号, 在P2实验室的生物安全柜内将蝙蝠体表蛛蝇和蝠蝇迅速倒入预冷的无菌研磨乳钵中进行研磨, 后加入配置好的研磨液(含90% MEM液、10%双抗、1%NaHCO3和1%谷氨酰胺), 均匀研磨后移入1.5 ml离心管中, 离心半径8 cm、10 000 r/min离心1 min, 倒尽上清液, 加200 μl缓冲液, 振荡至彻底悬浮待用。
1.3 DNA的提取沃尔巴克氏体的DNA提取按照天根生化科技公司的TIA Namp Genomic DNA Kit (DP304-03, 中国)提取试剂盒进行提取。在研磨处理好的1.5 ml离心管中的200 μl样品中加入20 μl蛋白酶K混匀, 再加入200 μl裂解液, 70℃孵育10 min, 每管加入200 μl无水乙醇溶液沉淀核酸, 将管内所有液体移入吸附柱内, 离心半径8 cm、12 000 r/min离心30 s, 弃废液后加入缓冲液清洗1次, 12 000 r/min离心30 s, 弃废液后加入漂洗液清洗2次, 12 000 r/min离心30 s, 将吸附柱放入回收管中, 干燥数分钟加入100 μl缓冲液TE洗脱DNA。
1.4 PCR扩增PCR扩增沃尔巴克氏体16S rRNA基因和wsp基因, 引物信息见表 1。PCR反应25 μl体系:2×GoTaq Green Master Mix 12.5 μl, 正、反向引物(10 mmol/L)各0.5 μl, 去离子水8.5 μl, 模板DNA 3 μl。PCR反应条件:WF/WR为94℃预变性3 min, 94℃ 1 min, 52℃ 1 min, 72℃ 1 min, 35个循环, 72℃延伸10 min。wsp 81F/wsp 691R为94℃预变性3 min, 94℃ 30 s, 52℃ 30 s, 72℃ 1 min, 35个循环, 72℃延伸10 min[22-23]。PCR反应结束后, 取2 μl产物进行1%琼脂糖凝胶电泳, 检测扩增效果。
对PCR扩增阳性的产物进行序列测定, 所有测序在生工生物工程(上海)股份有限公司昆明办事处完成。使用DNAStar软件包中的SeqMan对序列片段进行拼接、编辑、校正; 用Clustal X(1.83)软件进行碱基配对以及核苷酸同源性分析; 使用MEGA 5.05软件完成基于Neighbour-Joining(NJ)方法的进化树绘制, Bootstrap值设定为1 000[24]。
2 结果 2.1 蛛蝇和蝠蝇采集结果2012-2017年在9个采集点对蝙蝠体表蛛蝇和蝠蝇进行采集, 采集到蛛蝇48批733只, 蝠蝇6批19只。宿主蝙蝠的种类有6种, 即菊头蝠(Rhinolophus luctus)、水鼠耳蝠(Myotis daubentonii)和棕果蝠(Rousettus leschenaultii), 采集信息见表 2。
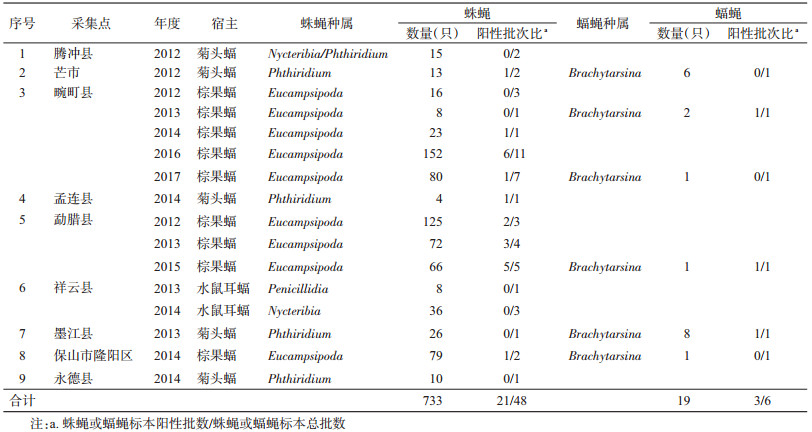
|
利用表 1中的引物从采集到的48批蛛蝇和6批蝠蝇中扩增沃尔巴克氏体的16S rRNA和wsp基因序列。48批蛛蝇标本中扩增出21批阳性(21/48), 其中勐腊县2012、2013和2015年共12批蛛蝇检出10批阳性(10/12);孟连县2014年1批蛛蝇检出阳性(1/1);畹町县2012-2014、2016-2017年共23批蛛蝇检出8批阳性(8/23);芒市2012年1批蛛蝇检出阳性(1/2);保山市隆阳区2014年1批蛛蝇检出阳性(1/2);其他地区腾冲(2012年/2批)、祥云(2013年/1批和2014年/3批)、墨江(2013年/1批)和永德县(2014年/1批)的蛛蝇中未检出沃尔巴克氏体。6批蝠蝇标本中扩增出3批阳性, 其中勐腊(2015年/1批)和墨江县(2013年/1批)均检出阳性; 畹町县(2013年/1批和2017年/1批)仅2013年的1批蝠蝇检测结果为阳性, 而芒市(2012年/1批)和保山市隆阳区(2014年/1批)检测结果均为阴性, 见表 2。
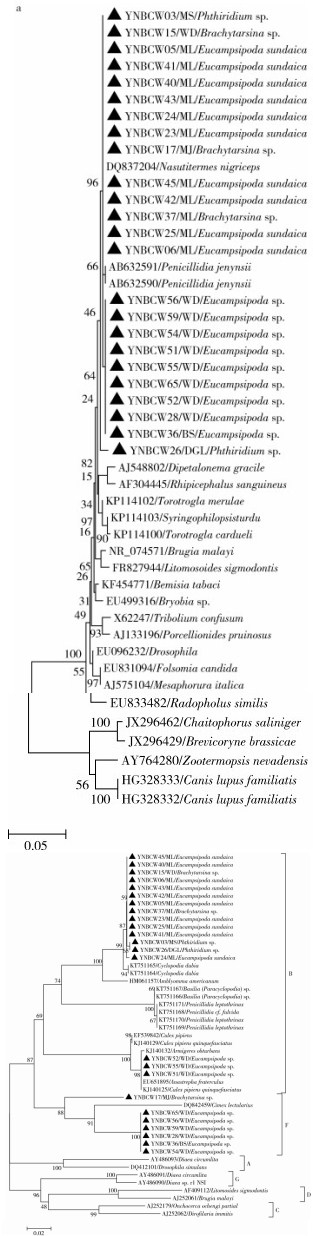
2.3 16S rRNA基因分析基于16S rRNA序列的系统进化分析发现, 沃尔巴克氏体属于同一单元, 并根据该序列约2%的差异可将沃尔巴克氏体属分为2个主要分支[25], 基于16S rRNA序列的系统进化分析提示, 所有的24株沃尔巴克氏体均位于一个大的分支中, 与1株来源于白蚁(DQ837204)和2株(AB632590/AB632591)来源于姜宜笔虱蝇(Penicillidia jenynsii)的沃尔巴克氏体处于一个小的分支(图 1a), 说明云南省蛛蝇和蝠蝇中的沃尔巴克氏体与这3株的进化关系更近。用DNAStar软件包中的SeqMan对24株序列进行拼接、编辑、校正后, 用413 bp大小的序列片段和GenBank中不同宿主来源的23株沃尔巴克氏体的参比序列进行同源性比较和系统进化分析, 结果显示, 24株沃尔巴克氏体间的同源性在98.60%~100%。来源于云南省蛛蝇和蝠蝇的24株沃尔巴克氏体与1株来源于白蚁(DQ837204)的同源性最高达到98.80%~100%;与另外2株(AB632590/AB632591)来源于姜宜笔虱蝇的沃尔巴克氏体同源性在98.30%~100%。
2.4 wsp基因分析随着研究的深入, 发现wsp基因进化速度比16S rDNA和ftsZ等基因快; 基于wsp基因序列2.5%的差异, wsp基因建立的系统进化树将沃尔巴克氏体分为4个组(A~D), 同时又将主要感染昆虫及甲壳类动物的A、B两组细分为12个亚组[23, 26-28]。基于wsp序列的系统进化分析提示, 24株沃尔巴克氏体位于3个分支中, 其中来源于蛛蝇的12株(YNBCW45、40、6、43、42、5、23、25、41、3、26、24)和2株(YNBCW15、37)来源于蝠蝇的沃尔巴克氏体与2株来源于环足虱蝇属(Cyclopodia dubia)KT751165和KT751164的沃尔巴克氏体处于一个分支; 另3株(YNBCW52、55、51)来源于蛛蝇的沃尔巴克氏体与来源于南美按实蝇(Anastrepha fraterculus)EU651895和来源于致倦库蚊(Culex pipiens quinquefasciatus)KJ140125的沃尔巴克氏体处于同一分支, 且这2个分支均属于B大组。来源于蛛蝇的6株(YNBCW65、56、59、28、36、54)和1株(YNBCW17)来源于蝠蝇的沃尔巴克氏体与1株来源于温带臭虫(Cimex lectularius)的沃尔巴克氏体DQ842459处于同一分支, 属于F大组(图 1b)。
|
| 注:▲为本次从云南省蛛蝇和蝠蝇中检测出的沃尔巴克氏体序列 图 1 南省蛛蝇和蝠蝇中沃尔巴克氏体16S rRNA基因(a)和wsp基因(b)系统进化分析 Figure 1 Phylogenetic analyses of the 16S rRNA (a) and wsp (b) genes of Wolbachia from Nycteribiidae and Streblidae in Yunnan province |
| |
用DNAStar软件包中的SeqMan对24株序列进行拼接、编辑、校正后, 用446 bp(B)和45 bp(F)大小的序列片段和GenBank中不同宿主来源的23株沃尔巴克氏体的参比序列进行同源性比较和系统进化分析。结果显示, 24株沃尔巴克氏体间的同源性在79.40%~100%。来源于云南省蛛蝇和蝠蝇的14株沃尔巴克氏体间的同源性为99.60%~100%, 与2株来源于环足虱蝇属(Cyclopodia dubia)KT751165和KT751164的同源性最高达到99.20%~99.40%, 与1株(HM061157)来源于美洲花蜱(Amblyomma americanum)的沃尔巴克氏体同源性在96.00%~96.20%。3株(YNBCW52、55、51)来源于蛛蝇的沃尔巴克氏体间的同源性为100%, 与来源于南美按实蝇EU651895、致倦库蚊KJ140125和骚扰阿蚊(Armigeres obturbans)KJ140132的同源性为99.60%、98.90%和99.40%。来源于云南省蛛蝇和蝠蝇的7株沃尔巴克氏体间的同源性为90.90%~100%, 虽然同属于F大组, 但是蝠蝇来源的YNBCW17与其他蛛蝇来源的6株存在差异, 且在系统进化分析时YNBCW17独立于一个小的分支中; 云南省的7株与来源于温带臭虫的沃尔巴克氏体DQ842459同源性在78.60%~83.30%, 存在较大差异。
3 讨论沃尔巴克氏体是一群细胞内寄生细菌, 不同的生殖表型与细胞质不相容、单性生殖和雄性雌性化等有关。对于沃尔巴克氏体的研究主要以蚊虫、白蚁、臭虫等为主, 其中以蚊虫的感染研究最多最深入, 我国蚊虫体内普遍存在沃尔巴克氏体的感染[29], 其中28.10%的蚊种(包括29.60%伊蚊、42.10%库蚊和50.00%曼蚊)携带沃尔巴克氏体[30], 但对于蝙蝠体表蛛蝇和蝠蝇感染沃尔巴克氏体的研究未见报道。
蝙蝠具有种类繁多、分布广泛和种群数量大的特点[31], 被认为是"具有飞行能力的病毒库", 成为多种人类新发传染病的宿主来源, 近年来发生的多种新发人、畜共患传染病均与蝙蝠有关[32-33]。蛛蝇和蝠蝇是蝙蝠体表寄生的重要吸血昆虫, 体内有共生菌[9-11]、疟疾[12-14]、巴尔通体[15-17]和病毒[18-20]的存在, 充当了蝙蝠携带病原体的"外库"作用。分清蝙蝠体表蛛蝇和蝠蝇感染沃尔巴克氏体的分布、种类是其用于控制蝙蝠及其体表寄生虫传播疾病的前提。
从本研究可知, 云南省9个采集点均采集到蛛蝇, 其中5个采集点(芒市、畹町、孟连、勐腊县和保山市隆阳区)沃尔巴克氏体检测阳性(5/9);5个采集点捕获蝠蝇19只, 包括芒市(6只)、畹町(3只)、勐腊(1只)、墨江(8只)县和保山市隆阳区(1只), 其中3个地点沃尔巴克氏体检测阳性(3/5)。各采集点的样本采集、保存、运输和实验室检测标准均保持一致, 未检测出沃尔巴克氏体的采集点可能是采样带来的选择偏倚。从时间上看, 沃尔巴克氏体在2012年蛛蝇中检出3批(3/10), 蝠蝇中未检出(0/1);2013年蛛蝇中检出3批(3/7), 蝠蝇检出2批(2/2);2014年蛛蝇中检出3批(3/8), 蝠蝇中未检出(0/1);2015年蛛蝇中检出5批(5/5), 蝠蝇检出1批(1/1);2016年蛛蝇中检出6批(6/11);2017年蛛蝇中检出1批(1/7), 蝠蝇未检出。结果显示, 沃尔巴克氏体在云南省蛛蝇和蝠蝇中广泛而长期存在。采集到的48批蛛蝇分属4个属, 其中蛛虱蝇属(Nycteribia, Latreille, 1796)(0/4)和笔虱蝇属(Penicillidia)(0/1)未检出, 蛛虱蝇属(Phthiridium, Hermann, 1804)[34]和Eucampsipoda属[13]中分别检出2批(2/6)和19批(19/37)。蝠蝇均属于蝠虱蝇属(Brachytarsina), 从中检出沃尔巴克氏体3批阳性(3/6)。Wilkinson等[21]的研究结果提示, 在马达加斯加地区的多种蛛蝇中检测到沃尔巴克氏体, 所有在蝙蝠蝇中发现的沃尔巴克氏体均属于F大组。与马达加斯加地区不同的是, 在马达加斯加地区的Eucampsipoda属蛛蝇中并未发现沃尔巴克氏体, 仅在食虫蝙蝠体表蛛蝇内检测出沃尔巴克氏体阳性, 但是在云南省棕果蝠体表的Eucampsipoda属蛛蝇中检出19批阳性(19/37), 沃尔巴克氏体在蛛蝇体内的感染是否因地域的不同而存在差异, 还需扩大范围进行研究。
目前沃尔巴克氏体有A~Q共16个组[35], 本研究基于16S rRNA和wsp基因用PCR方法对云南省9个采集点的蛛蝇和蝠蝇体内沃尔巴克氏体进行检测, 结果蛛蝇的检出率为43.75%(21/48), 蝠蝇的检出率为50.00%(3/6)。16S rRNA基因的系统进化分析, 云南省的24株沃尔巴克氏体均处于同一分支。进一步用wsp基因进行系统进化分析, 云南省24株分布在B大组和F大组, B大组中云南省17株与参比序列的同源性在96.00%~99.60%, 同源性较高, 提示这些序列的变异均未超出目前公布的序列范围。而蛛蝇来源的6株(YNBCW65、56、59、28、36、54)和蝠蝇来源的1株(YNBCW17)沃尔巴克氏体被分到F大组, 其可信度>70为可信, 但是云南省7株与参比序列DQ842459的同源性仅为78.60%~83.30%, 既往的研究表明, wsp基因在16S rRNA、ftsZ、groEL、gltA等用于沃尔巴克氏体的基因中进化速度最快, 其基因重组率也较高[36], 因此, 本研究中F大组中的7株(YNBCW65、56、59、28、36、54、17)有可能为目前未发现的wsp基因序列。但是也有研究表明, 用wsp基因对沃尔巴克氏体进行基因分型会造成聚类混乱的问题, 不能准确地反映沃尔巴克氏体进化的真实情况, 因此这7株(YNBCW65、56、59、28、36、54、17)是否为新发现的wsp基因序列, 还需进一步通过多位点序列分型技术(MLST)来验证[37-38], 目前的分类会随着新的wsp基因型的发现不断进行调整。另一方面沃尔巴克氏体是否能够影响及如何影响蛛蝇和蝠蝇的繁殖, 目前尚未可知, 是亟待研究和解决的问题[21]。
综上所述, 本次调查结果初步反映出云南省蝙蝠体表蛛蝇和蝠蝇感染沃尔巴克氏体的分布情况和种类特征; 该研究结果为沃尔巴克氏体用于蝙蝠体表寄生虫传播疾病的预防控制提供了前提条件, 为下一步的研究提供了科学依据。
| [1] |
郭颂, 凌锋, 王金娜, 等. 浙江省中东部白纹伊蚊共生菌沃尔巴克氏体的调查研究[J]. 中国媒介生物学及控制杂志, 2015, 26(6): 545-549. DOI:10.11853/j.issn.1003.4692.2015.06.002 |
| [2] |
Herting M, Wolbach SB. Studies on rickettsia-like micro-organisms in insect[J]. J Med Res, 1924, 44(3): 329-374. |
| [3] |
Hertig M. The rickettsia, Wolbachia pipientis (gen. et sp.n.) and associated inclusions of the mosquito, Culex pipiens[J]. Parasitology, 1936, 28(4): 453-486. DOI:10.1017/S0031182000022666 |
| [4] |
Hilgenboecker K, Hammerstein P, Schlattmann P, et al. How many species are infected with Wolbachia?-a statistical analysis of current data[J]. FEMS Microbiol Lett, 2008, 281(2): 215-220. DOI:10.1111/j.1574-6968.2008.01110.x |
| [5] |
Zug R, Hammerstein P. Still a host of hosts for Wolbachia:analysis of recent data suggests that 40% of terrestrial arthropod species are infected[J]. PLoS One, 2012, 7(6): e38544. DOI:10.1371/journal.pone.0038544 |
| [6] |
Werren JH. Biology of Wolbachia[J]. Annu Rev Entomol, 1997, 42(1): 587-609. DOI:10.1146/annurev.ento.42.1.587 |
| [7] |
Stouthamer R, Breeuwer JAJ, Hurst GDD. Wolbachia pipientis:Microbial manipulator of arthropod reproduction[J]. Annu Rev Microbiol, 1999, 53: 71-102. DOI:10.1146/annurev.micro.53.1.71 |
| [8] |
Werren JH, Baldo L, Clark ME. Wolbachia:master manipulators of invertebrate biology[J]. Nat Rev Microbiol, 2008, 6(10): 741-751. DOI:10.1038/nrmicro1969 |
| [9] |
Hosokawa T, Nikoh N, Koga R, et al. Reductive genome evolution, host-symbiont co-speciation and uterine transmission of endosymbiotic bacteria in bat flies[J]. ISME J, 2012, 6(3): 577-587. DOI:10.1038/ismej.2011.125 |
| [10] |
Morse SF, Bush SE, Patterson BD, et al. Evolution, multiple acquisition, and localization of endosymbionts in bat flies (Diptera:Hippoboscoidea:Streblidae and Nycteribiidae)[J]. Appl Environ Microbiol, 2013, 79(9): 2952-2961. DOI:10.1128/AEM.03814-12 |
| [11] |
Morse SF, Dick CW, Patterson BD, et al. Some like it hot:evolution and ecology of novel endosymbionts in bat files of cave-roosting bats (Hippoboscoidea, Nycterophiliinae)[J]. Appl Environ Microbiol, 2012, 78(24): 8639-8649. DOI:10.1128/AEM.02455-12 |
| [12] |
Witsenburg F, Salamin N, Christe P. The evolutionary host switches of Polychromophilus:a multi-gene phylogeny of the bat malaria genus suggests a second invasion of mammals by a haemosporidian parasite[J]. Malar J, 2012, 11: 53. DOI:10.1186/1475-2875-11-53 |
| [13] |
Olival KJ, Dick CW, Simmons NB, et al. Lack of population genetic structure and host specificity in the bat fly, Cyclopodia horsfieldi, across species of Pteropus bats in Southeast Asia[J]. Parasit Vectors, 2013, 6: 231. DOI:10.1186/1756-3305-6-231 |
| [14] |
Poinar GO Jr. Vetufebrus ovatus n. sp. (Haemospororida:Plasmodiidae) vectored by a streblid bat fly (Diptera:Streblidae) in Dominican amber[J]. Parasit Vectors, 2011, 4: 229. DOI:10.1186/1756-3305-4-229 |
| [15] |
Morse SF, Olival KJ, Kosoy M, et al. Global distribution and genetic diversity of Bartonella in bat flies (Hippoboscoidea, Streblidae, Nycteribiidae)[J]. Infect Genet Evol, 2012, 12(8): 1717-1723. DOI:10.1016/j.meegid.2012.06.009 |
| [16] |
Kamani J, Baneth G, Mitchell M, et al. Bartonella species in bats (Chiroptera) and bat flies (Nycteribiidae) from Nigeria, West Africa[J]. Vector Borne Zoonotic Dis, 2014, 14(9): 625-632. DOI:10.1089/vbz.2013.1541 |
| [17] |
Brook CE, Bai Y, Dobson AP, et al. Bartonella spp. in fruit bats and blood-feeding ectoparasites in Madagascar[J]. PLoS Negl Trop Dis, 2015, 9(2): e0003532. DOI:10.1371/journal.pntd.0003532 |
| [18] |
Aznar-Lopez C, Vasquez-Moron S, Marston DA, et al. Detection of rhabdovirus viral RNA in oropharyngeal swabs and ectoparasites of Spanish bats[J]. J Gen Virol, 2013, 94: 69-75. DOI:10.1099/vir.0.046490-0 |
| [19] |
Van Vuren PJ, Wiley M, Palacios G, et al. Isolation of a novel fusogenic orthoreovirus from Eucampsipoda africana bat flies in South Africa[J]. Viruses, 2016, 8(3): 65. DOI:10.3390/v8030065 |
| [20] |
Feng Y, Li YY, Fu SH, et al. Isolation of Kaeng Khoi virus (KKV) from Eucampsipoda sundaica bat flies in China[J]. Virus Res, 2017, 238(15): 94-100. DOI:10.1016/j.virusres.2017.06.007 |
| [21] |
Wilkinson DA, Duron O, Cordonin C, et al. The Bacteriome of bat flies (Nycteribiidae) from the Malagasy region:a community shaped by host ecology, bacterial transmission mode, and host-vector specificity[J]. Appl Environ Microbiol, 2016, 82(6): 1778-1788. DOI:10.1128/AEM.03505-15 |
| [22] |
Saurav GK, Daimei G, Rana VS, et al. Detection and localization of Wolbachia in Thrips palmi Karny (Thysanoptera:Thripidae)[J]. India J Microbiol, 2016, 56(2): 167-171. DOI:10.1007/s12088-016-0567-7 |
| [23] |
Zhou WG, Rousset F, O'Neill S. Phylogeny and PCR-based classification of Wolbachia strains using wsp gene sequences[J]. P Proc Roy Soc B:Biol Sci, 1998, 265(1395): 509-515. DOI:10.1098/rspb.1998.0324 |
| [24] |
Lei WW, Guo XY, Fu SH, et al. Isolation of Tibet orbivirus, TIBOV, from Culicoides collected in Yunnan, China[J]. PLoS One, 2015, 10(8): e0139646. DOI:10.1371/journal.pone.0136257 |
| [25] |
Werren JH, Windsor D, Guo LR. Distribution of Wolbachia among Neotropical arthropods[J]. Pros Roy Soc B:Biol Sci, 1995, 262(1364): 197-204. DOI:10.1098/rspb.1995.0196 |
| [26] |
Van Meer MMM, Witteveldt J, Stouthamer R. Phylogeny of the arthropod endosymbiont Wolbachia based on the wsp gene[J]. Insect Mol Biol, 1999, 8(3): 399-408. DOI:10.1046/j.1365-2583.1999.83129.x |
| [27] |
Sakamoto H, Ishikawa Y, Sasaki T, et al. Transinfection reveals the crucial importance of Wolbachia genotypes in determining the type of reproductive alteration in the host[J]. Genet Res, 2005, 85(3): 205-210. DOI:10.1017/S0016672305007573 |
| [28] |
Cordaux R, Michel-Salzat A, Frelon-Raimond M, et al. Evidence for a new feminizing Wolbachia strain in the isopod Armadillidium vulgare:evolutionary implications[J]. Heredity, 2004, 93(1): 78-84. DOI:10.1038/sj.hdy.6800482 |
| [29] |
宋社吾, 赵彤言, 董言德, 等. 我国蚊虫中昆虫共生微生物Wolbachia感染的研究[J]. 中国媒介生物学及控制杂志, 2002, 13(1): 19-21. DOI:10.3969/j.issn.1003-4692.2002.01.006 |
| [30] |
Iturbe-Ormaetxe I, Walker T, O'Neill SL. Wolbachia and the biological control of mosquito-borne disease[J]. EMBO Rep, 2011, 12(6): 508-518. DOI:10.1038/embor.2011.84 |
| [31] |
Calisher CH, Childs JE, Field HE, et al. Bats:important reservoir hosts of emerging viruses[J]. Clin Microbiol Rev, 2006, 19(3): 531-545. DOI:10.1128/CMR.00017-06 |
| [32] |
O'Shea TJ, Cryan PM, Cunningham AA, et al. Bat flight and zoonotic viruses[J]. Emerg Infect Dis, 2014, 20(5): 741-745. DOI:10.3201/eid2005.130539 |
| [33] |
Wynne JW, Wang LF. Bats and viruses:friend or for?[J]. PLoS Pathog, 2013, 9(10): e1003651. DOI:10.1371/journal.ppat.1003651 |
| [34] |
徐保海. 中国虱蝇总科记述(昆虫纲:双翅目)[J]. 中国人兽共患病学报, 2011, 27(1): 67-75. DOI:10.3969/j.issn.1002-2694.2011.01.016 |
| [35] |
Glowska E, Dragun-Damian A, Dabert M, et al. New Wolbachia supergroups detected in quill mites (Acari:Syringophilidae)[J]. Infect Genet Evol, 2015, 30: 140-146. DOI:10.1016/j.meegid.2014.12.019 |
| [36] |
Jiggins FM, Von Der Schulenburg JHG, Hurst GDD, et al. Recombination confounds interpretations of Wolbachia evolution[J]. Proc Biol Sci, 2001, 268(1474): 1423-1427. DOI:10.1098/rspb.2001.1656 |
| [37] |
Baldo L, Hotopp JCD, Jolley KA, et al. Multilocus sequence typing system for the endosymbiont Wolbachia pipientis[J]. Appl Environ Microbiol, 2006, 72(11): 7098-7110. DOI:10.1128/AEM.00731-06 |
| [38] |
胡亚萍, 刘小波, 桑少伟, 等. 多位点序列分型技术在沃尔巴克氏体基因分型中的研究进展[J]. 中国媒介生物学及控制杂志, 2016, 27(2): 197-201. DOI:10.11853/j.issn.1003.8280.2016.02.028 |
 2019, Vol. 30
2019, Vol. 30



