扩展功能
文章信息
- 栗冬梅, 徐兆楠, 朱彩英, 张政, 康央, 张洪江, 宋秀平, 唐承军, 葛军旗
- LI Dong-mei, XU Zhao-nan, ZHU Cai-ying, ZHANG Zheng, KANG Yang, ZHANG Hong-jiang, SONG Xiu-ping, TANG Cheng-jun, GE Jun-qi
- 应用TaqMan探针实时荧光定量PCR法调查北京市部分城郊区鼠传病原体流行状况
- An epidemiologic investigation of rodent-borne pathogens in some suburban areas of Beijing, China
- 中国媒介生物学及控制杂志, 2019, 30(1): 12-17
- Chin J Vector Biol & Control, 2019, 30(1): 12-17
- 10.11853/j.issn.1003.8280.2019.01.003
-
文章历史
- 收稿日期: 2018-09-04
- 网络出版时间: 2018-12-6 20:17
2 北京市朝阳区疾病预防控制中心, 北京 100021;
3 山东大学生命科学学院, 山东 济南 250100
2 Chaoyang District Center for Disease Control and Prevention of Beijing;
3 School of Life Sciences, Shandong University
啮齿动物是陆地上与人类关系密切、种类最丰富的物种之一, 占全部哺乳动物的43%[1], 约2 700种, 近90%的种类可携带200多种病原体, 可致人类疾病的有近60种[2]。在许多情况下, 啮齿动物的栖息和活动区域与人类、家畜及宠物的生活和活动区域重叠或紧密联系, 几乎有人类活动的地方就有啮齿动物, 特别是在家居环境中, 人类有大量机会与其发生接触。此外, 某些半家栖种类在人和野生动物之间架起了桥梁"bridge hosts"[3], 将某些已知或未知的自然疫源性病原体传播给人类, 是重要的疾病传播媒介和病原微生物宿主。调查和监测病原微生物在野生种群中的流行状况, 可以提供传染病疫情研判的基本数据, 科学地预测相关传染病的流行趋势, 有助于采取精确的预防控制措施[4]。
在众多鼠传病原体中, 本研究选取问号钩端螺旋体(Leptospira interrogans)、嗜吞噬细胞无形体(Anaplasma phagocytophilum)、巴尔通体(Bartonella spp.)、恙虫病东方体(Orientia tsutsugamushi)、莫氏立克次体(Rickettsia typhi)和土拉弗朗西斯菌(Francisella tularensis, 土拉菌)这几种重要的人兽共患性虫媒传染病病原微生物作为调查对象。所涉传染病包括钩端螺旋体(钩体)病和地方性斑疹伤寒, 是我国法定传染病; 人粒细胞无形体病和巴尔通体病是新发和再发传染病[5-6]; 恙虫病近年发病呈上升趋势[7]; 地方性斑疹伤寒属于近年被忽视、有潜在流行可能性的传染病[8]; 以及野兔热或称土拉热, 其病原体是潜在的生物恐怖战剂[9]。除钩体经疫水传播, 其余多经过蚤、蜱、螨等吸血节肢动物传播, 所致传染病在我国均有报道, 但在北京地区其相关宿主、传播媒介及人群流行病学研究报道甚少。
北京市地处华北大平原西北角, 介于39°8'~41°05'N, 115°25'~117°30'E之间, 地处中纬度, 具有明显的暖温带半湿润大陆性气候, 地形地貌类型丰富, 既有平原亦有山地丘陵, 自然植被及土壤类型复杂多样, 这使得啮齿动物种类多、分布不均衡。市区和居民区褐家鼠(Rattus norvegicus)及小家鼠(Mus musculus)是优势鼠种, 山地林区以林栖种居多[10], 这些家栖和野生啮齿动物所携带病原谱及差异目前还未见详细研究报道。本研究通过选取这些具有代表性的鼠传病原体作为调查对象, 应用TaqMan探针实时荧光定量PCR(qPCR)技术对北京市部分城郊区的啮齿动物进行调查研究, 探索实施相关鼠传疾病综合监测可行的检测技术方法, 为鼠传疾病的预防控制提供基础数据。
1 材料与方法 1.1 主要仪器设备与试剂CFX96荧光定量PCR仪(BioRad公司, 美国)、32通量核酸提取仪(百泰克生物技术有限公司, 北京)、核酸浓度测定仪NanoDrop-1000(Thermo公司, 美国)。磁珠法组织基因组DNA提取试剂盒AU19014(百泰克生物技术有限公司, 北京)、HR qPCR Master Mix(辉睿生物科技有限公司, 上海)、质粒提取试剂盒(全式金生物技术有限公司, 北京)。
1.2 样本采集2017年在北京市朝阳、怀柔、门头沟和平谷区用夹夜法捕获啮齿动物, 编号登记, 采集其肝、脾等组织样品, -80℃冻存待检。
1.3 样品DNA模板及阳性标准品制备剪取鼠脾组织5~10 mg, 应用磁珠法组织基因组DNA提取试剂盒纯化全基因组, 裂解时间45 min, 其他步骤不变, 150 μl洗脱缓冲液EB溶解核酸, 置于-20℃冻存待检。核酸浓度 < 50 ng/μl或A260/A280比值< 1.8或>2.1时, 重新提取该样品DNA。
1.4 qPCR引物、探针及扩增参数选用文献中报道的引物和探针检测莫氏立克次体、嗜吞噬细胞无形体、恙虫病东方体、土拉菌、巴尔通体和钩体6种病原体(表 1), 探针及引物[11-16]由北京奥科鼎盛生物科技有限公司合成。反应体系为20 μl, 10 μl用于qPCR反应的Taq DNA聚合酶和dNTP混合液HR qPCR Master Mix, 探针0.4 μl(终浓度200 nmol/L), 正、反向引物各0.8 μl(终浓度为400 nmol/L), 去离子水5 μl, DNA模板3 μl。应用伯乐(BioRad, 美国)CFX96荧光定量PCR仪进行扩增, 反应参数:第1步, 95℃ 5 min, 1个循环; 第2步, 95℃ 15 s, 60℃ 45 s, 40个循环。反应设阳性及空白对照, 阳性对照模板为各病原体的靶标序列质粒标准品, 由北京擎科新业生物技术有限公司合成。
将各病原体质粒标准品10倍系列稀释(100~106拷贝数/μl), 制作标准曲线并确定检测限。每个病原体检测方法分别进行6次平行实验, 每次平行实验中每个稀释度做6个平行孔, 最后依据各引物、探针的参考文献及在本实验室条件下产生的数据结果, 重新评估所用方法的检测限。标准曲线及敏感性实验所用扩增酶及反应条件同上。
1.6 统计学处理应用SPSS 24.0软件进行统计分析, 率的比较采用χ2检验和Fisher确切概率法。P < 0.05为差异有统计学意义。
2 结果 2.1 检测方法评估应用TaqMan探针qPCR方法检测各病原体, 在接近检测限时定量循环值(quantification cycle, Cq)开始出现不稳定情况, 即组内及组间均出现2个以上无值孔, 考虑实验重复性(repeatability)和再现性(reproducibility)[17], 为确定阳性判断标准, 将拷贝数最低、孔值稳定出现的Cq值定为检测阈值(表 2)。莫氏立克次体、嗜吞噬细胞无形体、恙虫病东方体、土拉菌、巴尔通体和问号钩端螺旋体的检测阈值分别为Cq ≤ 36(100拷贝数/μl)、Cq ≤ 35(100拷贝数/μl)、Cq ≤ 33(1 000拷贝数/μl)、Cq ≤ 36(100拷贝数/μl)、Cq ≤ 35(1 000拷贝数/μl)和Cq ≤ 35(100拷贝数/μl)。
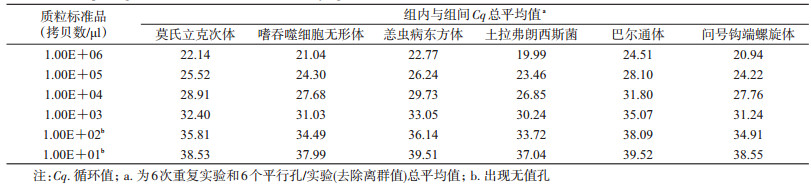
|
4个地区共捕获啮齿动物160只, 朝阳区采样点为城镇居民区, 捕获鼠种主要为褐家鼠和小家鼠, 3个远郊区采样点生境为山区林地, 捕获啮齿动物主要为朝鲜姬鼠(Apodemus peninsulae)和北社鼠(Niviventer confucianus), 另有3只鼩鼱(Sorex spp.)(表 3)。
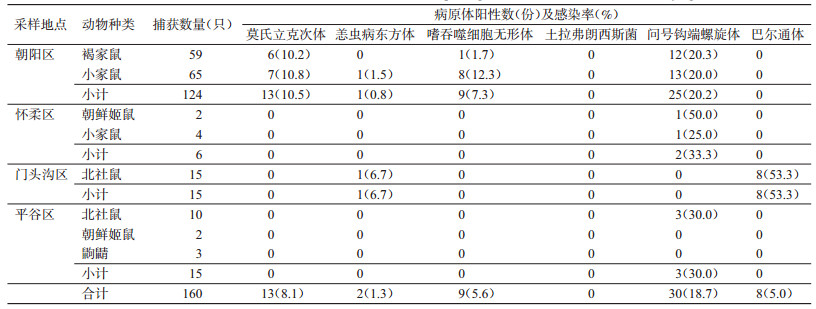
|
各地区捕获的啮齿动物中除土拉菌未检出外, 莫氏立克次体(8.1%)、恙虫病东方体(1.3%)、嗜吞噬细胞无形体(5.6%)、问号钩端螺旋体(18.7%)和巴尔通体均有检出(5.0%)(表 3), 不同病原体感染率差异有统计学意义(χ2=36.806, P=0.000)。
捕获的4种啮齿动物均检出病原体, 同一鼠种各病原体感染率不同(表 4)。小家鼠检出4种病原体, 钩体感染率为20.3%, 高于恙虫病东方体的感染率(1.4%), 且差异有统计学意义(χ2=12.641, P=0.000);莫氏立克次体(10.1%)、恙虫病东方体(1.4%)和嗜吞噬细胞无形体(11.6%)的感染率差异无统计学意义(P>0.05)。褐家鼠检出3种病原体, 问号钩端螺旋体、莫氏立克次体和嗜吞噬细胞无形体感染率分别为20.3%、10.2%和1.7%;其中, 问号钩端螺旋体感染率高于嗜吞噬细胞无形体(χ2=10.460, P=0.001);莫氏立克次体与问号钩端螺旋体、嗜吞噬细胞无形体的感染率差异均无统计学意义(χ2=2.360, P=0.124; χ2=2.430, P=0.119)。北社鼠检出恙虫病东方体(4.0%)、巴尔通体(32.0%)和问号钩端螺旋体(12.0%), 三者感染率差异均无统计学意义(χ2=7.738, P=0.021);4只朝鲜姬鼠检出了问号钩端螺旋体(25.0%)。
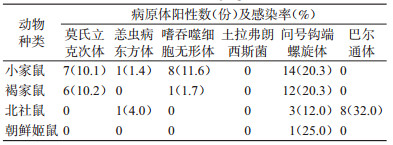
|
不同鼠种同一病原体的感染率差异均无统计学意义。小家鼠与褐家鼠的莫氏立克次体感染率分别为10.1%和10.2%(χ2=0.000, P=0.996);小家鼠与北社鼠的恙虫病东方体感染率分别为1.4%和4.0%(P=0.463);小家鼠与褐家鼠的嗜吞噬细胞无形体感染率分别为11.6%和1.7%(χ2=3.374, P=0.066);小家鼠、褐家鼠、北社鼠和朝鲜姬鼠的问号钩端螺旋体感染率分别为20.3%、20.3%、12.0%和25.0%(χ2=1.027, P=0.795)。
2.4 动物复合感染病原体情况由表 5可见, 在朝阳区捕获的3只褐家鼠和9只小家鼠携带2种以上病原体, 共计12只动物个体存在复合感染现象, 占所捕获啮齿动物的7.5%(12/160), 占总带菌动物的19.4%(12/62)。其中1只褐家鼠感染问号钩端螺旋体和嗜吞噬细胞无形体、2只褐家鼠感染问号钩端螺旋体和莫氏立克次体; 5只小家鼠感染问号钩端螺旋体和莫氏立克次体、3只小家鼠感染问号钩端螺旋体和嗜吞噬细胞无形体、1只小家鼠感染恙虫病东方体、嗜吞噬细胞无形体和莫氏立克次体。2个鼠种不同病原体复合感染率差异无统计学意义(χ2=2.371, P=0.124)。

|
病原微生物对其动物宿主或其侵袭的偶然宿主组织器官具有选择性, 也即组织细胞亲嗜性, 因此, 调查动物宿主的病原体携带情况要依据该病原体的组织亲嗜性特征选择靶器官或组织样品进行检测。脾是重要的淋巴器官, 参与机体免疫防御功能, 具有大量血窦, 是机体血液循环的一个过滤器, 血液中的多数病原体从此经过, 或被清除、储留或再次进入血液循环。脾组织带菌与否可以一定程度反映动物是否存在或曾发生过菌血症, 这一状态是很多动物作为传播宿主的一个窗口期, 可通过吸血节肢动物吸食带菌血液传播给其他个体或人类, 或者通过动物之间的争斗撕咬互相传播。某些肠道细菌最先在体内作用的部位甚至也是脾脏[18]。此外, 夹夜法捕获的动物多已死亡, 不能收集血液, 脾也是较为方便的采集目标。同时, 考虑到本次调查的病原体侵袭器官都包括脾脏, 因此, 选择脾组织提取核酸进行检测。
本次调查的检测方法全部采用qPCR技术, 具有高灵敏度和高特异性, 操作简便快速且污染少, 相比较传统的细菌培养、常规PCR和血清学方法明显提高检测实效, 适用于传染病病原体的筛查和监测。该技术方法在病原微生物和毒素、食品及动植物检疫、肿瘤及遗传疾病的诊断等领域已被科研、临床及检验检疫部门等实验室广泛采用, 随着定量PCR仪的普及已展现出取代常规PCR检测病原微生物的趋势[19]。因此, 本研究选择TaqMan探针qPCR技术检测6种鼠传病原体, 综合调查采样地区的啮齿动物感染情况。虽然本研究所选择的检测方法是已经验证有较高检测效能的, 但是由于仪器设备、检测试剂、操作人员等差别可能造成检测阈值变化, 因此, 在本地实验室应用前应重新评估方法, 以便选择高敏感度、特异性好的方法, 确认方法的可靠性和重复性, 并确定结果判断标准。评估实验主要考虑方法的重复性, 在接近检测限时出现不稳定值, 应采用较严谨的阈值设定标准, 便于结果判断一致性和避免出现假阳性。实验中还发现, 当更换定量PCR仪时, 阳性对照及阳性样品的Cq值会发生变化(数据未显示)。因此, 在使用不同厂家及型号的设备时应该重新测试标准曲线及检出限, 并制定新的Cq值作为检测阈值。
在本次调查中捕获动物以北京市城区家鼠为主, 除土拉菌外, 莫氏立克次体、恙虫病东方体、嗜吞噬细胞无形体、问号钩端螺旋体和巴尔通体均有检出, 褐家鼠和小家鼠带菌种类及感染率较高, 并出现多种细菌复合感染情况。调查结果表明, 这些病原体在北京市啮齿动物种群中自然存在, 且在与人居环境较为接近的家鼠鼠群中较为流行, 对居民健康构成威胁。动物个体复合感染多种微生物在自然界并不少见[3], 这增加了相应病原体的传播概率, 使得居民接触带菌动物后发生相关疾病的风险增加[20-21]。巴尔通体和立克次体类病原体可通过媒介节肢动物进行传播, 引起的疾病多无典型临床表现, 发热者居多, 因此, 关注此类疾病应注意不明原因发热人群。近年来我国恙虫病发病人数上升趋势明显[7], 北京地区亦有病例发生[22], 部分病例没有特异性焦痂或溃疡, 极易误诊。恙螨是该病的主要宿主和传播媒介, 啮齿动物是重要的带菌动物, 流行地区啮齿动物的自然感染率往往较高, 因此, 进行啮齿动物和媒介恙螨的调查与监测是防治恙虫病的基础和必要工作。本次调查感染率最高的病原体为问号钩端螺旋体, 此菌引起钩体病呈全球性分布, 在我国主要分布在长江流域及以南广大地区, 啮齿动物和猪是主要传染源。北方如河北、辽宁省等地或因大雨、洪水均有不同程度的钩体病流行, 北京地区也曾有因在水库游泳而暴发疫情的报道[23]。近年来北京地区虽少见人类钩体病的报道, 但对宿主动物如犬和猪等家畜、宠物的调查阳性报道较多[24-26], 啮齿动物调查不多见。北京市近年夏季降雨增多, 局部地区时常发生积水、甚至山洪, 水灾发生后人类及啮齿动物的生活及栖居环境和行为发生变化, 彼此发生直接和间接接触的机会增多, 增加了这一传染病的发生风险[27], 应予以关注。
本研究选取了6种有代表性的鼠传病原体在北京部分地区进行啮齿动物带菌情况调查, 初步探索了样品采集、检测方法和结果处理的综合监测筛检方法。结果证明, 脾组织适用于监测这些鼠传病原体, 有相关研究报道不同组织器官的染菌情况有差别[28], 这有待于更深入的调查验证。目前所用qPCR检测方法均适用于此类调查, 但是受限于工作通量, 只能进行一对一单病原体检测, 因此, 为提高病原体综合监测能力, 应进一步探索优化更加快速、完备的检测手段, 如利用高通量测序和宏基因组技术可以应对更多的鼠传病原微生物甚至未知病原体和疾病(Disease X)[29-30]。在综合监测中, 结果处理还应结合当地的地理、气候、生态环境、传染病历史和流行数据等信息综合分析, 通过收集野生动物个体及野生动物种类、分布、病原体和体表寄生虫携带等传染病相关生物、地理和流行病学数据, 建立相关传染病的综合网络信息系统, 能够指示热点并提前预警, 这应该是鼠传疾病综合监测在建立大健康体系和目标中的任务。
志谢 中国疾病预防控制中心传染病预防控制所钩端螺旋体病研究室蒋秀高研究员、张翠彩博士在钩体检测方法评估实验中给予指导和帮助; 鼠疫室李伟副研究员共同讨论土拉菌检测方法及提供帮助, 特此志谢| [1] |
Huchon D, Madsen O, Sibbald MJJB, et al. Rodent phylogeny and a timescale for the evolution of Glires:evidence from an extensive taxon sampling using three nuclear genes[J]. Mol Biol Evol, 2002, 19(7): 1053-1065. DOI:10.1093/oxfordjournals.molbev.a004164 |
| [2] |
Meerburg BG, Singleton GR, Kijlstra A. Rodent-borne diseases and their risks for public health[J]. CRC Crit Rev Microbiol, 2009, 35(3): 221-270. DOI:10.1080/10408410902989837 |
| [3] |
Bordes F, Blasdell K, Morand S. Transmission ecology of rodent-borne diseases:new frontiers[J]. Integr Zool, 2015, 10(5): 424-435. DOI:10.1111/1749-4877.12149 |
| [4] |
Wolfe ND, Dunavan CP, Diamond J. Origins of major human infectious diseases[J]. Nature, 2007, 447(7142): 279-283. DOI:10.1038/nature05775 |
| [5] |
Bakken JS, Dumler JS. Human granulocytic anaplasmosis[J]. Infect Dis Clin North Am, 2015, 29(2): 341-355. DOI:10.1016/j.idc.2015.02.007 |
| [6] |
Failloux AB, Moutailler S. Zoonotic aspects of vector-borne infections[J]. Rev Sci Tech, 2015, 34(1): 165-283. DOI:10.20506/rst.issue.34.1.58 |
| [7] |
李贵昌, 栗冬梅, 李焱, 等. 2006-2016年我国恙虫病流行特征分析[J]. 疾病监测, 2018, 33(2): 139-143. DOI:10.3784/j.issn.1003-9961.2018.02.007 |
| [8] |
孙印旗, 董妥, 姜霞, 等. 2009-2012年河北鼠型斑疹伤寒流行概况及实验室调查分析[J]. 中国人兽共患病学报, 2015, 31(6): 552-555. DOI:10.3969/cjz.j.issn.1002-2694.2015.06.012 |
| [9] |
Bossi P, Bricaire F. Tularemia, a potential bioterrorism weapon[J]. Presse Med, 2003, 32(24): 1126-1130. |
| [10] |
贾延库, 高永荣, 陈长安, 等. 北京地区啮齿动物种类和地理分布调查[J]. 中国媒介生物学及控制杂志, 1999, 10(2): 87-90. DOI:10.3969/j.issn.1003-4692.1999.02.004 |
| [11] |
杨晓, 陈梅玲, 温博海, 等. 实时荧光定量PCR检测莫氏立克次体[J]. 解放军医学杂志, 2007, 32(10): 1054-1056. DOI:10.3321/j.issn:0577-7402.2007.10.016 |
| [12] |
张晶波, 温博海, 陈梅玲, 等. 荧光定量PCR检测嗜吞噬细胞无形体[J]. 中国人兽共患病学报, 2006, 22(4): 289-293. DOI:10.3969/j.issn.1002-2694.2006.04.001 |
| [13] |
付秀萍, 贺金荣, 张景山, 等. TaqMan-MGB探针实时荧光定量PCR检测恙虫病东方体方法的建立[J]. 中国媒介生物学及控制杂志, 2012, 23(2): 108-110. |
| [14] |
史清海, 曲识, 周冬生, 等. 应用TaqMan荧光定量PCR检测土拉弗朗西斯菌[J]. 生物技术通讯, 2009, 20(6): 806-809. |
| [15] |
Diaz MH, Bai Y, Malania L, et al. Development of a novel genus-specific real-time PCR assay for detection and differentiation of Bartonella species and Genotypes[J]. J Clin Microbiol, 2012, 50(5): 1645-1649. |
| [16] |
张翠彩, 李秀文, 聂一新, 等. 致病性钩端螺旋体TaqMan Real-time PCR检测技术的建立及其应用[J]. 中华流行病学杂志, 2011, 32(10): 1018-1021. DOI:10.3760/cma.j.issn.0254-6450.2011.10.015 |
| [17] |
Bustin SA, Benes V, Garson JA, et al. The MIQE guidelines:Minimum/information for publication of quantitative real-time PCR experiments[J]. Clin Chem, 2009, 55(4): 611-622. DOI:10.1373/clinchem.2008.112797 |
| [18] |
Conlan JW. Early host-pathogen interactions in the liver and spleen during systemic murine listeriosis:an overview[J]. Immunobiology, 1999, 201(2): 178-187. DOI:10.1016/S0171-2985(99)80057-6 |
| [19] |
Maurin M. Real-time PCR as a diagnostic tool for bacterial diseases[J]. Expert Rev Mol Diagn, 2012, 12(7): 731-754. DOI:10.1586/erm.12.53 |
| [20] |
Telfer S, Lambin X, Birtles R, et al. Species interactions in a parasite community drive infection risk in a wildlife population[J]. Science, 2010, 330(6001): 243-246. DOI:10.1126/science.1190333 |
| [21] |
Schmidt S, Essbauer SS, Mayer-Scholl A, et al. Multiple infections of rodents with zoonotic pathogens in Austria[J]. Vector Borne Zoonotic Dis, 2014, 14(7): 467-475. DOI:10.1089/vbz.2013.1504 |
| [22] |
张鑫, 邢海英, 张凤革, 等. 北京市平谷区恙虫病134例临床特征分析[J]. 浙江临床医学, 2014, 16(7): 1079-1080. |
| [23] |
董翠珍, 李文靖. 昌平县钩端螺旋体病感染状况调查[J]. 中国人兽共患病杂志, 1995, 15(5): 133. |
| [24] |
齐海霞, 张海云, 邓小雨, 等. 犬、猫钩端螺旋体病的流行病学调查[J]. 中国畜牧兽医, 2012, 39(11): 203-206. DOI:10.3969/j.issn.1671-7236.2012.11.047 |
| [25] |
肖园, 吴海燕, 孙艳争, 等. 犬钩端螺旋体病3例报告[J]. 中国人兽共患病学报, 2017, 33(5): 469-471. DOI:10.3969/j.issn.1002-2694.2017.05.016 |
| [26] |
王雅琴, 张海云, 唐艳荣, 等. 2016年朝阳区动物诊疗机构犬狂犬病和A型流感的流行病学调查报告[J]. 中国畜牧兽医文摘, 2017, 33(11): 124-126. |
| [27] |
Diaz JH. Recognition and management of rodent-borne infectious disease outbreaks after heavy rainfall and flooding[J]. J La State Med Soc, 2014, 166(5): 186-192. |
| [28] |
Villette P, Afonso E, Couval G, et al. Consequences of organ choice in describing bacterial pathogen assemblages in a rodent population[J]. Epidemiol Infect, 2017, 145(14): 3070-3075. DOI:10.1017/S0950268817001893 |
| [29] |
Galan M, Razzauti M, Bard E, et al. 16S rRNA amplicon sequencing for epidemiological surveys of bacteria in wildlife[J]. mSystems, 2016, 1(4): e00032-16. DOI:10.1128/mSystems.00032-16 |
| [30] |
World Health Organization. 2018 annual review of diseases prioritized under the research and development blueprint[R]. Geneva: WHO, 2018: 2, 9.
|
 2019, Vol. 30
2019, Vol. 30



