扩展功能
文章信息
- 刘阳, 张韶华, 梁焯南, 朱毅朝, 梁桂
- LIU Yang, ZHANG Shao-hua, LIANG Zhuo-nan, ZHU Yi-chao, LIANG Gui
- 广东省深圳市2017年褐家鼠对抗凝血杀鼠剂抗药性研究
- Study on resistance of commensal rats (Rattus norvegicus) to anticoagulant rodenticides in Shenzhen
- 中国媒介生物学及控制杂志, 2018, 29(6): 617-620
- Chin J Vector Biol & Control, 2018, 29(6): 617-620
- 10.11853/j.issn.1003.8280.2018.06.016
-
文章历史
- 收稿日期: 2018-06-24
- 网络出版时间: 2018-10-16 07:57
2 深圳市城市管理局, 广东 深圳 518036
2 Shenzhen Municipal Bureau for Urban Administration
深圳市地处华南地区南部,气候温暖潮湿,非常适合鼠类的繁衍生息,同时密集的人口产生的厨余垃圾给鼠类提供了充足的食物来源,城市化又给鼠类提供了多样的隐蔽栖息地,鼠类密度高,控制难度大,肾综合征出血热等鼠传疾病时有发生[1],近年来鼠疫等在世界各地有死灰复燃的趋势,深圳市作为重要港口城市,存在较大的输入和扩散风险。因此有效控制深圳市鼠类密度,对防止鼠传疾病发生流行、确保居民生命健康有着重要意义。随着深圳市城镇化水平提高,鼠类密度监测的优势鼠种构成已从褐家鼠(Rattus norvegicus)与黄胸鼠(R. tanezumi)各占一半逐渐变为以褐家鼠为绝对优势种类[2],因此,褐家鼠是城区灭鼠主要防治目标。深圳市主要采用化学杀鼠剂开展鼠类防制,第一代抗凝血杀鼠剂从1986年开始使用[3],在深圳市创建卫生城市、全面灭鼠中发挥了重要作用,之后更高效的第二代抗凝血杀鼠剂如溴敌隆、溴鼠灵等出现,在近10年的灭鼠工作中逐渐代替第一代杀鼠剂占领主导地位。而随着抗凝血杀鼠剂的普及和长期大量使用,可能在家栖鼠种群中产生抗药性,引起灭鼠药物效果降低,继而导致防制失败。为掌握深圳市家栖鼠类对第一、二代抗凝血杀鼠剂的抗药性发生情况,科学指导防制合理用药,我们于2017年7-12月开展了褐家鼠抗药性监测研究。
1 材料与方法 1.1 药物来源与配制采用95%溴敌隆原药及96%杀鼠灵原药作为实验药物,前者由汕头市农业科学研究所提供,后者由湛江市鼠疫防治所提供。将原药混合优质淀粉配成1%母粉,再使用花生油作为粘合剂将母粉与新鲜大米混合制成0.005%的毒饵供试。
1.2 试鼠捕捉与选择采用笼诱法捕鼠,于2017年7-12月,在深圳市的光明、龙岗、坪山、南山区共选择8个街道作为监测点,每个监测点布放鼠笼100~200个,诱饵为烧鸭、猪油渣,于20:00布放,翌日08:00收笼,对捕获鼠进行初筛,淘汰残疾、疑似患病、衰老及过小的个体,选择毛色光鲜、行动活泼的个体,保留的个体送至实验室饲养。
1.3 实验方法将筛选后的试鼠鉴别雌雄、称重、编号后分笼单独饲养,饲养笼规格40 cm×30 cm×30 cm,适应饲养1周后,再选择成年(体质量≥80 g)、非孕、无外伤的健康鼠进行攻毒实验。喂毒前先提供足量无毒饵料2 d,每天称消耗量并更换新饵,淘汰第2天饵料消耗量不到全部试鼠平均消耗量20%的个体。之后进行食毒期实验,连续6 d供给足量的0.005%毒饵(40 g/d),每天对毒饵称重并更换新毒饵,淘汰食毒第1天消耗量不到前1天10%的个体。食毒期实验结束后将鼠转移至干净饲养笼正常饲养14 d,观察并记录鼠的中毒表现和死亡情况,并对死鼠进行解剖,淘汰实验期产仔或实验结束还存活且食药剂量未达到12 mg /kg的个体数据。
1.4 数据处理使用WPS Excel 2016软件进行数据录入和整理,使用SPSS 16.0软件对数据进行统计描述和统计分析。褐家鼠雌、雄之间和不同监测点之间致死剂量的比较采用t检验。P<0.05为差异有统计学意义。
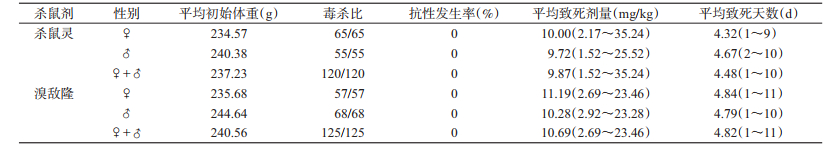
2 结果 2.1 褐家鼠对第一、二代抗凝血杀鼠剂抗药性发生率共测试褐家鼠245只(其中雄性123只,雌性122只),平均体质量为238.93 g,标准差84.19 g。使用0.005%杀鼠灵处理褐家鼠120只(其中雌性65只,雄性55只),结果显示未出现抗药性个体,抗药性发生率为0;使用0.005%溴敌隆处理褐家鼠125只(其中雌性57只,雄性68只),结果显示未出现抗药性个体,抗药性发生率为0,见表 1。
|
如表 1所示,杀鼠灵平均致死剂量为9.87 mg/kg,摄食杀鼠灵毒饵致死的试鼠中最敏感的个体为雄性,体质量为395 g,摄药剂量为1.52 mg/kg;最不敏感个体为雌性,体质量为83 g,摄药剂量为35.24 mg/kg,两者摄药剂量相差22.18倍,不同性别最不敏感个体与最敏感个体比较,雄性为16.79倍,雌性为16.24倍,雌、雄间致死剂量差异无统计学意义(t=-0.144,P=0.886)。
溴敌隆平均致死剂量为10.69 mg/kg,摄食溴敌隆毒饵致死的试鼠中最敏感个体为雌性,体质量为372 g,摄药剂量为2.69 mg/kg,最不敏感个体为雌性,体质量为81 g,摄药剂量为23.46 mg/kg,两者摄药剂量相差7.72倍。雄性最不敏感个体与最敏感个体比较相差7.97倍,雌、雄间致死剂量差异无统计学意义(t=1.032,P=0.304)。
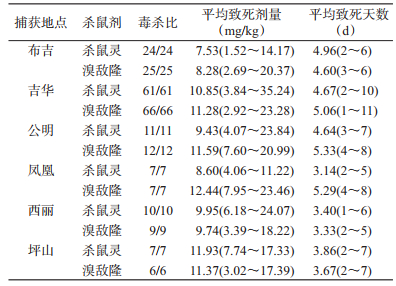
2.3 不同监测点褐家鼠抗药性测试结果如表 2所示,杀鼠灵平均致死剂量最低的是布吉监测点,为7.53 mg/kg,最高的是坪山监测点,为11.93 mg/kg,两者相差0.58倍,2个监测点的试鼠致死剂量差异有统计学意义(t=-2.074,P=0.047);溴敌隆平均致死剂量最低的是布吉监测点,为8.28 mg/kg,最高的是凤凰监测点,为12.44 mg/kg,两者相差0.50倍,2个监测点的试鼠致死剂量差异有统计学意义(t=-2.037,P=0.013)。
经观察和解剖发现,试鼠均出现不同程度的中毒症状,主要症状有活动缓慢,口鼻出血,心、肺、肝脏等脏器出血以及睾丸出血等。如图 1所示,杀鼠灵和溴敌隆死亡时间的个体数量符合正态分布;杀鼠灵死亡时间最早为2 d,最迟为10 d,高峰期为3~5 d,最高峰为3 d,平均为4.51 d,标准差为1.70 d;溴敌隆死亡时间最早为2 d,最迟为11 d,高峰期为3~5 d,最高峰为4 d,平均为4.88 d,标准差为1.74 d。
目前,世界上一些国家和地区如英国、印度等均有褐家鼠对第二代抗凝血杀鼠剂溴敌隆产生抗药性的报道[4-5],我国近几年各地的监测报告显示,也有部分地区的褐家鼠对溴敌隆产生了抗药性,如成都市褐家鼠对溴敌隆抗性率为6.0%[6],上海市虹口区的抗性率为3.7%[7];而当前各地褐家鼠对杀鼠灵的抗药性监测结果多为敏感,如成都市[6]、上海市[7-8]、南通市[9]的报告均显示褐家鼠对杀鼠灵的抗性率为0,咸宁市自2008年检出1只抗性鼠后,连续4年未检出杀鼠灵抗性个体[10]。
深圳市曾经在1991和1998年开展过鼠类抗药性监测[3, 11],根据深圳市爱国卫生运动委员会办公室1998年的监测结果,褐家鼠对杀鼠灵抗药性发生率为3.3%,平均致死剂量为12.8 mg/kg,而本次监测未检出抗药性个体,平均致死剂量为9.87 mg/kg,有较明显的下降。推断其原因,深圳市自10年前开始引进毒力更高的第二代抗凝血杀鼠剂,第一代抗凝血杀鼠剂使用相对越来越少,目前几乎无人使用,因此在较低的选择压力下褐家鼠的敏感性可能逐渐升高。同时溴敌隆监测结果未出现抗药性,与上海市的监测结果一致[8, 12],其原因:①可能是目前监测点溴敌隆的使用频率未达到可形成抗性种群的水平,褐家鼠对该药物仍然敏感;②由于现有的鼠类抗药性监测方法还没有针对溴敌隆等二代杀鼠剂的抗性判断标准,本实验参考了邓良利等[6]、徐仁权等[13]的方法,使用杀鼠灵的毒饵浓度与攻毒时间开展实验,其抗性判断标准的可靠性还有待进一步求证。
野鼠相对其他病媒生物有着难获取、在实验室条件下难饲养、难大量繁殖的特点,目前鼠类抗药性监测的规范方法多采用1991年全国鼠类协作组规定的方法[14],操作较为繁琐,工作量大,一般单位难以广泛开展,生物安全性也是一个需要解决的问题(为防止疾病感染,可能需要成本较高的负压饲养箱),因此有待出台更高效的检测方法标准。维生素K环氧化物还原酶(VKORC)是抗凝血杀鼠剂的主要靶标酶[15],其活性改变可以影响鼠类对抗凝血剂的敏感性,目前也有一些研究使用凝血反应来检测鼠类VKORC活动性从而判断鼠抗药性产生情况[16-17],该方法相比喂食实验较为简便,但仍存在操作复杂、实验周期长等问题[18];当前一些国家已利用VKORC基因检测反映鼠类种群抗药性发展情况[19-21],该方法主要基于PCR、基因测序等分子生物学技术,只需少量DNA即可开展检测,实验周期短、成本低[22],有较大推广前景,但目前我国对鼠类抗性基因位点的基础研究相对较少,若要将此方法标准化还需要进行更全面的探索研究。
本次调查结果显示,在多年使用抗凝血杀鼠剂后,深圳市褐家鼠的抗药性仍然保持敏感水平,由于条件限制,目前仅在4个行政区开展了鼠类抗药性监测,若要代表全市褐家鼠的抗药性水平,需要进一步开展全面监测实验。虽然未出现抗药鼠个体,但个体之间对抗凝血杀鼠剂的敏感性差别较大,而且不同监测点之间褐家鼠的敏感性也产生了显著区别,因此有可能产生抗药性的种群,应继续开展鼠类抗药性监测,从而及时掌握深圳市家栖鼠抗药性发展动态。虽然抗药性监测结果显示敏感,但深圳市经常有防制部门反映抗凝血药物灭鼠效果下降的情况,究其原因,可能是部分地区未能按规定使用鼠药导致。经调查,深圳市目前普遍存在鼠药使用不当的问题,如毒鼠屋设置过少,有毒鼠屋但无鼠药,未及时补投吃完的鼠药,未及时更换发霉变质的鼠药等。因此,建议有关部门加强防制队伍管理,同时对鼠类防制人员开展鼠药灭鼠技术培训,规范鼠药投放流程,从而提升深圳市鼠类化学防控效果。此外,在防制中选择药物的适口性也是影响鼠类防制效果非常重要的一个因素[23],不同的鼠药产品虽然有效成分类似,但适口性上的差别可能导致鼠类的行为抗性,因此在防制过程中需要多观察实践,在考虑成本、安全性、毒力等因素的同时,尽量选择适口性好的杀鼠剂品种。
| [1] |
蔡春林, 陈戊申, 陈伟红, 等. 深圳地区流行性出血热疫点鼠类汉坦病毒血清学调查研究[J]. 中国卫生检验杂志, 2017, 27(1): 127-128. |
| [2] |
王敬忠, 李怀昕, 谢旭, 等. 深圳市鼠疫宿主动物及媒介监测分析[J]. 实用预防医学, 2011, 18(11): 2061-2063. DOI:10.3969/j.issn.1006-3110.2011.11.012 |
| [3] |
练春林, 吴利平. 深圳市褐家鼠对杀鼠灵抗药性调查[J]. 中国国境卫生检疫杂志, 1993, 16(5): 291-292. DOI:10.16408/j.1004-9770.1993.05.017 |
| [4] |
Garg N, Singla N, Jindal V, et al. Studies on bromadiolone resistance in Rattus rattus populations from Punjab, India[J]. Pestic Biochem Physiol, 2017, 139: 24-31. DOI:10.1016/j.pestbp.2017.04.005 |
| [5] |
Buckle A. Anticoagulant resistance in the United Kingdom and a new guideline for the management of resistant infestations of Norway rats (Rattus norvegicus Berk[J]. Pest Manag Sci, 2013, 69(3): 334-341. DOI:10.1002/ps.3309 |
| [6] |
邓良利, 马林, 刘竹, 等. 成都地区褐家鼠对杀鼠灵和溴敌隆的抗药性调查[J]. 医学动物防制, 2013, 29(4): 367-368, 371. |
| [7] |
王飞, 蒋璐, 宋长飞, 等. 褐家鼠对杀鼠灵和溴敌隆抗药性的测定[J]. 中华卫生杀虫药械, 2014, 20(4): 326-328. |
| [8] |
徐仁权, 刘洪霞, 张春哲, 等. 上海地区家栖鼠对抗凝血杀鼠剂的抗药性现状调查[J]. 中华卫生杀虫药械, 2013, 19(1): 20-25. |
| [9] |
王智泉, 章士军, 陈郁, 等. 南通市褐家鼠对杀鼠灵的抗药性研究[J]. 医学动物防制, 2011, 27(12): 1106-1107. DOI:10.3969/j.issn.1003-6245.2011.12.010 |
| [10] |
李华民, 高燕, 谭梁飞. 咸宁市褐家鼠对杀鼠灵的抗药性研究[J]. 中华卫生杀虫药械, 2014, 20(1): 43-44. |
| [11] |
冯南贵, 欧扬, 欧汉标, 等. 深圳市褐家鼠对抗凝血剂的抗药性监测[J]. 中国媒介生物学及控制杂志, 1999, 10(6): 467-468. DOI:10.3969/j.issn.1003-4692.1999.06.025 |
| [12] |
杨迎宇, 孙春卫, 李明珠. 上海市宝山区黄胸鼠和褐家鼠对溴敌隆的抗药性调查[J]. 中国媒介生物学及控制杂志, 2014, 25(4): 359-360. DOI:10.11853/j.issn.1003.4692.2014.04.021 |
| [13] |
徐仁权, 朱江, 任文军, 等. 上海地区家栖鼠对杀鼠灵和溴敌隆抗药性研究[J]. 中国媒介生物学及控制杂志, 2005, 16(6): 427-429. DOI:10.3969/j.issn.1003-4692.2005.06.006 |
| [14] |
鼠类抗药性监测协作组. 家栖鼠对抗凝血灭鼠剂抗药性的检验方法[J]. 中国媒介生物学及控制杂志, 1991, 2(5): 339-340. |
| [15] |
孙毅, 郭天宇, 董天义. 家栖鼠抗药性研究进展[J]. 中华卫生杀虫药械, 2004, 10(3): 164-167. DOI:10.3969/j.issn.1671-2781.2004.03.011 |
| [16] |
孙毅, 郭天宇, 董天义, 等. 应用凝血反应检测杀鼠灵抗药性褐家鼠的可行性研究[J]. 兽类学报, 2006, 26(2): 176-182. DOI:10.3969/j.issn.1000-1050.2006.02.011 |
| [17] |
Garg N, Singla N. Blood clotting response test for detecting resistance to second generation anticoagulant bromadiolone in house rat (Rattus rattus)[J]. Indian J Anim Res, 2015, 49(5): 607-611. DOI:10.18805/ijar.5571 |
| [18] |
邓良利, 孙毅, 田汶佳. 成都地区抗药性褐家鼠维生素K环氧化物还原酶编码基因的变异[J]. 医学动物防制, 2016, 32(12): 1353-1355, 1417. |
| [19] |
Runge M, von Keyserlingk M, Braune S, et al. Distribution of rodenticide resistance and zoonotic pathogens in Norway rats in Lower Saxony and Hamburg, Germany[J]. Pest Manage Sci, 2013, 69(3): 403-408. DOI:10.1002/ps.3369 |
| [20] |
Meerburg BG, van Gent-Pelzer MP, Schoelitsz B, et al. Distribution of anticoagulant rodenticide resistance in Rattus norvegicus in the Netherlands according to Vkorc1 mutations[J]. Pest Manage Sci, 2014, 70(11): 1761-1766. DOI:10.1002/ps.3809 |
| [21] |
Haniza MZH, Adams S, Jones EP, et al. Large-scale structure of brown rat (Rattus norvegicus) populations in England: effects on rodenticide resistance[J]. Peer J, 2015, 3: e1458. DOI:10.7717/peerj.1458 |
| [22] |
宋英, 李宁, 王大伟, 等. 鼠类对抗凝血类灭鼠剂抗药性的遗传机制[J]. 中国科学:生命科学, 2016, 46(5): 619-626. |
| [23] |
陈蔚恩, 李选云, 钟柳青, 等. 0.005%溴鼠灵饵剂的适口性及其现场灭鼠效果研究[J]. 中华卫生杀虫药械, 2016, 22(3): 239-241. |
 2018, Vol. 29
2018, Vol. 29