扩展功能
文章信息
- 刘德星, 邱德义, 李婷婷, 张瑞玲, 刘春晓, 岳巧云
- LIU De-xing, QIU De-yi, LI Ting-ting, ZHANG Rui-ling, LIU Chun-xiao, YUE Qiao-yun
- 热带臭虫及温带臭虫形态与分子鉴定
- Morphological and molecular identification of Cimex hemipterus and C. lectularius
- 中国媒介生物学及控制杂志, 2018, 29(6): 576-581
- Chin J Vector Biol & Control, 2018, 29(6): 576-581
- 10.11853/j.issn.1003.8280.2018.06.006
-
文章历史
- 收稿日期: 2018-06-15
- 网络出版时间: 2018-10-16 07:57
2 泰山医学院, 山东 泰安 271016;
3 深圳国际旅行卫生保健中心, 广东 深圳 518000;
4 中山大学生命科学学院, 广东 广州 510275
2 Taishan Medical University;
3 Shenzhen International Travel Healthcare Center;
4 College of Life Science Sun Yat-sen University
臭虫属于半翅目(Hemiptera)异翅亚目(Heteroptera)臭虫科(Cimicidae)。臭虫科包含6亚科22属近90种,在我国与人类有密切关系和医学意义的仅有臭虫属(Cimex)的2种,即热带臭虫(C. hemipterus)和温带臭虫(C. lectularius)。温带臭虫和热带臭虫嗜吸人血,导致局部皮损,奇痒难忍,有时可能引起强烈的过敏反应,出现丘疹样荨麻疹,还可能出现臭虫抗原引起的过敏性哮喘。自然条件下在臭虫体内可检测到普氏立克次体、克氏锥虫、班氏丝虫等病原体,存在传染疾病的风险[1]。温带臭虫和热带臭虫外部形态相似,差别细微,仅靠成虫的形态特征有时难以准确鉴定,对于形态不完整的成虫、幼虫、卵或者残肢等更难以鉴别,对臭虫的分类鉴定造成一定困扰。随着分子生物学的发展,特别是DNA测序技术的普遍应用,致使许多学者从形态分类学研究转向应用DNA条形码等分子生物学方法来分析和解决近缘种的分类问题,其中线粒体基因和核糖体基因应用最广泛[2]。
细胞色素C氧化酶亚基Ⅰ(COI)基因是线粒体细胞色素氧化酶亚基Ⅰ编码蛋白基因,在半翅目中全长1 400 bp左右,也是动物分子系统学中应用频率较高的一种线粒体基因[3]。COI基因的不同区段由于功能差异,进化速度不同,适合解决从高级阶元到亲缘关系密切的种、亚种及地理种群之间的系统关系[4]。16S rDNA是编码线粒体中16S RNA的基因,全长1 400~1 700 bp,是目前在昆虫分子系统学中被经常应用的分子标记。线粒体的16S rDNA是动物种内个体间较为保守的序列,改变速率较为缓慢,适合于高级阶元分类[5]。28S rDNA是真核生物的染色体上编码核糖体大亚基RNA的基因,全长4~5 kb,是研究生物高级阶元系统发育较好的分子标记,28S rDNA保守的序列中含有12个高变区(D1~D12),可用来解决从种到科水平上的系统发生关系[6]。ITS2是内转录间隔区,进化速度快,能提供系统分类学中可遗传性状,适合于种或种下水平的分析。由于具有很高的可变性,是区分种群和研究种系之间关系的最适宜进化速率的基因,因此被广泛应用[7]。本研究通过形态的对比并利用线粒体基因COI、16S rDNA和核糖体基因28S rDNA、ITS2来鉴定与区别热带臭虫和温带臭虫。
1 材料与方法 1.1 标本采集热带臭虫采自深圳市某大学集体宿舍,温带臭虫采自山东泰安市某大学集体宿舍,所有标本均采集于2017年7月。
1.2 形态学鉴定将采集的臭虫制作成干制标本,在体视显微镜下观察臭虫标本,根据《医学昆虫学》[1]检索鉴定。
1.3 分子鉴定 1.3.1 DNA提取取臭虫的1条后足用于基因组DNA的提取,按TIANGEN公司生产的TIANamp Genomic DNA Kit试剂盒的使用说明书进行基因组DNA提取。
1.3.2 DNA扩增DNA的扩增和PCR产物的纯化参照Yue等[8]方法。引物由宝生物工程(大连)有限公司合成(表 1),EX-Taq DNA聚合酶、dNTP等PCR试剂从宝生物工程(大连)有限公司购置。
1.3.3 测序与序列分析将PCR产物送上海立菲科技有限公司测序,测序引物同扩增引物。利用MEGA 6.0软件寻找测序结果的引物并将其去除,得到有效序列;将有效序列提交于美国国立生物技术信息中心(NCBI)进行结果比对;用MEGA 6.0软件分析处理有效序列并生成Neighbor-Joining(NJ)进化树[9]。
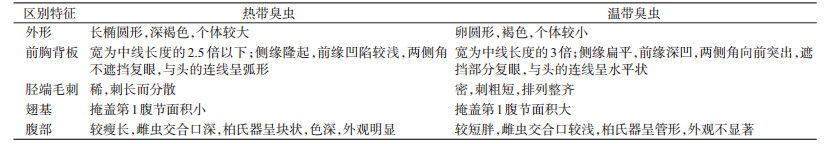
1.3.4 比对序列的获得从GenBank中搜索并下载热带臭虫和温带臭虫的COI、16S rDNA、28S rDNA、ITS2序列,Anthocoris nemorum的COI序列,A. confusus的16S rDNA序列和Cacodmus vicinus的ITS2序列,用于比对与分析。
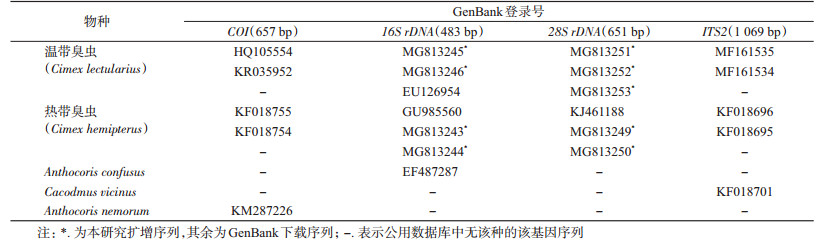
2 结果 2.1 形态鉴定结果根据臭虫的形态描述检索鉴定标本,比对两者的前胸背板、足、翅基及腹部等特征,可看出热带臭虫与温带臭虫之间存在区别,具体区别特征见图 1,区别特征描述见表 2。

|
| 注:A.热带臭虫前胸背板;B.温带臭虫前胸背板;C.热带臭虫翅基与第1腹节;D.温带臭虫翅基与第1腹节;E.热带臭虫第3~5腹节及交合口;F.温带臭虫第3~5腹节及交合口;G.热带臭虫胫端毛刺;H.温带臭虫胫端毛刺 图 1 热带臭虫与温带臭虫(雌)特征的区别 Figure 1 The morphological differences between Cimex hemipterus and C. lectularius (female) |
| |
|
将PCR扩增并去掉引物的有效序列16S rDNA、28S rDNA提交到NCBI进行BLAST分析,其中16S rDNA的结果与形态鉴定结果一致,热带臭虫28S rDNA与形态鉴定结果一致,由于GenBank缺乏温带臭虫28S rDNA的序列,因此没有准确的对比结果。
利用有效的16S rDNA、28S rDNA序列和从GenBank下载2种臭虫的COI、16S rDNA、28S rDNA、ITS2序列进行比对分析,添加A. nemorum的COI,A. confusus的16S rDNA和C. vicinus的ITS2作为外源种,构建4种基因的NJ进化树,物种与4种基因的详细信息见表 3。
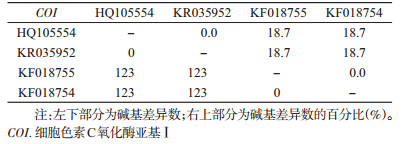
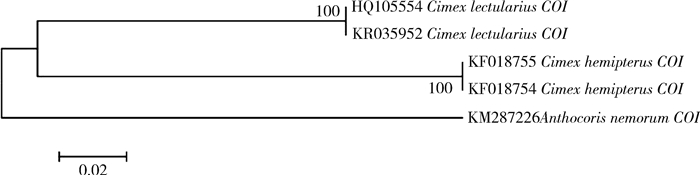
从表 4可看出,热带臭虫与温带臭虫COI的种内碱基数差异为0,相似度达到100%,而种间的碱基差异达到18.7%;从图 2 COI的NJ进化树上看,温带臭虫与热带臭虫各自聚为一支,支持率达到100%。说明COI基因在热带臭虫与温带臭虫之间有明显差异,可以用于鉴定和区分这2种近似种。
|
|
| 图 2 热带臭虫与温带臭虫COI的NJ进化树 Figure 2 Neighbor Joining tree based on COI |
| |
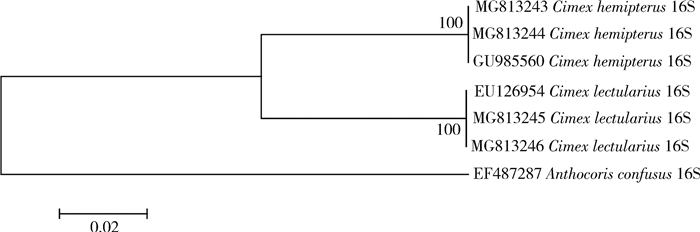
从表 5可看出,热带臭虫与温带臭虫16S rDNA的种内碱基数差异为0,相似度达到100%,而种间的碱基差异达到8.7%;从图 3 16S rDNA的NJ进化树上看,温带臭虫与热带臭虫各自聚为一支,支持率达到100%。说明16S rDNA基因在热带臭虫与温带臭虫之间有明显差异,可以用于鉴定和区分这2种近似种。

|
|
| 图 3 热带臭虫与温带臭虫16S rDNA的NJ进化树 Figure 3 Neighbor-Joining tree based on 16S rDNA |
| |
从表 6可看出,热带臭虫与温带臭虫28S rDNA的种内碱基数差异为0,相似度达到100%,而种间的碱基差异达到19.5%;从图 4 28S rDNA的NJ进化树上看,温带臭虫与热带臭虫各自聚为一支,支持率达到100%。说明28S rDNA基因在热带臭虫与温带臭虫之间有明显差异,可以用于鉴定和区分这2种近似种。

|

|
| 图 4 热带臭虫与温带臭虫28S rDNA的NJ进化树 Figure 4 Neighbor-Joining tree based on 28S rDNA |
| |
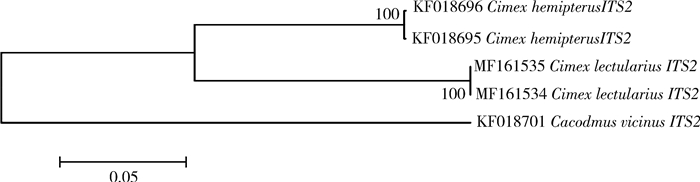
从表 7可看出,热带臭虫ITS2的种内碱基数差异为1,相似度达到99.9%,温带臭虫的种内碱基数差异为0,相似度达到100%,而种间的碱基差异达到13.9%~14.2%;从图 5 ITS2的NJ进化树上看,温带臭虫与热带臭虫各自聚为一支,支持率达到100%。说明ITS2基因在热带臭虫与温带臭虫之间有明显差异,可以用于鉴定和区分这2种近似种。

|
|
| 图 5 热带臭虫与温带臭虫ITS2的NJ进化树 Figure 5 Neighbor-Joining tree based on ITS2 |
| |
热带臭虫和温带臭虫作为医学昆虫,不仅滋扰人类的生活,还有可能传播病原体。对于热带臭虫和温带臭虫的分类鉴定,一般通过成虫外部形态来鉴别。虽然热带臭虫与温带臭虫的地域分布有明显差异[10],但是由于现代交通便利和贸易交流频繁等,有可能导致臭虫随着交通工具或贸易的货物被带到不同的地方,因此从地理分布确定臭虫的种类并不完全准确。随着DNA分子技术的发展,并且应用于物种的分类鉴定,特别是线粒体基因和核糖体基因的广泛应用,使热带臭虫和温带臭虫的鉴定与区分不再是单一的形态鉴定。
将获得的16S rDNA和28S rDNA序列进行对比,对比结果与形态鉴定结果一致,相似度均达到100%,种内差异均<2%,种间差异均>2%。比较分析从GenBank下载的2种臭虫的COI和ITS2基因,相似度均达到99%以上,种内差异均<2%,种间差异均>2%。从4个基因的NJ进化树看,2个种均能各自聚为一支,支持率均达到100%,由此看出,无论是线粒体基因的COI、16S rDNA还是核糖体基因的28S rDNA、ITS2,均能很好地鉴定与区分这2种臭虫。因此,这4种基因可用作热带臭虫与温带臭虫2种近似种鉴定与区别DNA的分子标记。但由于数据库中数据有限,分析的个体数不够多,随着分析个体数量的增多种内个体间的碱基差异有可能不均为0。
DNA分子标记已应用于多种医学昆虫近似种的鉴定与区别[11-13],由于分子标记不受虫态的影响[14],对于形态学难以鉴定的卵和幼虫进行鉴定更方便、准确,形态与分子相结合的方法鉴定与区别近似种,可以相互验证,使结果更为准确,为难以快速鉴别的近似种的鉴定提供有效的方法和有力保证。
| [1] |
李朝品. 医学昆虫学[M]. 北京: 人民军医出版社, 2007: 328-334.
|
| [2] |
尹文英, 宋大祥, 杨星科, 等. 六足动物(昆虫)系统发生的研究[M]. 北京: 科学出版社, 2008: 28-110.
|
| [3] |
李培.缘蝽科昆虫线粒体COI基因的分子系统学研究(半翅目: 异翅亚目)[D].西安: 陕西师范大学, 2007. http://cdmd.cnki.com.cn/article/cdmd-10718-2007199396.htm
|
| [4] |
Zhang DX, Hewitt GM. The long and short of nuclear mitochondrial DNA (Numt) lineages Reply from D-X. Zhang and G.M. Hewitt[J]. Trends Ecol Evol, 1997, 12(3): 114. DOI:10.1016/S0169-5347(97)84926-9 |
| [5] |
田颖.半翅目异翅亚目及臭虫型内部分子系统发育研究(半翅目: 异翅亚目)[D].天津: 南开大学, 2008. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1798213
|
| [6] |
赵华斌, 杨群, 郝家胜. 苔藓动物主要类群28S rDNA多变区的分子形态分析及其系统学意义[J]. 动物分类学报, 2006, 31(2): 247-255. DOI:10.3969/j.issn.1000-0739.2006.02.003 |
| [7] |
任芳, 杨玉荣, 韦华. 3种线虫rDNA-ITS2-RFLP分析[J]. 中国人兽共患病学报, 2006, 22(7): 661-664. DOI:10.3969/j.issn.1002-2694.2006.07.018 |
| [8] |
Yue QY, Wu KL, Qiu DY, et al. A formal re-description of the cockroach Hebardina concinna anchored on DNA Barcodes confirms wing polymorphism and identifies morphological characters for field identification[J]. PLoS One, 2014, 9(9): e106789. DOI:10.1371/journal.pone.0106789 |
| [9] |
黄原. 分子系统发生学[M]. 北京: 科学出版社, 2012: 247-280.
|
| [10] |
李朝品. 医学节肢动物学[M]. 北京: 人民卫生出版社, 2009: 748-758.
|
| [11] |
邱德义, 魏晓雅, 吴可量, 等. 德国小蠊及其近缘种的形态和分子鉴定[J]. 中国媒介生物学及控制杂志, 2017, 28(3): 220-225. DOI:10.11853/j.issn.1003.8280.2017.03.006 |
| [12] |
廖俊蕾, 岳巧云, 邱德义, 等. 新截获中国未见分布种杜比亚丽蝇形态和DNA条形码鉴定[J]. 中国媒介生物学及控制杂志, 2014, 25(6): 509-513. DOI:10.11853/j.issn.1003.4692.2014.06.006 |
| [13] |
钟敏, 蔺应学, 王英. 分子生物学技术在按蚊近缘种鉴定的应用进展[J]. 中国热带医学, 2014, 14(12): 1529-1532. DOI:10.13604/j.cnki.46-1064/r.2014.12.039 |
| [14] |
岳巧云, 邱德义, 黄艺文, 等. 应用DNA条形码技术鉴定未知双翅目蛹[J]. 中国国境卫生检疫杂志, 2011, 34(5): 343-347. DOI:10.16408/j.1004-9770.2011.05.029 |
 2018, Vol. 29
2018, Vol. 29