扩展功能
文章信息
- 程睿, 付士红, 范娜, 何英, 雷雯雯, 王环宇, 王斌, 鲁晓晴, 梁国栋
- CHENG Rui, FU Shi-hong, FAN Na, HE Ying, LEI Wen-wen, WANG Huan-yu, WANG Bin, LU Xiao-qing, LIANG Guo-dong
- 中华按蚊分离的版纳病毒全基因组序列测定与分子遗传进化分析
- Genome sequencing and phylogenetic analysis of Banna virus (genus Seadornavirus, family Reoviridae) isolated from Anopheles sinensis
- 中国媒介生物学及控制杂志, 2018, 29(6): 550-556
- Chin J Vector Biol & Control, 2018, 29(6): 550-556
- 10.11853/j.issn.1003.8280.2018.06.002
-
文章历史
- 收稿日期: 2018-07-20
- 网络出版时间: 2018-10-16 10:27
2 中国疾病预防控制中心病毒病预防控制所病毒性脑炎室, 传染病预防控制国家重点实验室, 北京 102206
2 Stay Key Laboratory of Communicable Disease Prevention and Control, National Institute for Communicable Disease Prevention and Control, Chinese Center for Disease Control and Prevention
版纳病毒(Banna virus)是呼肠孤病毒科(Reoviridae)东南亚12节段RNA病毒属(Seadornavirus)的病毒,于1987年首次分离自我国云南省西双版纳地区的病毒性脑炎患者脑脊液标本[1]。目前已经从中国的西南部云南省至北部内蒙古自治区的9个省(自治区)采集的蚊虫中分离到版纳病毒。此外已经从印度尼西亚、越南[2]的蚊虫中分离到版纳病毒。至今已在三带喙库蚊(Culex tritaeniorhynchus)、淡色库蚊(Cx. pipiens pallens)、环带库蚊(Cx. annulus)、伪杂麟库蚊(Cx. psedovishnui colless)、凶小库蚊(Cx. modestus)、致倦库蚊(Cx. pipiens quinquefasciatus)、刺扰伊蚊(Aedes vexans)、背点伊蚊(Ae. dorsalis)、白纹伊蚊(Ae. albopictus)、迷走按蚊(Anopheles vagus)、中华按蚊(An. sinensis)[3-4]11种蚊虫中分离到版纳病毒。
中华按蚊隶属于双翅目蚊科(Culicidae)按蚊亚科(Anophelinae)按蚊属(Anopheles)赫坎按蚊种团(Hyrcanus Group)[5],在我国分布非常广泛,除青海省和西藏自治区外,其余省份均有中华按蚊记载[6]。此外该蚊还在阿富汗、日本、印度尼西亚等东亚、东南亚地区分布[7]。中华按蚊是非常重要的医学媒介昆虫,主要传播疟原虫和丝虫及流行性乙型脑炎病毒等多种人畜共患病原体。此前,已从多种蚊虫中分离到版纳病毒,但仅对库蚊(三带喙库蚊、环带库蚊、伪杂鳞库蚊)分离的版纳病毒做了全基因组序列测定与分析。虽然已从中华按蚊分离到多株版纳病毒,但未见对该蚊分离的版纳病毒全基因组序列的测定和分析。鉴于此,我们对2012年在云南省采集的中华按蚊标本中分离到的版纳病毒YN12234株进行全基因组序列测定与分析,发现包括按蚊在内的蚊虫传播的版纳病毒并不存在病毒与蚊虫种类之间的病毒/媒介的适应性,现将结果报告如下。
1 材料与方法 1.1 细胞培养使用C6/36细胞(白纹伊蚊卵细胞),为本实验室保存。C6/36细胞培养由90% RMPI 1640(Invitrogen)、10%胎牛血清(FBS,Invitrogen)和100 U/ml的青霉素和链霉素配制。C6/36细胞置于28 ℃培养箱中培养。
1.2 病毒株来源YN12234病毒株分离自2012年云南省中缅边境地区采集的中华按蚊,病毒株为本科室保存。YN12234病毒接种C6/36细胞,28 ℃连续培养,每日观察是否产生细胞病变(CPE)。
1.3 病毒RNA提取和病毒基因组cDNA制备吸取140 μl病毒感染的C6/36细胞上清液,用QIAamp Viral RNA Mini kit(50)试剂盒,按操作说明书提取版纳病毒RNA。将提取的RNA在65 ℃水浴10 min,然后冰浴2 min,取出32 μl加入到第一合成反应链管(来自英国Amersham公司的Ready-To-Go You-Prime Fimt-Strand Beads试剂盒)中,静置1 min,加入1 μl(50 ng/μl)随机引物pd(N)6,轻敲管壁,瞬时离心,37 ℃水浴60 min,将cDNA储存于-40 ℃。
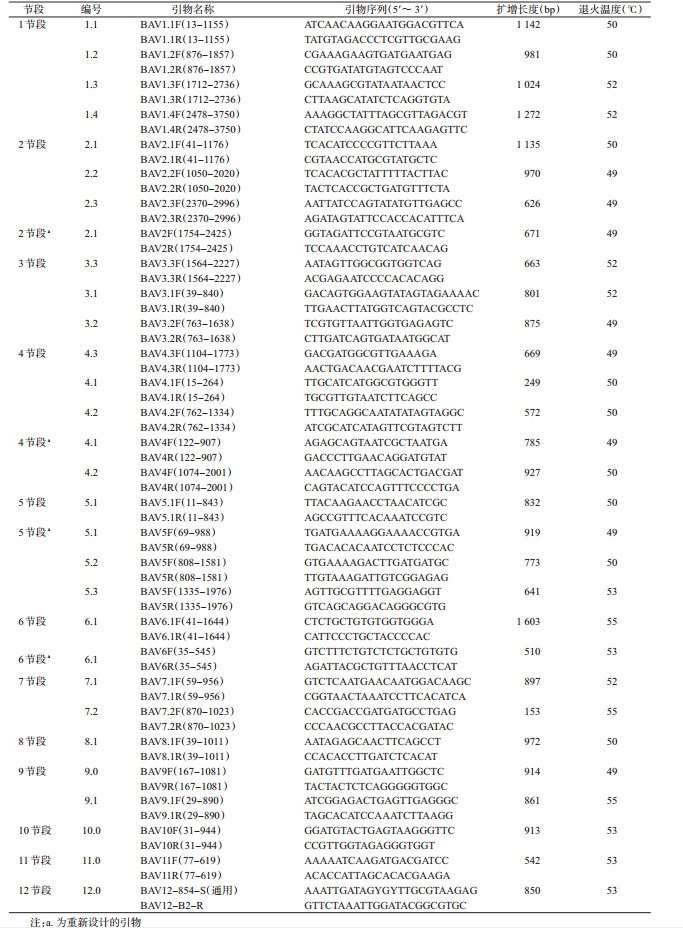
1.4 病毒基因扩增及序列测定所用引物参照已发表的版纳病毒全基因组序列扩增引物[8]以及自行设计的引物(表 1)扩增出基因的全序列,自行设计的引物使用Primer Premier 5.0软件(加拿大Premier公司)进行引物设计和评估,综合考虑扩增目的片段长度、引物退火温度等信息,找出引物的合适反应条件(表 1)。
以YN12234病毒株感染的C6/36细胞上清液制备的cDNA为模板,使用正、反向引物(TSINGKE,China),GoTaq® Green Master Mix,2×(Promega,Madison,WI)试剂配制25 μl体系,使用Mastercycler(Eppendorf,Hamburg,Germany)完成RT-PCR扩增。扩增条件:95 ℃预变性5 min,94 ℃变性30 s,退火温度(表 1)退火30 s,72 ℃延伸60 s,35个循环后72 ℃延伸10 min。PCR反应结束,取5 μl PCR产物进行1%琼脂糖凝胶电泳检测扩增结果。目的条带阳性产物经过切胶回收使用QIAquick Gel Extraction Kit(Qiagen,Hilden,Germany)纯化后,进行序列测定。将序列进行BLAST(NCBI,美国国立生物技术信息中心)比对,获得GenBank信息来鉴定病毒基因。
1.5 序列分析将GenBank中呼肠孤病毒科14个病毒属代表病毒第1节段病毒蛋白氨基酸序列(表3中毒株GenBank序列号分别为FJ183364、JN255862、AM745077、AAB18743、AAC58684、ACA50122、ACA50110、AAF78849、APG79118、AAF78848、AAQ83562、AAT11887、AAZ94041、AAL31497、AAN46860、AAK00595、AAZ49068、AAZ49068、AAP45577、AAA47234、AAC36456)以及分离自不同国家、不同蚊种媒介和宿主动物的39株版纳病毒基因组编码区核苷酸序列(GenBank序列号分别为AAC36456、EU265715、EU265705、EU265694、EU265692、AF052024、AF052008、AF019908、GQ331963~GQ331972、FJ160414、GQ331954~GQ331962、FJ217989~FJ217991、FJ161964~FJ161966、AY568290、GQ331973、AY568289、MF979781、MF979782)与YN12234病毒株核苷酸序列进行分子遗传特征分析。使用Seqman软件(DNAStar,Madison,WI)对病毒株YN12234的基因测序结果进行拼接和质量分析;使用BioEdit(version 7.0.5.3;Thomas)软件进行病毒核苷酸多序列比对;使用MEGA 6.0软件完成基于Neighbour-Joining(NJ)方法的系统进化分析,Bootstrap值设定为1 000。使用MegAlign软件(DNAStar,Madison,WI)进行核苷酸和氨基酸序列的同源性分析。
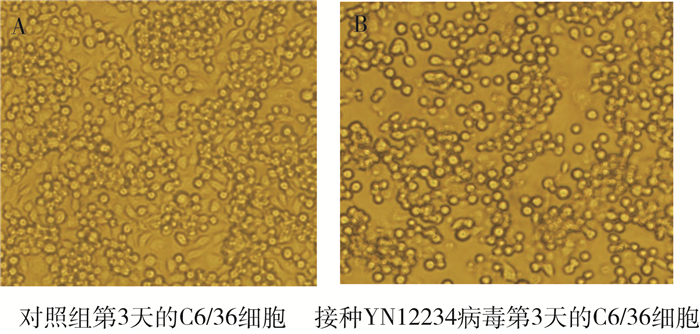
2 结果 2.1 致细胞病变将YN12234病毒株接种C6/36细胞,逐日观察细胞病变。结果显示,该病毒株接种C6/36细胞后,48 h开始出现细胞病变,表现为细胞聚集和脱落,病变逐渐加重,72 h病变达到+++(细胞病变75%)(图 1)。YN12234病毒可以在C6/36细胞稳定传代。
|
| 图 1 YN12234病毒对C6/36细胞的致病变作用(×200) Figure 1 Cytopathic effect of YN12234 on C6/36 cells (×200) |
| |
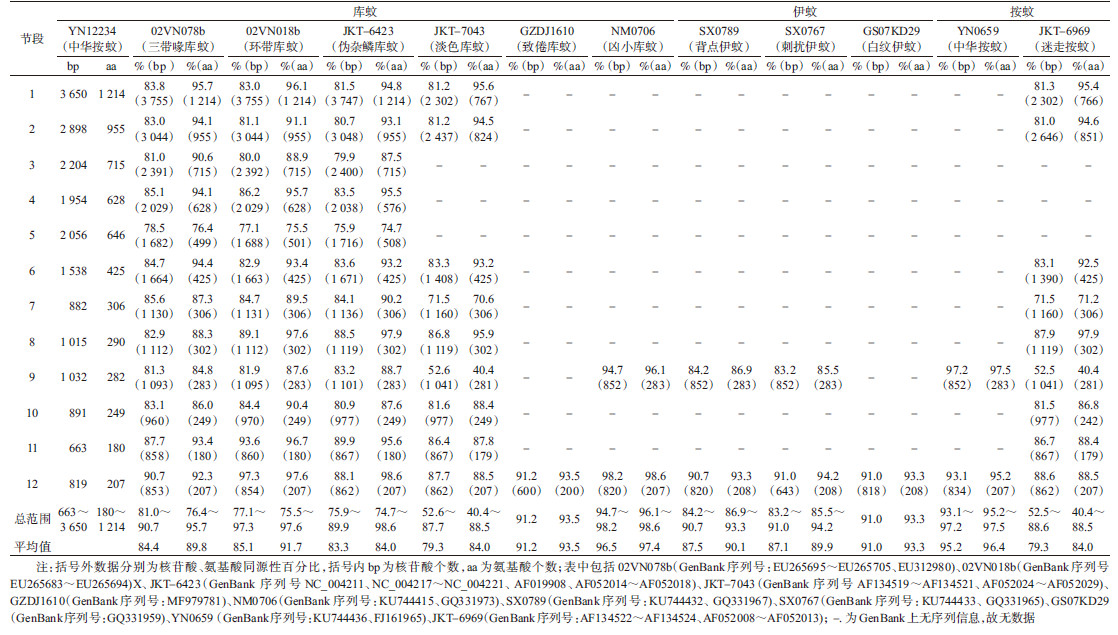
以YN12234病毒株制备的cDNA为模板,使用版纳病毒第12节段(850 bp)特异性引物进行RT-PCR扩增和序列测定,序列分析显示YN12234病毒为版纳病毒。使用基因扩增引物(表 1)对YN12234病毒株进行全基因组序列扩增,获得YN12234株病毒全基因核苷酸序列(表 2)。
|
YN12234病毒与分离自库蚊、伊蚊、按蚊(包括三带喙库蚊、淡色库蚊、环带库蚊、伪杂麟库蚊、致倦库蚊、凶小库蚊、刺扰伊蚊、背点伊蚊、白纹伊蚊、迷走按蚊、中华按蚊)的版纳病毒(02VN018b、02VN078b、JKT-6423、JKT-6969、JKT-7043、GZDJ1610、MN0706、SX0789、SX0767、GS07KD29和YN0659株)进行同源性比对,各基因节段核苷酸与氨基酸同源性分析结果显示,YN12234病毒株与库蚊属中NM0706株(凶小库蚊,2007年)同源性最高,核苷酸和氨基酸同源性平均值为96.5%(94.7%~98.2%)和97.4%(96.1%~98.6%);与02VN078b株(三带喙库蚊,2002年)次之,核苷酸和氨基酸同源性平均值分别为85.1%(81.0%~90.7%)和91.7%(76.4%~95.7%);与伊蚊属中SX0767株第12节段核苷酸和氨基酸同源性最高,分别为91.0%和94.2%;与按蚊属中YN0659(中华按蚊,2006年)同源性最高,核苷酸和氨基酸同源性平均值分别为95.2%和96.4%。YN12234病毒基因组分子信息及特征见表 2。
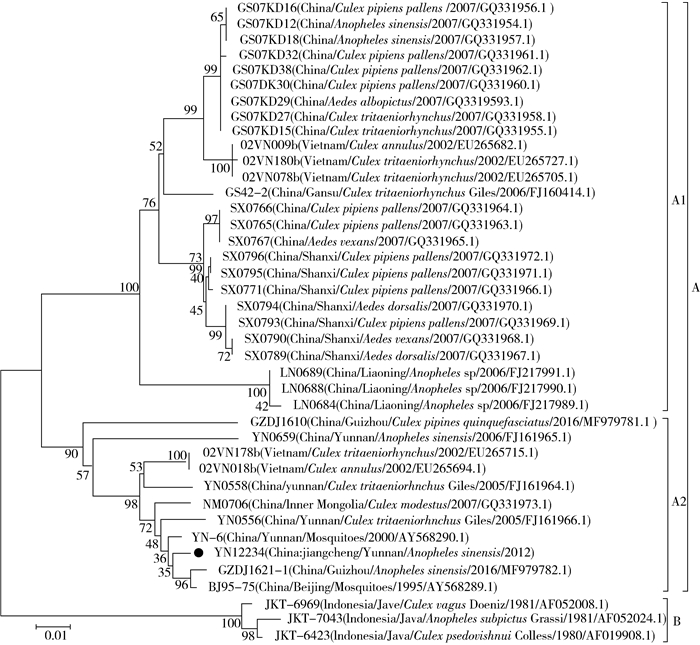
2.4 进化分析为明确YN12234病毒基因组遗传进化地位,将YN12234病毒与呼肠孤病毒科14个病毒属代表病毒VP1蛋白(RdRp)氨基酸序列进行系统进化分析,结果显示,YN12234株病毒与此前分离的多株版纳病毒处在同一进化分支,而与辽宁病毒、KDV病毒共同构成处在呼肠孤病毒科Seadornavirus病毒属中,上述结果提示,YN12234病毒为Seadornavirus病毒属的版纳病毒(图 2)。鉴于在国际基因库可以利用的版纳病毒基因序列中第12基因节段的序列信息最多(蚊虫中分离的版纳病毒第12节段39条),为此构建了版纳病毒12节段基因序列构建系统进化树,结果显示,YN12234病毒为A基因型版纳病毒中的A2基因亚型版纳病毒(图 3)。

|
| 注:●标注毒株为云南省中华按蚊标本分离的版纳病毒YN12234病毒株 图 2 呼肠孤病毒科成员基于第1节段病毒蛋白构建的氨基酸系统进化树 Figure 2 Phylogenetic analysis of segment 1 viral protein amino acid sequences from Reoviridae |
| |
|
| 注:●标注毒株为云南省中华按蚊标本分离的版纳病毒YN12234病毒株 图 3 不同蚊种版纳病毒12节段系统进化树 Figure 3 Phylogenetic analysis of Banna virus isolates based on 12th segment coding region nucleotide sequences |
| |
中华按蚊属半家栖蚊种,孳生环境十分广泛,且具有很强的适应性,稻田、芦苇塘、沼泽地等是中华按蚊的主要孳生环境[9],在我国绝大多数省份都存在中华按蚊,有预测表明,中华按蚊的适生区主要分布在我国第二、三级阶梯内,即在北部地区40°N、中部地区25°~35°N和南部地区20°~25°N均是中华按蚊适生区分布的聚集区,暴露于中华按蚊分布区内的人口2005—2010年平均占全国总人口比例的50%以上。即在中国有一半以上的人口存在感染中华按蚊传播疾病的可能性[10]。我国已先后在南至云南、北至辽宁、东至甘肃、贵州等地的中华按蚊中分离到版纳病毒[4, 11-13],该蚊在版纳病毒的传播中扮演了相当重要的角色。资料显示[1],感染版纳病毒的患者可出现不规则发热、头痛、肌肉酸痛、颈(项)硬、嗜睡等症状,严重者可出现昏迷,病毒性脑炎。感染版纳病毒的猪、牛等脊椎动物可出现消瘦、厌食、失明等症状[3, 14-15]。版纳病毒与人、畜疾病有密切关系。
版纳病毒基因组全长约21 000 bp,由12条双链RNA组成,每个基因片段含有一个读码框编码一个病毒蛋白(viral protein,VP),为VP1~VP12。完整的版纳病毒颗粒中含有7个结构蛋白,其中第4节段编码的VP4和第9节段编码的VP9形成外层衣壳,另外5个结构蛋白分别是VP1、VP2、VP3、VP8和VP10,位于病毒的核心颗粒上。5个非结构蛋白分别是VP5、VP6、VP7、VP11和VP12,其中VP12执行双链RNA结合蛋白的功能[16-17]。版纳病毒第12节段基因序列是最为保守也是毒株序列信息最丰富的节段[18],且在进化分析中具有有效分辨度和可靠的稳定性[17]。使用版纳病毒第12节段基因序列进行病毒系统进化分析认为,2012年从云南省中华按蚊分离的YN12234病毒株属于版纳病毒基因A2型病毒。
分子遗传进化分析发现,YN12234病毒株与15°~30°(中国南方)地区分离的版纳病毒共同组成A2型分离株在一簇[19-20]。第12节段系统进化分析显示,版纳病毒具有较为明显的地域分布特征,同一地域且在同一时间分离的病毒株在同一进化簇如甘肃、山西省分离株各自成一簇(图 3),而不同蚊种库蚊、伊蚊、按蚊分离出的版纳病毒可在同一进化簇,未发现依据种属来源不同而聚类成簇的现象,进一步说明版纳病毒与蚊虫种类之间并未形成相互的适应性[20],而病毒基因组核苷酸和氨基酸序列同源性分析也未表现出明显的蚊种差异(表 2),YN12234株与NM0706、02VN078b、SX0767、YN0659株同源性较高,其中与库蚊和按蚊中分离出的版纳病毒同源性最高,与伊蚊中分离出的版纳病毒同源性较低,但不同蚊种间分离病毒的同源性是否存在差异,还需增加更多蚊虫分离版纳病毒的测定以得到验证。
版纳病毒具有广泛的媒介宿主,可以感染多种蚊种,具有广泛的宿主生态链中传播的特性,这或许为版纳病毒的碱基缺失、插入、重组、重配提供了有利条件,而这些变异正是病毒适应性进化的驱动力,中华按蚊作为重要的宿主媒介,要增强对其病毒监测的关注。且随着国际间人员来往交流更加频繁,外来疾病进入国门的概率增大。我国的输入性疟疾病例时有发生,临床已有疟疾合并登革热病毒的感染病例[21-22],甚至恶性疟疾合并登革热的病例报道[23]。而中华按蚊作为疟疾与版纳病毒的共同媒介宿主,疟疾与版纳病毒的合并感染是一个具有潜在风险的公共卫生问题。有必要对疟疾与版纳病毒的合并感染加以关注和防范。因此,应重视版纳病毒在传播媒介以及宿主中的检测,以便更全面地应对潜在的病毒风险。这些检测提供的版纳病毒分子生物学信息会使版纳病毒家族成员的信息更加多样,丰富、全面,有利于研究者对于版纳病毒的进一步研究,为版纳病毒潜在的流行风险做好更充足的准备。
| [1] |
徐普庭, 王逸民, 左建民, 等. 从云南省无名热病人和脑炎病人分离到新环状病毒[J]. 病毒学报, 1990, 6(1): 27-33. DOI:10.13242/j.cnki.bingduxuebao.000560 |
| [2] |
Nabeshima T, Nga PT, Guillermo P, et al. Isolation and molecular characterization of Banna virus from mosquitoes, Vietnam[J]. Emerg Infect Dis, 2008, 14(8): 1276-1279. DOI:10.3201/eid1408.080100 |
| [3] |
刘红, 梁国栋. 版纳病毒及其感染[J]. 中国媒介生物学及控制杂志, 2010, 21(5): 502-504. |
| [4] |
Fu SH, Song S, Liu H, et al. ZIKA virus isolated from mosquitoes:a field and laboratory investigation in China, 2016[J]. Sci China Life Sci, 2017, 60(12): 1364-1371. DOI:10.1007/s11427-017-9196-8 |
| [5] |
马颖.中国按蚊属按蚊亚属分子系统学研究(双翅目: 蚊科)[D].西安: 陕西师范大学, 2010.
|
| [6] |
冯欣宇.中华按蚊免疫相关基因多态性研究[D].上海: 第二军医大学, 2012. http://cdmd.cnki.com.cn/article/cdmd-90024-1012404708.htm
|
| [7] |
王小婷, 张玉娟, 何秀, 等. 中华按蚊全基因组微卫星的鉴定、特征及分布规律[J]. 昆虫学报, 2016, 59(10): 1058-1068. DOI:10.16380/j.kcxb.2016.10.004 |
| [8] |
Song S, Li YY, Fu SH, et al. Genome sequencing and phylogenetic analysis of Banna virus (genus Seadornavirus, family Reoviridae) isolated from Culicoides[J]. Sci China Life Sci, 2017, 60(12): 1372-1382. DOI:10.1007/s11427-017-9190-6 |
| [9] |
潘波. 我国主要传疟媒介的形态特征、生态习性及传疟作用[J]. 热带医学杂志, 2003, 3(4): 477-480. DOI:10.3969/j.issn.1672-3619.2003.04.038 |
| [10] |
马爱民, 王劲峰, 王多全, 等. 基于最大熵模型的中华按蚊潜在分布预测[J]. 中国媒介生物学及控制杂志, 2014, 25(5): 393-398. DOI:10.11853/j.issn.1003.4692.2014.05.003 |
| [11] |
杨杜鹃, 付士红, 张海林, 等. 云南省东北等地区蚊虫及蚊媒病毒调查研究[J]. 中国媒介生物学及控制杂志, 2011, 22(4): 304-308, 312. |
| [12] |
孟维珊, 张稷博, 孙肖红, 等. 辽宁省部分地区2006年虫媒病毒分离鉴定[J]. 中华流行病学杂志, 2009, 30(1): 50-54. DOI:10.3760/cma.j.issn.0254-6450.2009.01.015 |
| [13] |
翟友刚, 王焕琴, 于德山, 等. 甘肃省分离的版纳病毒具有显著地域特征[J]. 中国人兽共患病学报, 2010, 26(4): 304-309. DOI:10.3969/j.issn.1002-2694.2010.04.003 |
| [14] |
李其平, 谢杏初, 郅琦, 等. 首次从新疆的蜱和病牛血清分离到新环状病毒[J]. 地方病通报, 1992, 7(4): 64-69. DOI:10.13215/j.cnki.jbyfkztb.1992.04.021 |
| [15] |
徐普庭, 王逸民, 左建民, 等. 云南省猪牛体内发现人源同型新环状病毒[J]. 病毒学报, 1990, 6(4): 327-331. DOI:10.13242/j.cnki.bingduxuebao.000624 |
| [16] |
Jaafar FM, Attoui H, Mertens PPC, et al. Structural organization of an encephalitic human isolate of Banna virus (genus Seadornavirus, family Reoviridae)[J]. J Gen Virol, 2005, 86(Pt 4): 1147-1157. DOI:10.1099/vir.0.80578-0 |
| [17] |
刘红.版纳病毒全基因组序列特征及其分子进化研究[D].北京: 中国疾病预防控制中心, 2011. http://cdmd.cnki.com.cn/Article/CDMD-84501-1011210944.htm
|
| [18] |
刘红, 梁国栋. 新发虫媒病毒:基因A型版纳病毒全基因组序列扩增引物[J]. 中国媒介生物学及控制杂志, 2016, 27(6): 533-538. DOI:10.11853/j.issn.1003.8280.2016.06.002 |
| [19] |
刘红, 高晓艳, 付士红, 等. 基于第12节段基因序列的版纳病毒分子遗传进化分析[J]. 中华流行病学杂志, 2016, 37(9): 1277-1282. DOI:10.3760/cma.j.issn.0254-6450.2016.09.019 |
| [20] |
Liu H, Li MH, Zhai YG, et al. Banna virus, China, 1987-2007[J]. Emerg Infect Dis, 2010, 16(3): 514-517. DOI:10.3201/eid1603.091160 |
| [21] |
周庆荣. 疟疾与登革热感染1例报告[J]. 浙江预防医学, 2014, 26(12): 1252-1253. DOI:10.19485/j.cnki.issn.1007-0931.2014.12.021 |
| [22] |
张照英, 高再发, 熊晓霞. 输入性登革热合并疟疾两例调查处理报告[J]. 公共卫生与预防医学, 2009, 20(6): 75-76. |
| [23] |
杨宁, 王晗, 洪炜, 等. 输入性恶性疟疾合并登革热休克综合征的病例分析[J]. 中国热带医学, 2016, 16(6): 580-583. DOI:10.13604/j.cnki.46-1064/r.2016.06.17 |
 2018, Vol. 29
2018, Vol. 29