扩展功能
文章信息
- 宋暖, 黄振东, 薛志静, 万晴, 庄桂芬, 张瑞玲, 许永玉, 张忠
- SONG Nuan, HUANG Zhen-dong, XUE Zhi-jing, WAN Qing, ZHUANG Gui-fen, ZHANG Rui-ling, XU Yong-yu, ZHANG Zhong
- 盐酸环丙沙星对家蝇幼虫和蛹体内抗氧化酶活力的影响
- Impact of ciprofloxacin on the antioxidases activities of Musca domestica larvae and pupae
- 中国媒介生物学及控制杂志, 2018, 29(5): 448-452
- Chin J Vector Biol & Control, 2018, 29(5): 448-452
- 10.11853/j.issn.1003.8280.2018.05.007
-
文章历史
- 收稿日期: 2018-06-19
- 网络出版时间: 2018-08-03 17:12
2 山东农业大学植物保护学院, 山东 泰安 271000;
3 泰山医学院基础医学院, 山东 泰安 271016
2 Plant Protection College of Shandong Agricultural University;
3 College of Basic Medicine, Taishan Medical University
昆虫在长期协同进化过程中,与其肠道细菌共同构成昆虫的肠道微生态系统,其自身为其肠道菌提供营养,而肠道菌则可协同调控宿主昆虫的生长发育、生殖能力、免疫抗逆和生态适应等[1-4]。大多数昆虫肠道共生菌中的优势菌群为细菌,被称为昆虫肠道共生细菌[5-6]。昆虫的肠道共生细菌易受外界环境、食物、病原体感染等因素影响,可反映出昆虫肠道微生态环境对外界环境改变的响应。
家蝇(Musca domestica)是一种重要的病媒生物,可机械性传播细菌、病毒、支原体、真菌、寄生虫卵等多种病原体,威胁人类健康[7-9]。虽然家蝇生活环境比较污浊,但其生活史很少受到影响;家蝇的免疫功能比较强大,其体内完善的抗氧化系统也发挥重要作用,保护其生长发育过程中产生的活性氧自由基存在产生和消除的动态平衡[10]。家蝇体内活性氧防御系统主要包括总超氧化物歧化酶(T-SOD)、过氧化氢酶(CAT)和过氧化物酶(POD),3种酶在清除活性氧自由基方面发挥重要作用。我们的前期研究表明,以抗生素去除家蝇肠道共生细菌后,其生长发育、种群增长和繁殖均受到严重抑制[11],但对其体内抗氧化酶活性影响的研究仍未见相关报道。本研究通过测定喂食家蝇抗生素后其幼虫和蛹体内的抗氧化酶活性,研究抗生素对家蝇幼虫和蛹抗氧化酶活性的影响。
1 材料与方法 1.1 试虫来源家蝇为泰山医学院病媒生物与虫媒病实验室饲养品系。
1.2 试剂盐酸环丙沙星,纯度 > 88.5%,由上海源叶生物科技有限公司提供。
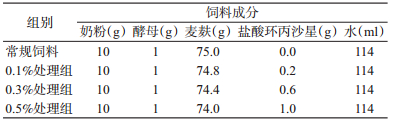
1.3 饲养方法家蝇幼虫的饲料配方见表 1,其中麦麸和水均经灭菌处理。以喂食常规饲料的家蝇幼虫及蛹为对照组,以喂食含0.1%、0.3%和0.5%盐酸环丙沙星饲料的家蝇幼虫及蛹作为处理组,每组设5次重复。成虫饲养:为对照组成虫提供奶粉和红糖作为补充营养,同时提供饮水。为处理组成虫提供奶粉和红糖作为补充营养,同时提供含有0.001、0.003、0.005 g/ml盐酸环丙沙星的饮水。幼虫饲养条件:恒温培养箱温度(25±1)℃、相对湿度(70±5)%,光照周期(L:D)=12 h:12 h。家蝇幼虫化蛹后,进行单只饲养,用于取样。
将供试家蝇幼虫或去除蛹壳后的蛹各20只置于预冷的玻璃匀浆器中,加入磷酸盐缓冲液和少量苯基硫脲,在冰浴中匀浆。匀浆液置于冷冻离心机中,离心半径8 cm,4 ℃ 6 000 r/min离心20 min,取上清液作为酶原,-80 ℃冰箱保存备用,正常饲养的对照组和喂食0.1%、0.3%和0.5%盐酸环丙沙星的家蝇幼虫或蛹各取100只。
1.5 酶活力测定3种酶活力分别采用T-SOD、CAT、POD试剂盒测定,试剂盒均由南京建成科技有限公司提供。
1.5.1 T-SOD的测定采用T-SOD试剂盒(可见光法)测定,按组织样本方法进行。T-SOD计算公式:

|
采用CAT试剂盒测定,按试剂盒说明书操作加入试剂后,最后以钼酸铵迅速终止CAT分解H2O2的反应,剩余H2O2可与钼酸铵产生一种淡黄色的络合物。通过分光光度计于405 nm处测定其生成量,可计算CAT活力。活力单位定义:每毫克组织蛋白每秒分解1 μmol/L H2O2的量。计算公式:
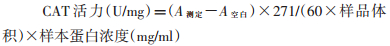
|
采用POD(测动物组织)试剂盒测定,POD可催化过氧化氢反应,通过测定420 nm处吸光度的变化值,根据试剂盒说明书计算酶活性。POD活力计算公式:

|
采用SPSS 20.0软件分别对不同浓度盐酸环丙沙星饲喂后家蝇幼虫和蛹体内抗氧化酶活力数据,经单因素方差分析后,用Turkey多重比较方法进行显著性分析,P < 0.05为差异有统计学意义。
2 结果 2.1 盐酸环丙沙星对家蝇体内T-SOD活力的影响 2.1.1 对家蝇幼虫体内T-SOD活力的影响家蝇幼虫喂食不同浓度盐酸环丙沙星后,对照组、0.1%和0.3%处理组同日龄家蝇幼虫T-SOD活性差异无统计学意义(P > 0.05);饲食含0.5%盐酸环丙沙星的家蝇幼虫T-SOD活性显著高于对照组、0.1%和0.3%处理组,与对照组比较最高可升高30倍。家蝇幼虫发育过程中,对照组和0.1%、0.3%处理组家蝇幼虫体内T-SOD活性均无显著变化;喂食含0.5%盐酸环丙沙星家蝇幼虫发育期间T-SOD活性变化显著,并呈逐渐下降趋势,见表 2。
|
家蝇幼虫喂食不同浓度的盐酸环丙沙星化蛹后,同日龄家蝇蛹对照组、0.1%、0.3%和0.5%盐酸环丙沙星处理组间T-SOD活力差异均有统计学意义(P < 0.001),其中0.5%处理组家蝇蛹体T-SOD活性最高可达0.1%处理组的40倍;在家蝇蛹发育过程中,对照组、0.1%和0.3%处理组T-SOD活性均有显著变化,而0.5%处理组T-SOD活性无显著变化(表 3)。
|
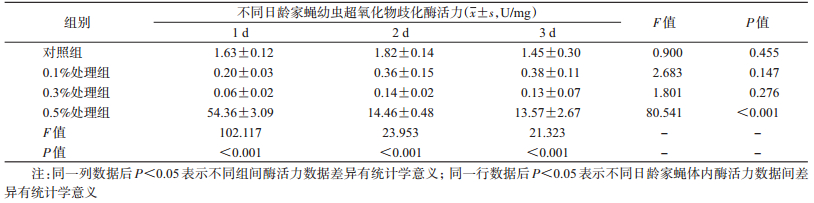
家蝇幼虫取食不同浓度盐酸环丙沙星后,孵化后1 d各处理组间家蝇幼虫体内CAT活性差异无统计学意义(P > 0.05);而孵化2、3 d的各处理组家蝇幼虫体内CAT活性差异有统计学意义(F=11.629,P=0.003;F=40.433,P=0.001),其中0.5%处理组家蝇幼虫体内CAT活性高于其他组(F=9.473,P=0.014),最高可达对照组的3倍。各组家蝇幼虫发育过程中其体内CAT活性均自孵化后第2天开始升高,其中0.5%处理组发育过程中升高最为显著,对照组间差异较小(表 4)。
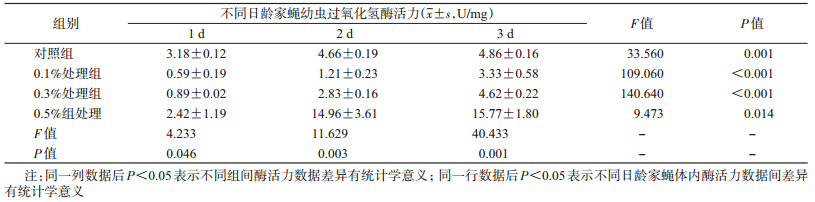
|
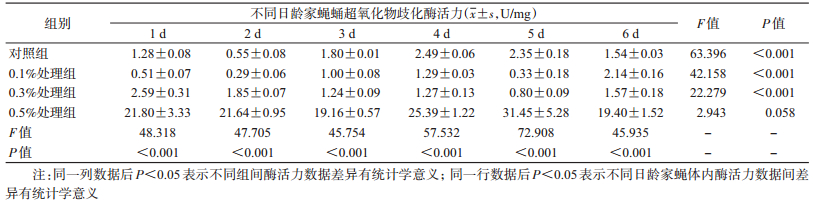
各组家蝇蛹体内CAT活性有显著变化,0.5%处理组家蝇蛹体内CAT酶活力高于对照组、0.1%和0.3%处理组(P < 0.001),对照组、0.1%和0.3%处理组间差异无统计学意义(P > 0.05),0.5%处理组家蝇蛹体内CAT酶活力最高可达对照组的6倍。对照组和0.5%处理组家蝇蛹发育期间CAT酶活性均无显著变化;0.1%和0.3%处理组家蝇蛹发育过程中CAT活性差异有统计学意义,且整体均呈先下降后升高趋势(表 5)。

|
喂食不同浓度盐酸环丙沙星后,1、2日龄家蝇幼虫体内POD活力均无显著变化,3日龄家蝇幼虫体内POD活力发生显著变化,0.5%处理组家蝇幼虫体内POD活性显著升高。各处理组家蝇幼虫发育过程中,其体内POD活性差异均有统计学意义(P < 0.01),3日龄家蝇幼虫体内活性显著升高(F=13.319,P=0.002),见表 6。
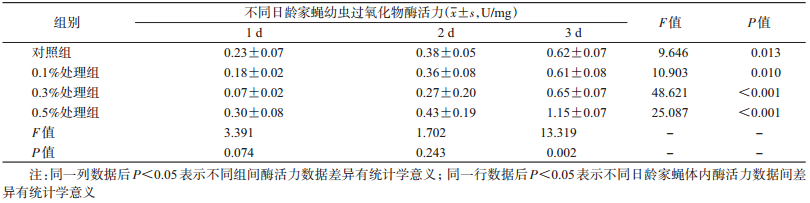
|
喂食不同浓度盐酸环丙沙星后,家蝇蛹体内POD酶活性变化显著,其中0.5%处理组家蝇幼虫体内POD活性高于对照组、0.1%和0.3%处理组(F=13.625、15.097、3.169,P < 0.001、< 0.001、0.047),而后3组间差异无统计学意义(P > 0.05)。家蝇蛹发育过程中,对照组、0.1%和0.3%处理组的POD活性变化显著,而0.5%处理组家蝇在蛹发育期间POD活性无显著变化(表 7)。
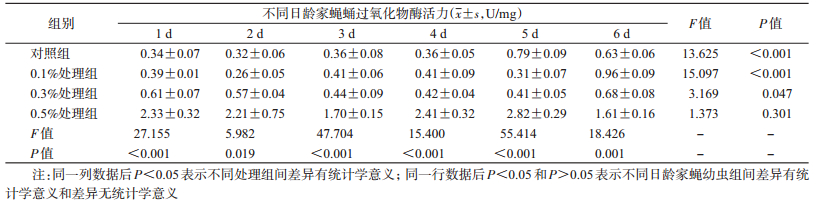
|
活性氧是生物体在氧化代谢过程中自然产生的,包括超氧阴离子、过氧化物和羟自由基[12]。在正常情况下,活性氧的产生和抗氧化过程协调发生,活性氧处于动态平衡状态,但当昆虫处于非正常条件或机体受损时,活性氧浓度会大量增加,导致过氧化胁迫[13],最终导致细胞死亡[14]。抗氧化酶系统是昆虫及螨类等变温动物抵御温度、毒物和体内机能胁迫的重要手段。在3种主要的抗氧化酶中,SOD几乎存在于所有生物细胞中,可催化超氧阴离子发生歧化反应生成过氧化氢,CAT和POD将生成的过氧化氢转化成对细胞无害的水,从而达到清除氧自由基、保护细胞的目的[15]。
已有研究表明,喂食家蝇盐酸环丙沙星后,其生长发育和种群繁殖均受显著抑制,卵和幼虫的期望寿命也显著缩短[11]。本研究表明,喂食家蝇幼虫不同浓度的盐酸环丙沙星后,同日龄家蝇幼虫和蛹的对照组、0.1%和0.3%处理组家蝇幼虫的T-SOD、POD和CAT活性差异均无统计学意义,而喂食含0.5%盐酸环丙沙星家蝇幼虫和蛹体内的3种抗氧化酶活性显著高于对照组、0.1%和0.3%处理组。由此可见,0.5%处理组对家蝇幼虫和蛹体内的抗氧化酶系均有显著影响,低浓度盐酸环丙沙星对家蝇幼虫体内的3种抗氧化酶活力影响不大,而家蝇在高浓度盐酸环丙沙星胁迫下,其体内抗氧化酶活性得到有效激活,产生保护机制。
家蝇肠道细菌在其生长发育、种群繁衍、环境抗逆等方面有重要作用,研究去除肠道细菌对其抗氧化酶系活性的影响,有利于进一步了解其肠道细菌功能。通过喂食高浓度盐酸环丙沙星后,家蝇幼虫和蛹体内的3种抗氧化酶均呈显著升高趋势,而这些抗氧化酶激活过程及肠道细菌作用等问题均有待深入研究。
| [1] |
Crotti E, Balloi A, Hamdi C, et al. Microbial symbionts:a resource for the management of insect-related problems[J]. Microb Biotechnol, 2012, 5(3): 307-317. DOI:10.1111/j.1751-7915.2011.00312.x |
| [2] |
Engel P, Moran NA. The gut microbiota of insects-diversity in structure and function[J]. FEMS Microbiol Rev, 2013, 37(5): 699-735. DOI:10.1111/1574-6976.12025 |
| [3] |
Shi WB, Syrenne R, Sun JZ, et al. Molecular approaches to study the insect gut symbiotic microbiota at the 'omics' age[J]. Insect Sci, 2010, 17(3): 199-219. DOI:10.1111/j.1744-7917.2010.01340.x |
| [4] |
相辉, 黄勇平. 肠道微生物与昆虫的共生关系[J]. 昆虫知识, 2008, 45(5): 687-693. DOI:10.3969/j.issn.0452-8255.2008.05.003 |
| [5] |
刘婧, 陈丹, 庄桂芬, 等. 家蝇发育过程中肠道可培养共生细菌的分离与鉴定[J]. 中国寄生虫学与寄生虫病杂志, 2017, 35(2): 120-124. |
| [6] |
陈勃生, 鲁兴萌, 邵勇奇. 鳞翅目昆虫肠道微生物的多样性及其与宿主的相互作用[J]. 昆虫学报, 2017, 60(6): 710-722. DOI:10.16380/j.kcxb.2017.06.011 |
| [7] |
陈丹, 张瑞玲, 刘婧, 等. 蝇类携带病原体研究进展[J]. 中国病原生物学杂志, 2016, 11(8): 765-768. DOI:10.13350/j.cjpb.160821 |
| [8] |
陈丹.不同生境家蝇体表携带细菌的多样性研究及家蝇携菌能力评估[D].泰安: 泰山医学院, 2016.
|
| [9] |
薛志静, 张瑞玲, 庄桂芬, 等. 家蝇携带真菌的研究进展[J]. 中国媒介生物学及控制杂志, 2017, 28(4): 396-399. DOI:10.11853/j.issn.1003.8280.2017.04.025 |
| [10] |
王慧.重金属Cu2+、Cd2+胁迫对几种蝇类抗氧化酶系统的影响[D].杭州: 浙江大学, 2005. http://cdmd.cnki.com.cn/Article/CDMD-10335-2005088287.htm
|
| [11] |
宋暖.去除肠道共生细菌对家蝇发育和丽蝇蛹集金小蜂寄生作用的影响[D].济南: 山东农业大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10434-1014341670.htm
|
| [12] |
Livingstone DR. Contaminant-stimulated reactive oxygen species production and oxidative damage in aquatic organisms[J]. Mar Pollut Bull, 2001, 42(8): 656-666. DOI:10.1016/S0025-326X(01)00060-1 |
| [13] |
Lopez-Martinez G, Elnitsky MA, Benoit JB, et al. High resistance to oxidative damage in the Antarctic midge Belgica antarctica, and developmentally linked expression of genes encoding superoxide dismutase, catalase and heat shock proteins[J]. Insect Biochem Mol Biol, 2008, 38(8): 796-804. DOI:10.1016/j.ibmb.2008.05.006 |
| [14] |
Green DR, Reed JC. Mitochondria and apoptosis[J]. Science, 1998, 281(5381): 1309-1311. DOI:10.1126/science.281.5381.1309 |
| [15] |
Felton GW, Summers CB. Antioxidant systems in insects[J]. Arch Insect Biochem, 1995, 29(2): 187-197. DOI:10.1002/arch.940290208 |
 2018, Vol. 29
2018, Vol. 29