扩展功能
文章信息
- 王佳琳, 云超, 曾令军, 陶春, 宋洪涛
- WANG Jia-lin, YUN Chao, ZENG Ling-jun, TAO Chun, SONG Hong-tao
- 长效驱蚊软膏的制备及驱蚊效果评价
- Development and evaluation on long acting mosquito repellent ointment
- 中国媒介生物学及控制杂志, 2018, 29(4): 400-402
- Chin J Vector Biol & Control, 2018, 29(4): 400-402
- 10.11853/j.issn.1003.8280.2018.04.021
-
文章历史
- 收稿日期: 2018-03-29
- 网络出版时间: 2018-06-01 11:51
2 福建医科大学药学院, 福州 350108
2 College of Pharmacy, Fujian Medical University
蚊虫是重要的病媒生物,可传播疟疾、登革热等多种虫媒疾病。传染性疾病的控制以预防为主[1],驱避剂本身无杀虫作用,通过药物挥发在人体周围形成屏障而实现驱避作用,防止蚊虫叮咬,具有无毒或低毒、刺激性小等优点[2]。在某些不能使用杀虫剂的室内和蚊虫密度未知的室外,驱避剂为主要防蚊措施。市售驱蚊外用制剂存在驱避时间短的缺点,需要在短时间内反复使用。因此,开发长效、安全的外用驱蚊软膏有重要现实意义。
植物驱避剂的高效性和持久性均较低[3],对环境和生态的影响及社会经济效益和环境生态效益间的平衡问题等均需慎重考虑。化学合成驱避剂中关于DEET的研究较为详细,已有较明确的驱避范围,对蚊虫、蜱、蚤、白蛉和蠓等均有驱避作用[4]。DEET是蚊虫驱避剂中的“金标准”[5],为制备驱避制剂的首选药物,同时也是其他驱避剂效能的标准对照品。DEET对蚊虫的驱避能力较强,其最小驱避浓度为16 μg/m2[6]。DEET的毒理学相关研究比较全面[7],而其他驱避剂的毒理学相关研究较少,尚无明确的毒理学资料[8]。因此,本研究以DEET作为主成分制备长效驱蚊软膏,在室内进行了缓释性能和驱避效能实验。
1 材料与方法 1.1 试药来源DEET酊剂原药浓度为99.9%,由广州日油科技有限公司提供。使用前用无水乙醇配制成15.0%的驱避制剂,与市售制剂和自制驱蚊软膏中的DEET浓度相同供实验用。
1.2 避蚊胺的体外分析方法 1.2.1 检查波长精密称取DEET,用流动相制备成适宜浓度的溶液,以空白溶剂为空白对照,在190~400 nm波长范围内进行紫外扫描。DEET在209 nm处具有最大吸收。故选择209 nm作为检测波长。
1.2.2 色谱条件Agilent1200高效液相色谱系统(UV检查器,美国Agilent公司),色谱柱为Diamond C18(4.0 mm×150 mm,5 μm),流动相为乙腈:水(47:53,V/V),流速为1 ml/min,柱温为20 ℃,进样量为20 μl。
1.2.3 系统适应性实验以DEET原药配制成适宜浓度,按照上述色谱条件进样20 μl,DEET出峰保留时间为5.911 min,理论塔板数为21 837,对称因子为0.928。
1.2.4 线性关系考察精密吸取DEET原料药1 ml至100 ml容量瓶中,用47%乙腈稀释至刻度,摇匀,得到DEET标准储备液。再分别精密吸取DEET标准储备液0.10、0.25、0.50、0.75、1.00、1.25、1.50 ml至50 ml容量瓶中,用47%乙腈稀释至刻度,摇匀,得到不同浓度的对照品溶液。经过滤后分别精密吸取各浓度对照品溶液续滤液20 μl,注入液相色谱仪,按1.2.2色谱条件进行测定。以峰面积对对照品溶度进行线性回归,得到标准曲线方程:A=94.42C+258.4,r=0.999 4,线性范围为20~300 μg/ml。
精密吸取DEET原料药1 ml至100 ml容量瓶中,用47%乙腈稀释至刻度,摇匀,得到DEET标准储备液。分别连续精密吸取同一份DEET标准储备液各6次,每次20 μl,分别注入高效液相色谱仪,记录峰面积,计算相对标准偏差(RSD)。DEET的日间精密度RSD为0.41%,日内精密度RSD为1.36%。结果表明,避蚊胺含量测定RSD均<2%,精密度良好。
1.2.5 回收率实验精密称取DEET 8、10和12 mg,分别置于0.1 g的空白基质中,加入适量流动相溶液,超声10 min,置于50 ml容量瓶中,加流动相溶液稀释至刻度,摇匀,得到低、中、高不同浓度的溶液,每个浓度样品各3份。用0.22 μm微孔滤膜过滤,弃去初滤液,续滤液按1.2.2色谱条件分别进样,记录色谱峰面积。根据回归方程计算出相应浓度和含量,并计算回收率、平均回收率和RSD。回收率在95%~105%之间,且RSD<1.5%,符合要求。
1.3 长效驱蚊软膏的制备称取一定量的聚乙二醇400和DEET,搅拌均匀后加入预先经过85 ℃预热处于熔融状态的聚乙二醇3350,在40 ℃水浴条件下搅拌5~10 min,待其冷却后使用。DEET的药物浓度可达15%。
1.4 缓释性能测试 1.4.1 市售第二军医大学驱蚊霜的缓释挥发实验将约0.1 g样品均匀涂布于表面积相同的培养皿上(ϕ 90 mm),记录称量时间,共15个。等待约20 min至质量恒定后再次称量,记录第2次称量时间。随机分为5组,将培养皿敞口放置于温度为32 ℃(人体体表温度为32 ℃)的烘箱中进行缓释挥发实验,分别于1、3、6、9和12 h取一个平行组,用流动相溶解剩余样品,分次洗涤后转移至50 ml容量瓶中定容,经0.45 μm微孔滤膜过滤后测定DEET缓释挥发剩余量,计算药物挥发率的平均值,计算公式:

|
同1.4.1步骤,无需质量挥发至恒重步骤。仅通过DEET的挥发率无法判断制剂间的驱避效果差异,因此,需对不同制剂进行驱蚊效能测定。
1.5 长效驱蚊软膏的驱蚊效果评价 1.5.1 蚊虫来源白纹伊蚊(Aedes albopictus)采自福建省福州总医院动物房,采集时间为春夏季节16:00—05:00[9]。
1.5.2 供试动物昆明种小鼠来自福州总医院比较医学科,体质量为3~5 g。
1.5.3 饲养条件相对温度(27±1)℃、相对湿度(60±10)%、光照:黑暗(L:D)=12 h:12 h,黄昏光照和黎明光照各1 h。用10%葡萄糖溶液(含0.2%对羟基甲苯)和小白鼠新鲜血液交替饲喂[10]。
1.5.4 饲养方法在动物房捕获的白纹伊蚊雌蚊约300只,带回养蚊室后放入35 cm×35 cm×35 cm的蚊笼中待其产卵。放入20 ml 10%蔗糖或葡萄糖溶液(含0.2%对羟基甲苯)作为营养液,以10.5 cm×10.5 cm×4.5 cm的白透明聚丙烯制成的类似保鲜盒作为产卵杯,内壁由湿润的海绵布和白色纤维素滤纸覆盖[9]。营养液每2 d更换一次。待1~2 d后蚊虫产卵,将卵转移至10.5 cm×10.5 cm×4.5 cm的正方形白透明聚丙烯制成的类似保鲜盒的容器中进行孵化,密度为100~150条/盒。同时在水中加入猪肝混悬液[11](将5 g猪肝剪碎,加入250 ml注射用水后经400 W超声15 s,间隔5 s,全程30 min匀浆至均匀混悬液)1~2 ml,吹打均匀,敷成膜阻止幼蚊和氧气接触。幼蚊孵化40 h为1龄,60 h为2龄,80 h为3龄,再经150 h为4龄[11]。1~2龄幼蚊每2~3 d喂一次猪肝混悬液(1~2 ml),3龄幼蚊每天喂1次,4龄幼蚊每天喂2次。待幼蚊化蛹后,每天早晨吸蛹1次,将蛹放入35 cm×35 cm×35 cm的蚊笼内羽化。化蛹后促使其密集成群交配[12],并将蚊笼置于有自然光照的不锈钢架上,饲喂10%葡萄糖溶液(含0.2%对羟基甲苯)。每笼装有300只白纹伊蚊作为实验动物以测定自制驱蚊软膏的药效。
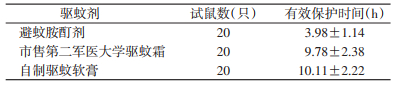
1.5.5 驱避效能测定方法按GB/T 13917.9—2009《农药登记用卫生杀虫剂室内药效试验及评价》要求,选择攻击力合格的白纹伊蚊和小白鼠。将DEET酊剂、市售第二军医大学驱蚊霜和自制驱蚊软膏(DEET浓度均为15%)直接涂抹在小白鼠腹部暴露皮肤(2.0 cm×2.0 cm)进行测试,涂抹剂量均为1.5 mg/cm2,其他部位严密遮蔽。涂布2 h后将小白鼠放入含有300只雌蚊的蚊笼内5 min,观察有无蚊虫吸血。若有1只蚊虫停落吸血即判为实验结束。按统一纳入标准选择小白鼠,采用完全随机设计方法将小白鼠分为3组,每组20只。计算有效保护时间(保护率>95%时的保护时间)[13]。
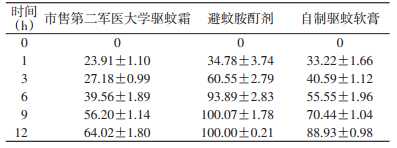
2 结果 2.1 缓释性能测定结果测试12 h内,以市售第二军医大学驱蚊霜制剂中的DEET释放速度最慢,平均挥发率为(64.02±1.80)%;DEET酊剂中的DEET释放速度最快,在12 h时已全部挥发;而自制驱蚊软膏制剂中的DEET释放速度适中,12 h的平均挥发率为(88.93±0.98)%,见表 1。
测试结果见表 2。3种驱蚊剂中的平均有效保护时间差异有统计学意义(F=35.762,P<0.01),而自制驱蚊软膏与市售第二军医大学驱蚊霜的平均有效保护时间差异亦有统计学意义(F=22.247,P<0.01)。自制驱蚊软膏的有效保护时间大于DEET酊剂和市售第二军医大学驱蚊霜。
蚊媒传染性疾病严重威胁人类健康。本研究在室内对驱避剂的驱蚊效果进行了测试,而室外涂抹使用驱避剂的效果受诸多因素影响,如风速、温度、使用者的个体差异及蚊虫种类和密度等[14]。因此,研发长效安全的外用驱蚊剂应考虑驱避药物的种类、浓度和影响驱避实验的因素等。本研究发现,自制驱蚊软膏可明显增强DEET的驱蚊效果,其优于市售第二军医大学长效驱蚊霜,可能因熔融的聚乙二醇3500与DEET混合后再冷却固化成膜状结构,可减缓DEET的挥发速率,从而达到缓释驱避效果[2]。本研究为长效安全广谱驱避制剂的制备提供了理论指导并有现实意义。
| [1] |
Fournier PE, Roux V, Caumes E, et al. Outbreak of Rickettsia africae infections in participants of an adventure race in South Africa[J]. Clin Infect Dis, 1998, 27(2): 316-323. DOI:10.1086/514664 |
| [2] |
Norris EJ, Coats JR. Current and future repellent technologies:the potential of spatial repellents and their place in mosquito-borne disease control[J]. Int J Environ Res Public Health, 2017, 14(2): 124. DOI:10.3390/ijerph14020124 |
| [3] |
禤砾. 漫话植物源昆虫驱避剂[J]. 世界农药, 2002, 24(2): 20-22, 5. DOI:10.3969/j.issn.1009-6485.2002.02.005 |
| [4] |
Frances SP. Efficacy and safety of repellents containing deet[M]//Debboun M, Frances SP, Srtickman D. Insect Repellents: Principles, Methods, and Uses. Boca Raton: CRC Press, 2007: 311-325.
|
| [5] |
Goodyer LI, Croft AM, Frances SP, et al. Expert review of the evidence base for arthropod bite avoidance[J]. J Travel Med, 2010, 17(3): 182-192. DOI:10.1111/j.1708-8305.2010.00402.x |
| [6] |
De Gennaro M. The mysterious multi-modal repellency of DEET[J]. Fly, 2015, 9(1): 45-51. DOI:10.1080/19336934.2015.1079360 |
| [7] |
Swale DR, Sun BN, Tong F, et al. Neurotoxicity and mode of action of N, N-diethyl-meta-toluamide(DEET)[J]. PLoS One, 2014, 9(8): e103713. DOI:10.1371/journal.pone.0103713 |
| [8] |
Diaz JH. Chemical and plant-based insect repellents:efficacy, safety, and toxicity[J]. Wilderness Environ Med, 2016, 27(1): 153-163. DOI:10.1016/j.wem.2015.11.007 |
| [9] |
Ciocchetta S, Darbro JM, Frentiu FD, et al. Laboratory colonization of the European invasive mosquito Aedes(Finlaya) koreicus[J]. Parasit Vectors, 2017, 10: 74. DOI:10.1186/s13071-017-2010-2 |
| [10] |
Lees RS, Knols B, Bellini R, et al. Review:improving our knowledge of male mosquito biology in relation to genetic control programmes[J]. Acta Trop, 2014, 132(Suppl): S2-11. |
| [11] |
Le Goff G, Goodman SM, Elguero E, et al. Survey of the mosquitoes (Diptera:Culicidae) of Mayotte[J]. PLoS One, 2014, 9(7): e100696. DOI:10.1371/journal.pone.0100696 |
| [12] |
Facchinelli L, Valerio L, Lees RS, et al. Stimulating Anopheles gambiae swarms in the laboratory:application for behavioural and fitness studies[J]. Malar J, 2015, 14: 271. DOI:10.1186/s12936-015-0792-2 |
| [13] |
Kampen H, Medlock JM, Vaux AG, et al. Approaches to passive mosquito surveillance in the EU[J]. Parasit Vectors, 2015, 8: 9. DOI:10.1186/s13071-014-0604-5 |
| [14] |
Hsu HY, Harris MT, Toth S, et al. Drop printing of pharmaceuticals:effect of molecular weight on PEG coated-naproxen/PEG3350 solid dispersions[J]. AIChE J, 2015, 61(12): 4502-4508. DOI:10.1002/aic.14979 |
 2018, Vol. 29
2018, Vol. 29