扩展功能
文章信息
- 王卓, 王建伟, 于淼, 邢悦鹏, 冯立, 杨义军, 王秀红, 田圃, 吴益民
- WANG Zhuo, WANG Jian-wei, YU Miao, XING Yue-peng, FENG Li, YANG Yi-jun, WANG Xiu-hong, TIAN Pu, WU Yi-min
- 东北地区蜱传斑点热群立克次体的分子流行病学研究
- Molecular epidemiological studies on spotted fever group rickettsia in ticks from Northeastern China
- 中国媒介生物学及控制杂志, 2018, 29(4): 344-347
- Chin J Vector Biol & Control, 2018, 29(4): 344-347
- 10.11853/j.issn.1003.8280.2018.04.005
-
文章历史
- 收稿日期: 2018-02-24
- 网络出版时间: 2018-06-01 11:52
2 吉林大学生命科学学院, 长春 130012;
3 辽宁省食品检验检测院, 沈阳 110016
2 Jilin University, College Life Science;
3 Liaoning Institute for Food Control
斑点热群立克次体(spotted fever group rickettsia,SFGR)属于立克次体目(Rickettsiales)、立克次体科(Rickettsiaceae)、立克次体属(Rickettsia),是一类原核生物型、短小棒状或球形状、革兰阴性专性细胞内繁殖的微生物[1]。由SFGR引起的一类疾病主要为经蜱(螨、蚤)传播的人兽共患自然疫源性疾病,分布于世界各地。近年来,世界范围内新发及再发蜱媒立克次体病逐年增多,并不断发现证实SFGR的新种或新基因型,使其增加至30余种。目前,已证实16种SFGR对人体有致病性,其中7种为新发现的立克次体,近20种立克次体的致病性尚不清楚,因此,蜱媒立克次体病面临新挑战[1-2]。我国自1962年在黑龙江省虎饶地区的东方田鼠(Microtus fortis)分离出西伯利亚立克次体(R. sibirica)(HL-84株)以来,特别是1980年后的研究表明,我国南北方地区普遍存在SFGR。对蜱、宿主动物的调查研究发现,我国SFGR存在8种(基因型),如黑龙江立克次体(R. heilongjiangensis)、西伯利亚立克次体(R. sibirica)、内蒙古立克次体(R. mongolotimona)、拉欧蒂立克次体(R. raoultii)等[3]。其中黑龙江立克次体、西伯利亚立克次体、拉欧蒂立克次体和塔拉塞维奇立克次体(Candidatus R. tarasevichiae)已有实验室确诊病例报道[4-8]。随着发热伴血小板减少综合征布尼亚病毒(SFTSV)、无形体等新病原体的发现与证实,我国蜱媒传染病逐步成为公共卫生的新威胁[3, 9-10]。
蜱在SFGR传播中有媒介和储存宿主的双重作用,即通过叮咬哺乳动物形成水平传播,同时又可经卵传递至子代,进行垂直传播,维持立克次体在体内的延续及自然界的循环[1]。因此,蜱类立克次体感染的监测对蜱媒立克次体病自然疫源地的确定和疾病预防及评估均有现实意义。为了解东北地区蜱类SFGR感染情况及其种型分布,我们于2012—2014年在东北3省部分地区采集蜱类,应用PCR进行SFGR的分子流行病学研究。
1 材料与方法 1.1 蜱标本来源2012—2014年5—6月,采用人工布旗法在东北3省9个市(县)和黑瞎子岛的针阔混交林及灌木丛、草地等不同生境采集游离蜱及家畜(牛、羊)体表寄生吸血蜱,形态学鉴定分种后浸渍于75%乙醇保存。
1.2 DNA制备蜱标本用0.9%氯化钠溶液水洗3次,滤纸吸干。根椐采集地点和蜱种进行分组,游离蜱每组4~5只,寄生吸血蜱每组2只。用玻璃研磨器将蜱研碎,应用DNeasy Blood & Tissue Kit(QIAGEN)按说明书操作提取DNA,DNA提取液置-20 ℃保存备用。
1.3 引物设计与PCR扩增SFGR以外膜蛋白A基因(ompA)按文献[1]设计引物和PCR扩增。引物由生工生物工程(上海)股份有限公司合成。引物序列:Rr190.70p 5′-ATG GCG AAT ATT TCT CCA AAA-3′和Rr190.701n 5′-GTT CCG TTA ATG GCA GCA TCT-3′。扩增产物目的片段为632 bp。
1.4 序列测定及分子遗传进化分析PCR阳性产物由生工生物工程(上海)股份有限公司测序。应用测序结果与GenBank中BLAST序列比较,采用DNAStar及MEGA 5.0软件进行同源性分析和构建分子系统进化树。
1.5 统计学处理利用SPSS 20.0软件进行统计学分析,率的比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果 2.1 不同地区蜱的SFGR PCR检测共采集蜱1 224只,分为280组,PCR检测具有SFGR阳性DNA片段(532 bp)有32组,阳性率为11.43%,见表 1。各地SFGR阳性率差异无统计学意义(χ2=7.683,P=0.566),说明调查地区的蜱类普遍感染SFGR。根据调查地区进行地域划分,沿黑龙江流域调查区(黑河、抚远市、逊克、萝北县和黑瞎子岛)和沿长白山山脉调查区(密山、敦化、集安、本溪市和宽甸县)蜱类SFGR阳性率分别为15.63%和9.24%,差异亦无统计学意义(χ2=1.201,P=0.273)。
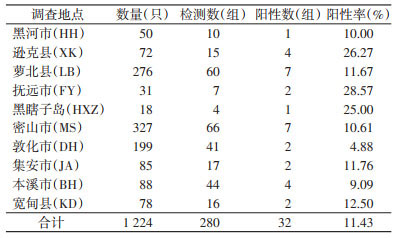
|
采集蜱分别为嗜群血蜱(Haemaphysalis concinna)、日本血蜱(H. japonica)、长角血蜱(H. loniconis)、森林革蜱(Dermacentor silvarum)和全沟硬蜱(Ixodes persulcatus)。SFGR阳性率分别为15.89%、5.26%、10.39%、12.50%和2.70%(表 2),SFGR感染率差异无统计学意义(χ2=6.354,P=0.174)。
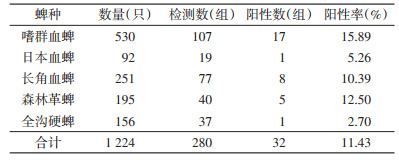
|
对32份蜱SFGR阳性标本进行测序,将成功测序的14份DNA标本和GenBank中注册的SFGR ompA基因序列进行同源性比较,并构建系统进化树。基于ompA基因的遗传进化分析显示,14份SFGR DNA标本分属于3种,5份嗜群血蜱标本(FY3、HXZ1、MS55、MS54、LB60)、日本血蜱标本(MS50)和森林革蜱标本(LB58)与R. heilongjiangensis 054株(AF179362.2)、HL-93株(AF179364.1)聚为一支,同源性为99.30%~100%;长角血蜱标本SFGR(BH36、BH43、KD9)与Candidatus R. hebeiii(QHD-3.HQ651817.1、TS-1.HQ651818.1、QHD-1.HQ651815.1)聚为一支,同源性为99.83%~100%,与R. heilongjiangensis(AF179362.2)和R. japonica(U43795.1)同源性较近;4份森林革蜱标本(X4、X10、XK36、XK40)与拉欧蒂立克次体俄罗斯株R.sp.DnS14(AH009130.2)、吉林株R.sp.JL-02(AY093696.1)聚为一支,同源性为98.79%~100%,与R. massiliae Mtu1.(U43799.1)同聚一支,见图 1。系统进化树表明,本次检测的14份测序标本分别属于斑点热群黑龙江立克次体、拉欧蒂立克次体及河北立克次体(Candidatus R. hebeiii),各蜱种的SFGR基因型分布见表 3。
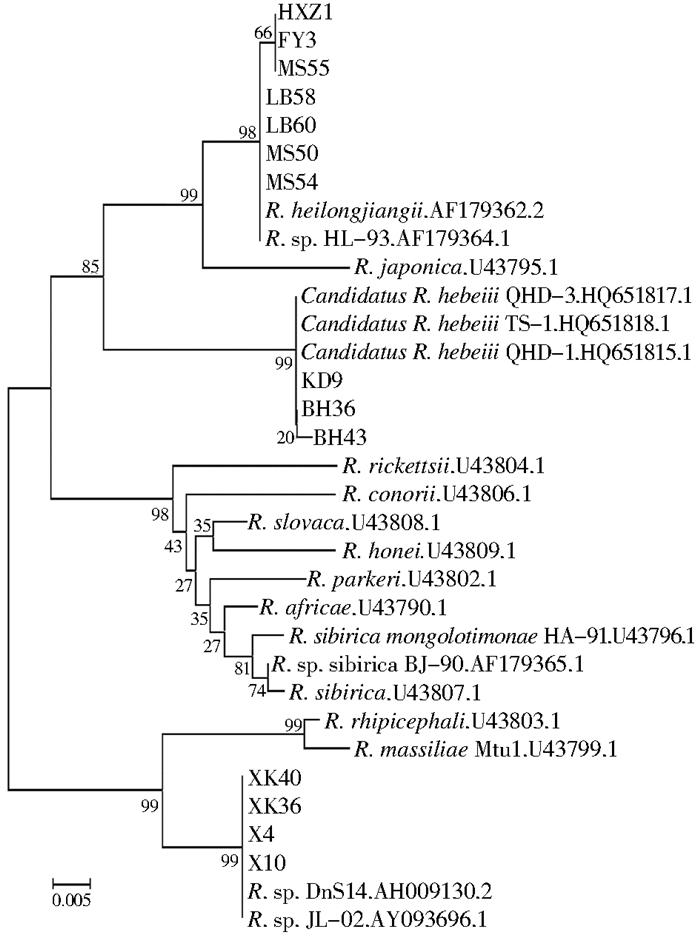
|
| 图 1 斑点热群立克次体ompA基因系统进化树 Figure 1 Phylogenetic tree based on spotted fever group rickettsia ompA gene |
| |
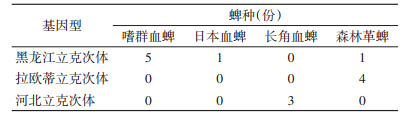
|
本研究发现,调查地区蜱类SFGR感染普遍。嗜群血蜱、日本血蜱、长角血蜱、森林革蜱和全沟硬蜱是东北地区的优势蜱种,调查地区多个蜱种均可能是SFGR的传播媒介,但血蜱属、革蜱属为SFGR感染的主要蜱种。我国存在8种SFGR(或基因型),涉及5属16个蜱种[3]。东北地区报告存在4种SFGR即黑龙江立克次体、西伯利亚立克次体、拉欧蒂立克次体和塔拉塞维奇立克次体[5-8]。本调查地区从蜱中检出3种SFGR,分别为黑龙江立克次体、拉欧蒂立克次体和河北立克次体。黑龙江立克次体是由我国黑龙江省绥芬河地区森林革蜱和嗜群血蜱分离而命名,为远东蜱传斑点热的病原体[11-12],主要分布于我国东北地区和俄罗斯远东地区,日本、泰国也有报道[5, 11-13]。近年来,内蒙古自治区(内蒙古)、青海、浙江、广东、河南、安徽及河北省相继报道,从革蜱属、血蜱属、扇头蜱属(Rhipicephalus)、璃眼蜱属(Hyalomma)等检测出黑龙江立克次体[14-16]。本研究从革蜱属和血蜱属的3个蜱种中均检测到该病原体,表明该立克次体具有分布广泛和感染蜱种多样性的特点,应引起重视。而感染SFGR的蜱种不同及检出SFGR种型有所差异,可能是各地地理生态环境、蜱种分布及捕蜱季节不同导致。
本研究在逊克地区的森林革蜱中检出拉欧蒂立克次体,在辽宁省本溪市和宽甸县的长角血蜱中检测到河北立克次体,这2种SFGR是近年来发现的斑点热群新基因型。拉欧蒂立克次体最早于1999年在俄罗斯的草原革蜱(Dermacentor nuttalli)和短小扇头蜱(Rh. pumilio)中发现[17]。我国于2011年首次在新疆维吾尔自治区的森林革蜱中检测到[18]。目前,国内从西藏、内蒙古自治区和吉林省的革蜱属和血蜱属5个蜱种中检测到拉欧蒂立克次体[3, 19]。本调查发现,黑龙江省逊克地区的森林革蜱存在拉欧蒂立克次体感染,证明我国拉欧蒂立克次体主要分布于北方地区,主要由革蜱属携带传播。河北立克次体为2011年在河北省燕山山区长角血蜱首次发现,经测序与系统发育分析认为是SFGR的新基因型[20]。河北省西部和南部山区长角血蜱中河北立克次体的感染率为6.90%~7.42%[21]。本研究在辽宁省东部山区长角血蜱中检出河北立克次体,感染率为10.39%。河北省南部燕山山区、西部太行山中段南麓、本溪市和宽甸县属长白山余脉,均为低山丘陵,有相似的地理地貌和生态环境,说明河北立克次体在长角血蜱中具有相对稳定性。目前,仅从河北省[20-21]和辽宁省长角血蜱中检出河北立克次体,其他蜱种是否感染及对人体的致病性有待深入调查研究。
根据已有报道和本研究结果,东北地区SFGR存在5个种或基因型(R. heilongjiangensis、R. sibirica、R. raoultii、Candidatus R. tarasevichiae和Candidatus R. hebeiii),主要涉及蜱的3属5种,揭示该地区SFGR感染具有SFGR基因型多样性、感染蜱种多样性及地域分布广泛性的特点。我国SFGR患者主要症状为发热、头痛、乏力、皮疹、焦痂、局部淋巴结肿大等[5],该病一般为自限性,但不同种或基因型SFGR感染的临床症状不同,有的可能出现重症临床表现,发生严重的多器官功能障碍或脑膜炎症状[7-8]。根据东北地区SFGR特点,应做好SFGR的预防和治疗,重点落实个人防蜱叮咬措施及蜱传立克次体病的诊断与鉴别。
| [1] |
Parola P, Paddock CD, Raoult D. Tick-borne rickettsioses around the world:emerging diseases challenging old concepts[J]. Clin Microbiol Rev, 2005, 18(4): 719-756. DOI:10.1128/CMR.18.4.719-756.2005 |
| [2] |
Tarasevich I. 立克次体生态学及立克次体病流行病学[M]//Alexandrov E. 当代立克次体学与立克次体病. 张丽娟, 译. 长春: 吉林大学出版社, 2010: 52-58.
|
| [3] |
Fang LQ, Liu K, Li XL, et al. Emerging tick-borne infections in mainland China:an increasing public health threat[J]. Lancet Infect Dis, 2015, 15(12): 1467-1479. DOI:10.1016/S1473-3099(15)00177-2 |
| [4] |
吴益民, 魏安明, 胡玲美, 等. 从病人血液分离的斑点热群立克次体H-5株的鉴定[J]. 中国人兽共患病杂志, 1998, 14(6): 23-26. |
| [5] |
吴益民, 张志强, 王洪军, 等. 中国东北地区远东蜱传斑点热流行病学调查[J]. 中华流行病学杂志, 2008, 29(12): 1173-1175. DOI:10.3321/j.issn:0254-6450.2008.12.001 |
| [6] |
Jia N, Jiang JF, Huo QB, et al. Rickettsia sibirica subspecies sibirica BJ-90 as a cause of human disease[J]. N Engl J Med, 2013, 369(12): 1176-1178. DOI:10.1056/NEJMc1303625 |
| [7] |
Jia N, Zheng YC, Ma L, et al. Human infections with Rickettsia raoultii, China[J]. Emerg Infect Dis, 2014, 20(5): 866-868. DOI:10.3201/eid2005.130995 |
| [8] |
Jia N, Zheng YC, Jiang JF, et al. Human infection with Candidatus Rickettsia tarasevichiae[J]. N Engl J Med, 2013, 369(12): 1178-1180. DOI:10.1056/NEJMc1303004 |
| [9] |
Zhang LJ, Liu Y, Ni DX, et al. Nosocomial transmission of human granulocytic anaplasmosis in China[J]. JAMA, 2008, 300(19): 2263-2270. DOI:10.1001/jama.2008.626 |
| [10] |
Yu XJ, Liang MF, Zhang SY, et al. Fever with thrombocytopenia associated with a novel Bunyavirus in China[J]. N Engl J Med, 2011, 364(16): 1523-1532. DOI:10.1056/NEJMoa1010095 |
| [11] |
娄丹, 吴益民, 王冰, 等. 斑点热群立克次体的一个新成员:黑龙江立克次体的分离和鉴定[J]. 中华微生物学和免疫学杂志, 1985, 5(4): 250-253. |
| [12] |
Mediannikov OY, Sidelnikov Y, Ivanov L, et al. Acute tick-borne rickettsiosis caused by Rickettsia heilongjiangensis in the Russian far East[J]. Emerg Infec Dis, 2004, 10(5): 810-817. DOI:10.3201/eid1005.030437 |
| [13] |
Ando S, Kurosawa M, Sakata A, et al. Human Rickettsia heilongjiangensis infection, Japan[J]. Emerg Infec Dis, 2010, 16(8): 1306-1308. DOI:10.3201/eid1608.100049 |
| [14] |
郝广福, 李宏, 孙毅, 等. 内蒙古部分边境口岸地区主要蜱类及蜱媒病原检测[J]. 中华流行病学杂志, 2009, 30(4): 365-367. DOI:10.3760/cma.j.issn.0254-6450.2009.04.014 |
| [15] |
李英, 李增魁, 陈刚, 等. 蜱传斑点热群立克次体青海分离株分离与遗传进化分析[J]. 中国兽医学报, 2014, 34(12): 1956-1961. |
| [16] |
张丽娟, 张景山, 付秀萍, 等. 我国南方媒介蜱中首次检出黑龙江立克次体(R.heilongjiangii)及马赛立克次体(R.massilliae)近缘菌[J]. 传染病信息, 2006, 19(2): 65-67. DOI:10.3969/j.issn.1007-8134.2006.02.010 |
| [17] |
Rydkina E, Roux V, Fetisova N, et al. New Rickettsiae in ticks collected in territories of the Former Soviet Union[J]. Emerg Infect Dis, 1999, 5(6): 811-814. DOI:10.3201/eid0506.990612 |
| [18] |
Tian ZC, Liu GY, Shen H, et al. First report on the occurrence of Rickettsia slovaca and Rickettsia raoultii in Dermacentor silvarum in China[J]. Parasit Vectors, 2012, 5: 19. DOI:10.1186/1756-3305-5-19 |
| [19] |
郝永建, 曹务春, 高淑萍, 等. 吉林省长白山区斑点热立克次体自然疫源地调查[J]. 中华流行病学杂志, 2003, 24(12): 1126-1128. DOI:10.3760/j.issn:0254-6450.2003.12.017 |
| [20] |
Zou YX, Wang QY, Fu ZX, et al. Detection of spotted fever group rickettsia in Haemaphysalis longicornis from Hebei province, China[J]. J Parasitol, 2011, 97(5): 960-962. DOI:10.1645/GE-2751.1 |
| [21] |
冯帅, 吴含, 张力文, 等. 河北省西部山区蜱传斑点热群立克次体分子流行病学研究[J]. 中国媒介生物学及控制杂志, 2013, 24(4): 308-312. DOI:10.11853/j.issn.1003.4692.2013.04.008 |
 2018, Vol. 29
2018, Vol. 29


