扩展功能
文章信息
- 潘虹, 高阳, 冯云, 韩茜, 张婧, 朱进, 李卫平, 李鸿斌, 范建华, 张海林
- PAN Hong, GAO Yang, FENG Yun, HAN Xi, ZHANG Jing, ZHU Jin, LI Wei-ping, LI Hong-bin, FAN Jian-hua, ZHANG Hai-lin
- 云南省景洪市2015年蚊虫感染病毒状况调查
- Identification of Japanese encephalitis viral infections in mosquitoes in Jinghong city, Yunnan province, China
- 中国媒介生物学及控制杂志, 2018, 29(4): 331-335
- Chin J Vector Biol & Control, 2018, 29(4): 331-335
- 10.11853/j.issn.1003.8280.2018.04.002
-
文章历史
- 收稿日期: 2018-03-20
- 网络出版时间: 2018-06-01 11:51
2 西双版纳傣族自治州疾病预防控制中心, 云南 景洪 666100
2 Xishuangbanna Prefecture Center for Diseases Control and Prevention
西双版纳傣族自治州(西双版纳州)位于云南省南部,属热带和亚热带气候,适于蚊虫孳生繁殖和虫媒病毒传播,广泛存在流行性乙型脑炎(乙脑)和登革热等多种蚊媒传染病[1-3]。西双版纳州的景洪市、勐腊县和勐海县,与缅甸和老挝接壤并设有多个国家级边境口岸,境内外人员贸易交流频繁,曾多次分离到乙脑病毒(Japanese encephalitis virus,JEV)、登革热病毒(Dengue virus,DENV)、辛德毕斯病毒(Sindbis virus)、基孔肯雅病毒(Chikungunya virus)、盖塔病毒(Getah virus)和版纳病毒(Banna virus)等[4-6],为我国虫媒病毒分布种类较多的地区。2015年西双版纳州暴发登革热疫情[3],为了解景洪市登革热流行期间伊蚊自然感染DENV和JEV情况,为相关蚊媒疾病的防治提供科学依据,我们于2015年8—9月在城区采集白天活动的蚊虫,利用RT-PCR法检测蚊虫标本中的DENV和JEV。
1 材料与方法 1.1 标本采集及处理2015年8月下旬和9月上、中旬选取景洪市城区(允景洪)24个采集点,白天用电动捕蚊器在房前屋后采集成蚊,并在积水容器中采集幼蚊和蛹带回实验室待其羽化。捕获成蚊或幼蚊羽化的成蚊置-20 ℃冷冻30 min致死,经分类鉴定,计数后分装,放入2 ml冻存管,冰排冷藏箱空运到云南省地方病防治所病毒实验室,置于-80 ℃冰箱保存,待检。
1.2 RT-PCR检测采用RT-PCR法检测DENV和JEV核酸。根据蚊虫种类及采集区将捕获蚊虫分44批,每批蚊虫30~60只。将蚊虫标本倒入预冷的无菌乳钵中,加入无血清基础培养液(MEM),研磨后移入1.5 ml离心管中,于4 ℃、离心半径8 cm,12 000 r/min离心30 min。用QIAamp Viral RNA Mini Kit(美国QIAGEN公司)提取蚊虫研磨上清液中的病毒RNA,用Ready-To-GoTM You prime First-Strand Beads试剂盒(美国GE Healthcare公司)反转录制备cDNA。使用黄病毒属(Flavivirus)引物及DENV和JEV引物(表 1),引物浓度均为0.01 mmol/L进行PCR扩增,反应体系25 μl:Green Master Mix 12.5 μl、Nuclease-Free water 9.5 μl、正、反向引物各0.5 μl、cDNA 2 μl,充分混匀。根据反应条件进行扩增,黄病毒属反应条件:94 ℃ 5 min,94 ℃ 30 s,56 ℃ 30 s,72 ℃ 40 s,35个循环,72 ℃ 10 min,4 ℃保存。JEV反应条件:①JEV-251F/JEV-925R:94 ℃ 5 min,94 ℃ 30 s,55 ℃ 30 s,72 ℃ 60 s,35个循环,72 ℃ 10 min,4 ℃保存;②JEV-251F/JEV-743R:94 ℃ 5 min,94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,35个循环,72 ℃ 10 min,4 ℃保存。DENV反应条件:94 ℃ 5 min,94 ℃ 30 s,55 ℃ 60 s,72 ℃ 120 s,35个循环,72 ℃ 10 min,4 ℃保存。反应结束后取2 μl产物进行1%琼脂糖凝胶电泳检测扩增效果。
对PCR阳性产物进行序列测定,由生工生物工程(上海)股份有限公司昆明办事处完成。使用DNAStar软件包中的SeqMan对序列片段进行拼接、编辑、校正;利用Clustal X(1.83)软件进行碱基配对及核酸和推导氨基酸序列同源性分析;应用MEGA 5.0软件邻接法(Neighbor-Joining)构建系统进化树。本研究进化分析引用来自GenBank中30株JEV C/PrM基因序列,其中基因Ⅰ型(Genotype-Ⅰ)25株、基因Ⅲ型2株、基因Ⅱ、Ⅳ和Ⅴ型各1株,外群为黄热病毒美洲株(79A,AF094612)。
2 结果 2.1 蚊类捕获情况共捕获蚊虫2 009只,其中白纹伊蚊(Aedes albopictus)896只、埃及伊蚊(Ae. aegypti)477只、刺扰伊蚊(Ae. vexans)2只和库蚊(未定种)634只。以前两种伊蚊统计,白纹伊蚊成蚊和幼虫羽化成蚊数量分别为607和289只,埃及伊蚊成蚊和幼虫羽化成蚊数量分别为35和442只;白纹伊蚊和埃及伊蚊成蚊分别占该两种伊蚊成蚊总数的94.55%(607/642)和5.45%(35/642)。
2.2 JEV和DENV核酸检测经PCR扩增,从一批白纹伊蚊和一批库蚊中均检测到JEV核酸(图 1),蚊虫标本均为现场捕获成蚊。其他蚊虫标本中未检测到JEV核酸,所有蚊虫标本的DENV核酸检测结果均为阴性。

|
| 注:M. DL2000 DNA Marker;1~22. JHM1501~JHM1522 图 1 景洪市蚊虫中JEV C/PrM基因RT-PCR检测结果 Figure 1 Results of RT-PCR detection for JEV C/PrM gene from mosquitoes in Jinghong city |
| |
经序列测定,从编号为JHM1516和JHM1517的JEV阳性扩增产物中获得这2株JEV的C/PrM基因核苷酸序列(492 bp),并与来自GenBank的30株JEV国内外参考株C/PrM基因核苷酸序列构建系统进化树。该2株病毒株与JEV-Ⅰ参考株处于同一进化支,同属基因Ⅰ型进化群,与JEV的基因Ⅱ~Ⅴ型病毒株进化关系较远。JEV(JHM1516和JHM1517)与2008年甘肃省JEV基因Ⅰ型分离株(JN381844/GSBY0804和JN381845/GSBY0827)[10]、2009年云南省弥勒县(KT229574/YN09M57)[11]和2010年德宏傣族景颇族自治州(德宏州)(KT229575/DHL10M62)[12] JEV基因Ⅰ型分离株进化关系较近,并与近几年我国南方地区流行株(FJ495189/HEN0701和HM366552/GZ56等)亲缘关系较近,见图 2。
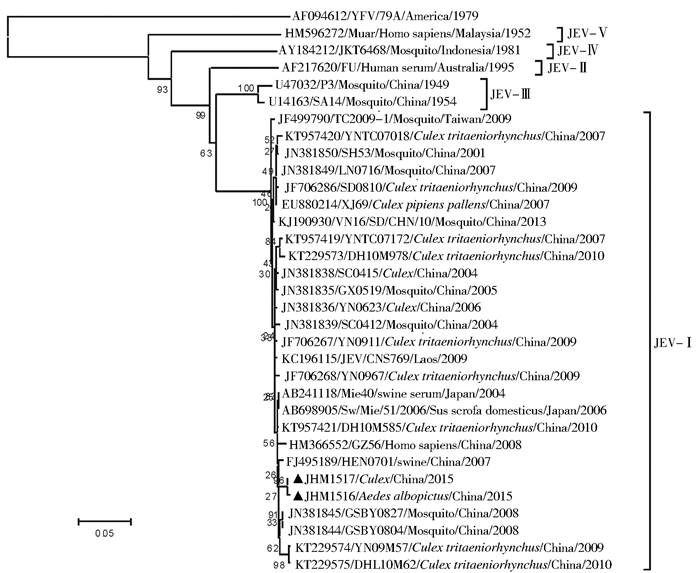
|
| 注:▲景洪市流行性乙型脑炎病毒株 图 2 景洪市2株JEV C/PrM基因核苷酸序列系统进化树 Figure 2 Phylogenetic analysis based on C/PrM gene sequence of 2 JEV strains from Jinghong city |
| |
对景洪市2株JEV(JHM1516和JHM1517)与14株JEV各基因型参考株进行C/PrM基因(240 bp)核苷酸和氨基酸同源性分析发现,2株JEV间核苷酸和氨基酸同源性均为100%,与10株JEV基因Ⅰ型参考株(云南省9株、甘肃省1株)的核苷酸和氨基酸同源性分别为96.7%~99.2%和93.8%~100%;与2009年云南省弥勒县分离株(YN0911)[13]和2006年滇西北分离株(YN0623)[14]的核苷酸和氨基酸同源性分别为97.9%~98.3%和100%;与2009年云南省绿春县分离株(YN0967)[13]的核苷酸和氨基酸同源性分别为97.5%和98.8%;与2007年云南省腾冲市病毒株(YNTC07018)[15]核苷酸和氨基酸同源性分别为97.5%和100%;与甘肃株(GSBY0827)[10]的核苷酸和氨基酸同源性分别为99.2%和100%。本研究2株JEV与基因Ⅰ~Ⅴ型参考株的核苷酸(氨基酸)同源性依次为82.9%(95.0%)、84.6%(95.0%)、79.2%(86.2%)和72.1%(81.2%),见表 2。

|
蚊虫是多种虫媒病毒的传播媒介,但不同虫媒病毒的传播蚊种不同。因此,掌握蚊虫分布特点及其自然感染虫媒病毒情况对蚊媒传染病的防制有重要意义。JEV和DENV均属于黄病毒科黄病毒属,本研究同时使用JEV和DENV特异性引物对所有蚊虫标本进行RT-PCR检测,从一批库蚊和一批白纹伊蚊标本中均检测到JEV,而DENV检测结果均为阴性。有研究报道,从西双版纳州三带喙库蚊等多种库蚊中分离到JEV[4-6],从白纹伊蚊体内分离到JEV[4-5]。本结果再次证实白纹伊蚊存在JEV自然感染。因此,白天活动蚊虫群落中的优势蚊种白纹伊蚊可传播DENV和JEV,应给予高度重视。西双版纳州2015年报道乙脑病例16例,其中景洪市2例(发病地区为景洪城区外乡镇)、勐腊县10例和勐海县4例,虽然该年度景洪市城区无病例报告,但蚊虫中仍存在JEV传播,需加强乙脑的监测和控制。本调查期间正值景洪市城区登革热流行[3],鉴于埃及伊蚊和白纹伊蚊均为白天活动蚊种,为了解伊蚊媒介携带DENV情况,本次蚊虫采集点主要是登革热疫点,采集对象主要是白天活动蚊虫。采获的所有埃及伊蚊和白纹伊蚊DENV核酸检测均为阴性,可能与采获伊蚊数量少及未采集到已感染DENV的伊蚊有关,如捕获成蚊可能大多数为自然界新羽化成蚊且未曾吸血即获得感染,而采获的蚊幼虫羽化出的成蚊数量较多,且自然界伊蚊中DENV经卵传递的概率较低,以至于本研究未能从登革热疫点的伊蚊中检测到DENV。本次DENV检测方法同时用于2015年景洪市登革热病例血清检测,效果较好[3]。因此,认为本次蚊虫DENV的检测方法可靠。本调查还证实,2015年景洪市城区广泛存在埃及伊蚊和白纹伊蚊,提示其在该年度的DENV传播中起重要作用。2016年景洪市城区仅发生个别登革热病例[16],2017年广泛流行(西双版纳州CDC登革热疫情调查资料),迄今未见当地蚊虫分离DENV报道。今后应加强伊蚊自然感染DENV的监测,为媒介蚊种的评价及防控提供科学依据。
目前,JEV分为基因Ⅰ~Ⅴ型共5种基因型[17-18]。我国有基因Ⅰ、Ⅲ和Ⅴ型流行,其中基因Ⅰ和Ⅲ型分布广泛,基因Ⅴ型仅从西藏自治区林芝市墨脱县三带喙库蚊(Cx. tritaeniorhynchus)中分离[19]。云南省2005年以前主要流行基因Ⅲ型,而2005—2010年流行株则以基因Ⅰ型为主[19-20]。20世纪80—90年代及2005年,多次从西双版纳州景洪市、勐腊和勐海县蚊虫中分离到JEV[4-6],但基因型均为基因Ⅲ型[6, 17-18]。2008年首次从西双版纳乙脑患者脑脊液中检测到JEV基因Ⅰ型[21]。本次蚊虫中检测到JEV基因Ⅰ型亦为西双版纳州首次报道,提示基因Ⅰ型可能为当地近期JEV的主要基因型。JEV C/PrM基因序列分析表明,2015年西双版纳州JEV流行株与2009年红河哈尼族彝族自治州(弥勒和绿春县)和2010年德宏州(芒市和瑞丽市)流行株及2008年甘肃株具有较近的亲缘关系和较高的同源性,表明2015年景洪市JEV流行株具有云南省JEV流行株的地域特征并与甘肃省JEV流行株进化关系较近。近几年,云南省未见有关JEV基因分型的报道。本次检测的基因Ⅰ型病毒株对于了解云南省JEV基因型的地区和时间分布有重要的流行病学意义。
乙脑在西双版纳州广泛分布,属云南省乙脑主要流行区[1],近几年的发病率有所下降。本调查发现,2015年景洪市城区存在JEV基因Ⅰ型流行,结合以往调查资料,该市乃至全州广泛分布三带喙库蚊及白纹伊蚊等JEV媒介蚊种。因此,今后仍需加强该地区的乙脑病例及其媒介蚊虫的监测和防控,防止乙脑的大范围流行。
| [1] |
朱秋艳, 胡筱莛, 李琼芬, 等. 云南省2005-2015年流行性乙型脑炎流行病学特征分析[J]. 中国疫苗和免疫, 2017, 23(1): 52-57. |
| [2] |
Hu TS, Zhang HL, Feng Y, et al. Epidemiological and molecular characteristics of emergent Dengue virus in Yunnan province near the China-Myanmar-Laos border, 2013-2015[J]. BMC Infect Dis, 2017, 17(1): 331. DOI:10.1186/s12879-017-2401-1 |
| [3] |
李园园, 冯云, 范建华, 等. 2015年云南省西双版纳州登革2型病毒暴发疫情的调查研究[J]. 中华实验和临床病毒学杂志, 2016, 30(4): 340-345. DOI:10.3760/cma.j.issn.1003-9279.2016.04.002 |
| [4] |
张海林, 施华芳, 米竹青, 等. 云南省西双版纳州蚊虫分布特点及与虫媒病毒的关系[J]. 地方病通报, 2000, 15(4): 35-38. DOI:10.13215/j.cnki.jbyfkztb.2000.04.015 |
| [5] |
张海林, 自登云, 米竹青, 等. 云南白纹伊蚊分布特点及与虫媒病毒的关系[J]. 中国媒介生物学及控制杂志, 2011, 12(2): 103-105. DOI:10.3969/j.issn.1003-4692.2001.02.007 |
| [6] |
Wang JL, Zhang HL, Sun XH, et al. Distribution of mosquitoes and mosquito-borne arboviruses in Yunnan province near the China-Myanmar-Laos border[J]. Am J Trop Med Hyg, 2011, 84(5): 738-746. DOI:10.4269/ajtmh.2011.10-0294 |
| [7] |
Kuno G, Chang GJ, Tsuchiya KR, et al. Phylogeny of the genus Flavivirus[J]. J Virol, 1998, 72(1): 73-83. |
| [8] |
Wang HY, Takasaki T, Fu SH, et al. Molecular epidemiological analysis of Japanese encephalitis virus in China[J]. J Gen Virol, 2007, 88: 885-894. DOI:10.1099/vir.0.82185-0 |
| [9] |
Lanciotti RS, Calisher CH, Gubler DJ, et al. Rapid detection and typing of dengue viruses from clinical samples by using reverse transcriptase-polymerase chain reaction[J]. J Clin Microbiol, 1992, 30(3): 545-551. |
| [10] |
李铭华, 付士红, 冯云, 等. 2008年甘肃省新分离乙脑病毒的分子生物学特征[J]. 中华实验和临床病毒学杂志, 2009, 23(4): 251-253. DOI:10.3760/cma.j.issn.1003-9279.2009.04.005 |
| [11] |
冯云, 陈卫武, 杨卫红, 等. 云南省弥勒县2009年蚊媒病毒分离和鉴定[J]. 中国媒介生物学及控制杂志, 2012, 23(5): 402-405. |
| [12] |
Zhang HL, Zhang YZ, Yang WH, et al. Mosquitoes of western Yunnan province, China:seasonal abundance, diversity, and arbovirus associations[J]. PLoS One, 2013, 8(10): e77017. DOI:10.1371/journal.pone.0077017 |
| [13] |
杨杜鹃, 付士红, 张海林, 等. 云南省东北等地区蚊虫及蚊媒病毒调查研究[J]. 中国媒介生物学及控制杂志, 2011, 22(4): 304-308, 312. |
| [14] |
孙肖红, 王环宇, 潘晓玲, 等. 中国滇西北地区分离流行性乙型脑炎病毒的分子特征研究[J]. 中华流行病学杂志, 2009, 30(6): 606-610. DOI:10.3760/cma.j.issn.0254-6450.2009.06.017 |
| [15] |
冯云, 李胜国, 张海林, 等. 云南腾冲县新分离乙型脑炎和盖塔病毒的分子生物学特征[J]. 中国人兽共患病学报, 2014, 30(4): 353-357. DOI:10.3969/cjz.j.issn.1002-2694.2014.04.003 |
| [16] |
范建华, 胡挺松, 张海林, 等. 西双版纳州2016年登革1型和2型病毒疫情的流行病学调查[J]. 中国热带医学, 2017, 17(10): 982-987. DOI:10.13604/j.cnki.46-1064/r.2017.10.07 |
| [17] |
Chen WR, Tesh RB, Rico-Hesse R. Genetic variation of Japanese encephalitis virus in nature[J]. J Gen Virol, 1990, 71(12): 2915-2922. DOI:10.1099/0022-1317-71-12-2915 |
| [18] |
Solomon T, Ni H, Beasley DW, et al. Origin and evolution of Japanese encephalitis virus in Southeast Asia[J]. J Virol, 2003, 77(5): 3091-3098. DOI:10.1128/JVI.77.5.3091-3098.2003 |
| [19] |
孙玉杰, 张海林. 中国流行性乙型脑炎病毒基因型及分布[J]. 中国媒介生物学及控制杂志, 2012, 23(5): 436-439. |
| [20] |
冯云, 张海林, 杨卫红, 等. 云南省1977-2010年流行性乙型脑炎病毒分子流行病学研究[J]. 中华流行病学杂志, 2016, 37(11): 1519-1525. DOI:10.3760/cma.j.issn.0254-6450.2016.11.017 |
| [21] |
袁军, 付士红, 张海林, 等. 云南省脑炎患者脑脊液中检测到基因Ⅰ和Ⅲ型流行性乙型脑炎病毒[J]. 中国病毒病杂志, 2014, 4(3): 187-191. DOI:10.16505/j.2095-0136.2014.03.009 |
 2018, Vol. 29
2018, Vol. 29



