扩展功能
文章信息
- 刘小波, 郭玉红, 吴海霞, 李全成, 岳玉娟, 任东升, 李贵昌, 宋秀平, 王君, 鲁亮, 刘起勇
- LIU Xiao-bo, GUO Yu-hong, WU Hai-xia, LI Quan-cheng, YUE Yu-juan, REN Dong-sheng, LI Gui-chang, SONG Xiu-ping, WANG Jun, LU Liang, LIU Qi-yong
- 2015-2017年我国媒介伊蚊幼蚊监测结果分析
- National surveillance on larval Aedes mosquito in China, 2015-2017
- 中国媒介生物学及控制杂志, 2018, 29(4): 325-330
- Chin J Vector Biol & Control, 2018, 29(4): 325-330
- 10.11853/j.issn.1003.8280.2018.04.001
-
文章历史
- 收稿日期: 2018-07-03
- 网络出版时间: 2018-07-06 16:50
2 宁夏医科大学第二附属医院, 银川 750001
2 The Second Affiliated Hospital of Ningxia Medical University
近年来,媒介伊蚊及其传播疾病如登革热、基孔肯雅热、黄热病和寨卡病毒病等已成为全球普遍关注的公共卫生热点并构成我国重要的公共卫生问题[1-2]。为有效应对媒介伊蚊及其传播疾病的威胁,中国CDC于2014年颁布了《登革热防治技术指南》[中疾控传防发(2014)360号],在全国层面对各地媒介伊蚊监测、风险评估和控制工作进行了科学指导。本研究分析了2015—2017年我国23个省(自治区、直辖市)媒介伊蚊幼蚊监测结果,研究结果可为厘清我国媒介伊蚊时空发生规律及伊蚊传播疾病的科学精准防控奠定基础[3]。
1 材料与方法 1.1 数据来源媒介伊蚊幼蚊监测资料来源于我国登革热中转支付项目全国媒介伊蚊监测点2015—2017年各地逐月上报的数据。
1.2 监测点选择根据中国CDC《关于印发登革热防治技术指南的通知》中《媒介伊蚊监测指南》,涉及的Ⅰ类省份包括广东、云南、广西、海南、福建和浙江省(自治区)共6个;Ⅱ类省份包括上海、重庆、江苏、安徽、江西、河南、湖北、湖南、四川和贵州省(直辖市)共10个;Ⅲ类省份包括北京、河北、山西、天津、山东、陕西和辽宁省(直辖市)共7个。在上述23个登革热中转支付项目省份开展媒介伊蚊监测。需要说明的是,虽然甘肃省陇南市和西藏自治区林芝市也存在白纹伊蚊(Aedes albopictus)分布,但目前两省尚未纳入登革热中转支付媒介伊蚊监测,因此不在本研究范畴。
1.3 监测方法及频次根据《媒介伊蚊监测指南》,媒介伊蚊幼蚊监测采用布雷图指数(BI)法和诱蚊诱卵器指数(MOI)法;各监测点根据当地情况至少选择1种。关于监测频率,Ⅰ类省份规定登革热高风险区域的蚊虫活动季节,每月2次,间隔10~15 d;Ⅱ类省份5—10月,每月1次;Ⅲ类省份6—9月,每月1次。
1.4 相关定义及计算本研究涉及的媒介伊蚊幼虫密度指标包括BI和MOI。计算公式:

|

|
根据《媒介伊蚊监测指南》,BI和MOI<5为控制登革热传播的阈值,≥5有传播风险,≥10有暴发风险,≥20有区域流行风险。
1.6 统计学分析采用SPSS 20.0和Excel 2007软件对选取的2015—2017年媒介伊蚊幼蚊监测结果进行数据整理及统计分析。
2 结果 2.1 一般情况2015年,全国23个省(自治区、直辖市)285个市、县(区)开展了媒介伊蚊幼蚊监测,其中,Ⅰ类省份监测市、县(区)104个,Ⅱ类省份146个,Ⅲ类省份35个。2016年,全国21个省(自治区、直辖市)3 305个市、县(区)采用BI法开展媒介伊蚊幼蚊监测,其中,Ⅰ类省份监测市、县(区)2 241个,Ⅱ类省份960个,Ⅲ类省份104个;同年,全国7个省630个市、县(区)采用MOI法开展媒介伊蚊幼蚊监测,其中,Ⅰ类省份监测市、县(区)467个,Ⅱ类省份131个,Ⅲ类省份32个。2017年,全国21个省(自治区、直辖市)的3 499个市、县(区)采用BI法开展媒介伊蚊幼蚊监测,其中,Ⅰ类省份监测市、县(区)2 436个,Ⅱ类省份939个,Ⅲ类省份124个;同年,全国6个省643个市、县(区)采用MOI法开展媒介伊蚊幼蚊监测,其中,Ⅰ类省份501个县(区),Ⅱ类省份108个县(区),Ⅲ类省份34个县(区)。
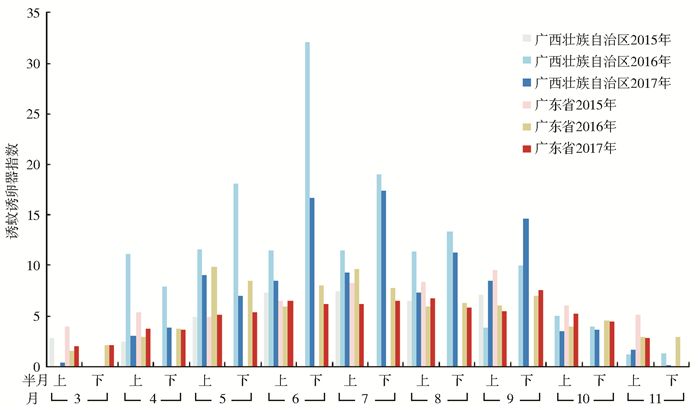
2.2 不同省份、不同时间媒介伊蚊幼蚊的BI 2.2.1 Ⅰ类地区海南省全年、浙江和福建省4—11月、广西壮族自治区(广西)4—9月以及云南省6—10月的媒介伊蚊幼蚊BI均>5,达到登革热传播风险,见图 1。广西4—10月和广东省3—11月的MOI>5,与同期BI监测呈现较为一致的趋势,见图 2。

|
| 图 1 2015—2017年不同省份、不同月份媒介伊蚊幼蚊布雷图指数 Figure 1 Breteau index in different provinces in different months, 2015-2017 |
| |
|
| 图 2 2015—2017年广西和广东省不同月份媒介伊蚊幼蚊诱蚊诱卵器指数 Figure 2 Mosquito-ovitrap index in Guangxi and Guangdong in different months, 2015-2017 |
| |
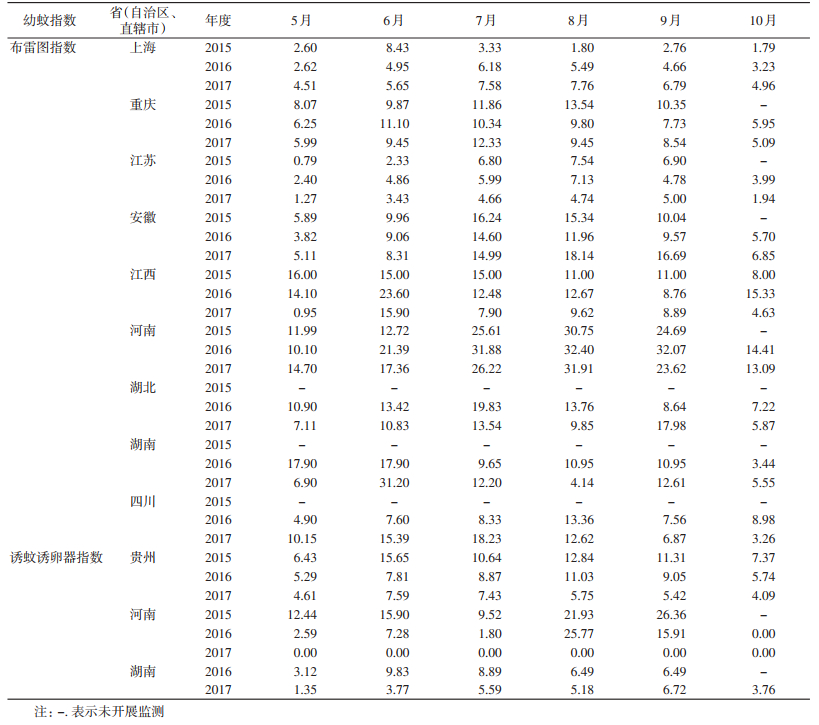
研究期内(5—10月)的大多数月份,重庆、安徽、江西、河南、湖北和四川省(直辖市)伊蚊幼蚊BI>5,且河南和湖北省大多数月份BI>10,达到登革热暴发水平。5—9月间的大多数月份,上海市和湖南省媒介伊蚊幼蚊BI>5,且近年来上海市媒介伊蚊幼蚊密度呈现逐年上升态势,见表 1。
|
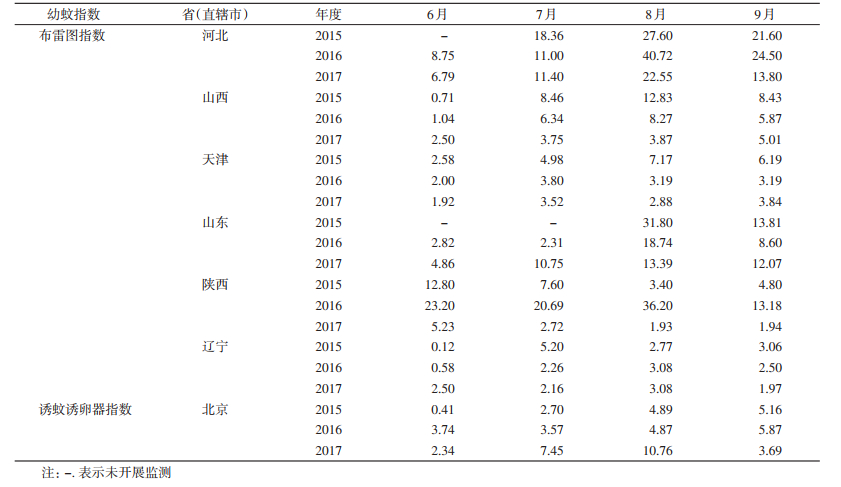
2016—2017年6—9月河北省各监测点媒介伊蚊幼蚊BI均>5;2017年7—9月山东省各监测点BI均>5;2015年5—6月、2016年研究期内及2017年5月陕西省各监测点媒介伊蚊幼蚊BI均>5。2015—2017年北京、天津市和辽宁省监测点媒介伊蚊幼蚊BI相对较低,仅个别月份BI曾达到5,见表 2。
|
本研究首次对2015—2017年全国媒介伊蚊幼蚊监测数据进行分析,研究结果对于未来我国各地媒介伊蚊及其传播疾病的风险评估、预测预警及可持续精准控制提供了基础资料[4]。
近3年媒介伊蚊幼蚊监测资料显示,我国Ⅰ类地区的6个省份较Ⅱ类和Ⅲ类地区的大多数省份媒介伊蚊幼蚊密度整体为高。其中,海南省全年、浙江和福建省4—11月、广西4—9月以及云南省6—10月的媒介伊蚊幼蚊BI>5,超过登革热传播阈值。虽然研究期内的云南和广东省媒介伊蚊幼蚊BI较其他几个Ⅰ类省份为低,但是广东省曾超过一半的监测市、云南省监测的少数州、市、县媒介伊蚊曾超过5。既往研究显示,各地媒介伊蚊幼蚊密度的高低与当地的生态环境、媒介伊蚊控制力度[5]、孳生水体和孳生地数量、当地血源动物数量、开展媒介伊蚊监测时的气象条件[6-8]、媒介伊蚊对常用公共卫生杀虫剂的抗性水平[9]以及监测方法的敏感性等复杂的自然和社会因素相关。众所周知,广东和云南两地是我国南方的重要省份,广东省经济发达、交通便捷、人口流动性大,云南省与多国交接,两地均为近年来我国登革热疫情暴发热点地区。为确保当地居民的身体健康和生命安全,均采取了强有力的媒介伊蚊控制措施,这也能从一定程度上解释广东和云南省监测到的媒介伊蚊幼蚊BI较其他省份低的原因。MOI监测也发现,广西4—10月和广东省3—11月的MOI>5,季节消长规律与BI监测呈现类似的趋势。此外,对比分析也发现,广东省和广西同期大多数月份MOI值高于BI值,后续研究应进一步分析两地同期BI与MOI的关系,确定更为敏感和可操作性强的方法及密度指标,便于指导两地开展媒介伊蚊及其传播疾病防控工作。
Ⅱ类地区中,重庆、安徽、江西、河南、湖北和四川省(直辖市)研究期内(5—10月)的大多数月份伊蚊幼蚊BI>5,且河南和湖北省大多数月份BI>10,达到伊蚊传播疾病暴发水平。上海市和湖南省5—9月大多数月份的媒介伊蚊幼蚊BI>5,且近年来上海市媒介伊蚊密度呈现逐年升高态势,人口多,流动性极大,应引起高度重视。江苏省大多数月份BI<5,当地媒介伊蚊控制措施有效,也可解释当地登革热等伊蚊传播疾病低发的原因。贵州、河南和湖南省也开展了MOI监测,贵州省5—10月、河南和湖南省6—9月MOI曾超过5。因河南省许昌市曾出现登革热本地暴发疫情,加之近3年来监测当地媒介伊蚊密度较高,应采取有针对性的防控措施切实降低媒介伊蚊密度及伊蚊传播疾病的风险。
研究显示,Ⅲ类地区整体伊蚊幼蚊密度较Ⅰ类和Ⅱ类地区为低。2016—2017年6—9月河北省媒介伊蚊幼蚊BI均>5,2017年7—9月山东省媒介伊蚊幼蚊BI均>5,2015年6—7月、2016年研究期内及2017年5月陕西省BI均>5,北京市近3年来7—9月BI也曾超过5。需要关注的是,2017年8—10月山东省济宁市曾出现登革热本地暴发疫情,应加强监测并及时做好风险评估。河北省毗邻我国首都北京市,近3年的监测期内大多数月份BI均达到登革热传播阈值,如媒介伊蚊控制措施不得力,一旦出现输入传染源,极有可能快速传播蔓延,威胁首都北京的安全。此外,北京市重点月份媒介伊蚊密度相对较高,且极为不利的因素为媒介伊蚊监测点仅覆盖5个区,下一步应力争各个区的全覆盖,才能更好地控制媒介伊蚊密度,确保首都人民的身体健康与生命安全。
鉴于我国埃及伊蚊(Ae. aegypti)的分布范围相对局限[10-12]、个别地区媒介伊蚊监测资料的可获得性和机构人员队伍所限,当前媒介伊蚊幼蚊监测分析并未进一步区分埃及伊蚊和白纹伊蚊[13],后续研究可进一步细化研究。与此同时,随着时代的发展,当前媒介伊蚊幼蚊BI监测出现了新问题,如普遍存在入户难的问题,加之不同监测者对于户外媒介伊蚊不同栖息生境的选择和户的界定差异,上述情况均对媒介伊蚊幼蚊BI监测的客观性构成了一定影响。最为关键的是,当前大多数监测省份未进行媒介伊蚊携带病原体如登革热病毒等的检测,对于其传播疾病的精准评估及科学防控形成挑战,后续研究亟待加强。
志谢: 本研究得到各监测省(自治区、直辖市)相关卫生行政机构和疾病预防控制机构的大力支持,特此志谢| [1] |
Lessler J, Chaisson LH, Kucirka LM, et al. Assessing the global threat from Zika virus[J]. Science, 2016, 353(6300): aaf8160. DOI:10.1126/science.aaf8160 |
| [2] |
Sun JM, Lu L, Wu HX, et al. Epidemiological trends of dengue in mainland China, 2005-2015[J]. Int J Infect Dis, 2017, 57: 86-91. DOI:10.1016/j.ijid.2017.02.007 |
| [3] |
刘起勇. 媒介生物控制面临的挑战与媒介生物可持续控制策略[J]. 中华流行病学杂志, 2012, 33(1): 1-8. DOI:10.3760/cma.j.issn.0254-6450.2012.01.001 |
| [4] |
刘小波, 吴海霞, 鲁亮. 对话刘起勇:媒介伊蚊可持续控制是预防寨卡病毒病的杀手锏[J]. 科学通报, 2016, 61(21): 2323-2325. DOI:10.1360/N972016-00734 |
| [5] |
Guo YH, Lai SJ, Liu XB, et al. Governmental supervision and rapid detection on dengue vectors:an important role for dengue control in China[J]. Acta Trop, 2016, 156: 17-21. DOI:10.1016/j.actatropica.2015.12.011 |
| [6] |
Xu L, Stige LC, Chan KS, et al. Climate variation drives dengue dynamics[J]. Proc Natl Acad Sci USA, 2017, 114(1): 113-118. DOI:10.1073/pnas.1618558114 |
| [7] |
Jia PF, Chen X, Chen J, et al. How does the dengue vector mosquito Aedes albopictus respond to global warming?[J]. Parasit Vectors, 2017, 10(1): 140. DOI:10.1186/s13071-017-2071-2 |
| [8] |
Xiang JJ, Hansen A, Liu QY, et al. Association between dengue fever incidence and meteorological factors in Guangzhou, China, 2005-2014[J]. Environ Res, 2017, 153: 17-26. DOI:10.1016/j.envres.2016.11.009 |
| [9] |
Wang YG, Liu X, Li CL, et al. A survey of insecticide resistance in Aedes albopictus(Diptera:Culicidae)during a 2014 dengue fever outbreak in Guangzhou, China[J]. J Econ Entomol, 2017, 110(1): 239-244. DOI:10.1093/jee/tow254 |
| [10] |
杨明东, 姜进勇, 郑宇婷, 等. 云南省边境地区埃及伊蚊分布调查[J]. 中国媒介生物学及控制杂志, 2015, 26(4): 406-408. DOI:10.11853/j.issn.1003.4692.2015.04.020 |
| [11] |
蔡传烈, 王爱民, 许炳芬, 等. 雷州半岛埃及伊蚊的分布、生态、密度与季节消长的研究[J]. 中国国境卫生检疫杂志, 2007, 30(6): 361-364, 370. DOI:10.3969/j.issn.1004-9770.2007.06.012 |
| [12] |
黄健人, 李继龙, 王树声, 等. 广西清除埃及伊蚊研究[J]. 广西预防医学, 2005, 11(3): 194. |
| [13] |
刘小波, 吴海霞, 郭玉红, 等. 2016年中国媒介伊蚊密度监测结果分析[J]. 疾病监测, 2018, 33(2): 144-149. DOI:10.3784/j.issn.1003-9961.2018.02.008 |
 2018, Vol. 29
2018, Vol. 29


