扩展功能
文章信息
- 周水茂, 李联军, 贾西帅, 杨燕, 徐明星, 陈芳
- ZHOU Shui-mao, LI Lian-jun, JIA Xi-shuai, YANG Yan, XU Ming-xing, CHEN Fang
- 输入性恶性疟原虫Pfcrt和pfmdr1基因突变关联性分析
- Correlation analysis on mutations of chloroquine resistant transporter and multi-drug resistance 1 gene in Plasmodium falciparum imported to Wuhan, China
- 中国媒介生物学及控制杂志, 2018, 29(3): 242-245
- Chin J Vector Biol & Control, 2018, 29(3): 242-245
- 10.11853/j.issn.1003.8280.2018.03.006
-
文章历史
- 收稿日期: 2017-10-24
- 网络出版时间: 2018-04-11 14:11
2 湖北省黄梅大河中心医院, 湖北 黄冈 435500
2 Hubei Huangmei Dahe Center Hospital
疟疾是一种严重危害人类健康的虫媒传播寄生虫病,以恶性疟最为严重,据WHO统计,2015年全球约有2.14亿疟疾病例,死亡约43.8万例,非洲死亡病例约占88%[1-2]。20世纪50年代末抗氯喹恶性疟原虫(Plasmodium falciparum)先后在东南亚、南美地区出现,并传播迅速,其抗药性从单药抗性向多药抗性发展,使疟疾防治更加艰难[3]。目前,恶性疟原虫的药物抗性在分子水平上的研究有较大进展,所有抗药性株均在位于7号染色体上恶性疟原虫氯喹抗性转运蛋白基因(P. falciparum chloroquine resistant transporter gene,Pfcrt)Pfcrt76位点发生了点突变,位于5号染色体上的恶性疟原虫多药抗性基因1(P. falciparum multidrug resistance 1 gene,pfmdr1)不同程度的点突变可导致疟原虫对氯喹产生不同程度的抗性[4-6],并认为氯喹抗性由多基因位点变异所致[7-8]。本研究采集从非洲、东南亚等疟疾流行区回国人员的疟疾现症患者血样,应用限制性片段长度多态性聚合酶链式反应(PCR-RFLP)检测Pfcrt和pfmdr1基因点突变,探究输入性恶性疟原虫Pfcrt和pfmdr1基因多态性及其关联性。
1 材料与方法 1.1 样本采集采集对象为2009—2016年非洲和东南亚等疟疾流行区确诊为恶性疟回国患者。采集患者手指或耳垂血,制作约ϕ1.2 cm的滤纸血斑,滤纸血自然干燥后封入塑料袋,4 ℃保存。
1.2 流行病学调查收集患者姓名、性别、年龄、工种、出国国家、国外停留时间、患者症状、体征及用药和治疗情况等资料。按临床症状重轻分重度和轻度2种,有重度贫血、溶血、休克、肺水肿、肝肾功能衰竭和脑损害等症状为重度;仅寒战、发热、盗汗及胃肠反应等症状,但无并发症为轻度[9]。本调查获得武汉市CDC伦理委员会的认证,获得了患者的知情同意。
1.3 仪器和试剂PTC-200 Peltier Thermal Cycler梯度PCR仪(美国Bio-Rad公司);Gene Genius Bio-Imaging System凝胶成像系统(英国Syngene公司);ColeParmer28560-00电泳仪(美国热电公司)。Taq DNA聚合酶购自加拿大BioStar公司,100 bp DNA标志物购自华美生物工程有限公司,dNTP购自美国Pharmacia公司,ApoⅠ、AseⅠ和EcoRv限制性内切酶购自欧洲联盟Fermentas公司,琼脂糖购自法国BIOWEST公司,PCR引物由上海英骏生物技术有限公司合成。
1.4 PCR模板的制备滤纸血剪成约3 mm×3 mm,置1.5 ml离心管中,按文献[10]操作,恶性疟原虫模板于20 μl无菌蒸馏水保留,-20 ℃保存。
1.5 巢式PCR扩增Pfcrt和pfmdr1根据Pfcrt和pfmdr1基因相关位点设计引物,分别扩增出含有Pfcrt76和pfmdr186、1042、1246位点氨基酸目的片段,引物序列见表 1。PCR反应体系和反应条件按文献[11]操作。

|
取第2轮PCR扩增产物10 μl,缓冲液2 μl,限制性内切酶0.5 μl,用ddH2O补充至20 μl,37 ℃过夜,取8 μl酶切产物电泳,观察结果。ApoⅠ酶切Pfcrt76扩增产物,酶切后野生型和突变型基因片段长度分别约为100和134 bp;ApoⅠ酶切pfmdr186扩增产物,酶切后野生型和突变型基因片段长度分别约为300和520 bp;AseⅠ酶切pfmdr11042扩增产物,酶切后野生型和突变型基因片段长度分别约为120和250 bp;EcoRv酶切pfmdr11246扩增产物,酶切后野生型和突变型基因片段长度分别约为410和200 bp。
1.7 统计学处理采用Excel 2003软件建立数据库,定性资料采用率进行统计描述,组间比较用χ2检验或趋势χ2检验及连锁不平衡分析,检验水准为α=0.05。
2 结果 2.1 病例情况共调查输入性恶性疟原虫患者232例,其中从非洲返回201例(重症38例),东南亚31例(重症3例)。
2.2 Pfcrt和pfmdr1基因各位点酶切结果恶性疟现症患者血样232例均扩增出Pfcrt和pfmdr1基因。Pfcrt76和pfmdr186、1042、1246位点经ApoⅠ、AseⅠ和EcoRv内切酶酶切,分别检出128、40、12和20例突变,突变型基因DNA片段长度分别约为134、520、250和200 bp(图 1)。
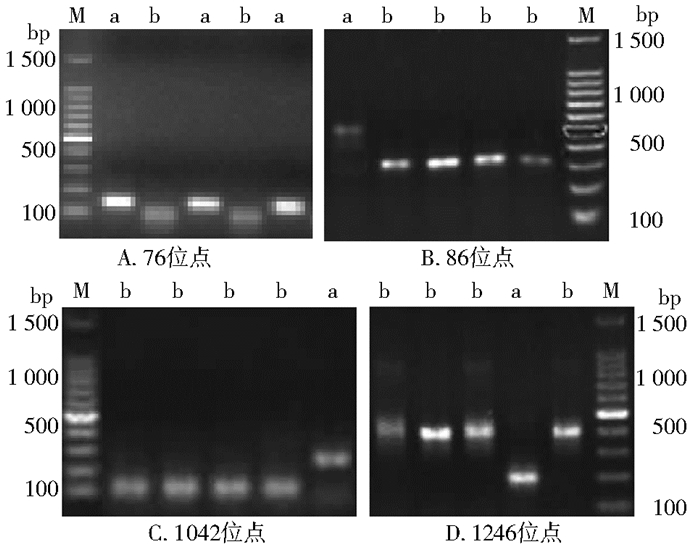
|
| 图 1 Pfcrt和pfmdr1基因内切酶酶切结果 Figure 1 Restriction enzyme digestion results of Pfcrt and pfmdr1 genes |
| |
232例输入性恶性疟患者Pfcrt76和pfmdr186、1042、1246位点突变率分别为55.2%、17.2%、5.2%和8.6%,pfmdr1总突变率为26.3%,见表 2。输入地为非洲的患者血样Pfcrt76及pfmdr186、1042、1246位点突变率分别为52.2%、19.9%、3.0%和10.0%;输入地为东南亚的患者血样Pfcrt76及pfmdr11042位点突变率分别为74.2%和19.4%,未检出pfmdr186和pfmdr11246位点突变;非洲和东南亚pfmdr11042点突变率差异有统计学意义(χ2=14.700,P<0.05)。
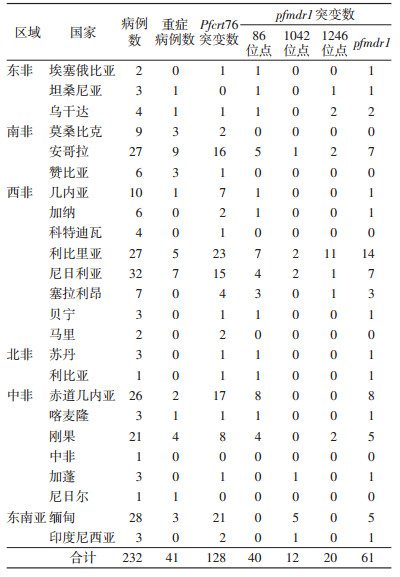
|
201例非洲输入性恶性疟患者,105例Pfcrt76突变型pfmdr186、1042、1246位点和pfmdr1总突变率分别为28.6%、3.8%、12.4%和36.2%;96例Pfcrt76野生型中,pfmdr186、1042、1246位点和pfmdr1总突变率分别为10.4%、2.1%、7.3%和17.7%。Pfcrt76与pfmdr186位点突变和pfmdr1突变呈正相关(P<0.05),与pfmdr11042、1246位点突变差异无统计学意义(P>0.05)。Pfcrt76与pfmdr186、1042、1246位点突变连锁不平衡分析,D′和r2分别为0.520和0.063、0.390和0.052、0.146和0.001、0.250和0.008。
2.5 患者症状与恶性疟原虫Pfcrt和pfmdr1基因位点突变关系检测输入性疟疾患者232例,其中41例重症患者Pfcrt76和pfmdr186、1042、1246位点突变分别为31、5、0和5例;191例轻度症状患者中,Pfcrt76和pfmdr186、1042、1246位点突变分别为97、35、12和15例,差异均无统计学意义(P>0.05)。患者症状与Pfcrt76、pfmdr186、1042、1246位点突变连锁不平衡分析,D′和r2分别为0.230和0.018、0.290和0.004、0.996和0.012、0.150和0.035。
3 讨论2015年全国疟疾疫情总体特征为境外输入性病例继续增多,其中恶性疟占61%[12-13]。疟疾是危害我国居民健康最严重的传染病之一,疟原虫的耐药性是全球性难题,对疟疾防治有重要影响[14-16]。抗疟药物的选择和疟原虫药物的抗性监测非常重要,在抗性监测中,分子标记技术得到广泛运用[14],输入性疟疾抗药性监测数据为输入病例的管理和抗药性情况提供信息支持。
检测232例输入性恶性疟原虫Pfcrt76、pfmdr186、1042和1246位点,非洲和东南亚恶性疟原虫Pfcrt76基因突变率分别为52.2%和74.2%,差异无统计学意义(P>0.05),但非洲恶性疟原虫Pfcrt76基因突变率低于应用青蒿素综合疗法(ACT)前,改用青蒿素抗疟药后,抗性程度呈明显下降趋势[9]。东南亚病例中,pfmdr186位点未检出突变,与王珊珊等[17]报道结果一致,非洲病例pfmdr186位点突变率为19.9%,明显低于国内外报道结果[18-19],可能与2006年后非洲国家采用ACT有关[20],采用ACT后pfmdr1基因突变明显下降[21-23]。东南亚国家pfmdr11042位点突变率(19.4%)明显高于非洲国家(3.0%),与国外研究结果一致[5]。东南亚病例pfmdr11246位点未检出突变,而非洲病例pfmdr11246位点突变率为10.0%,高于国外报道结果[24],pfmdr11246位点突变主要在南美洲的恶性疟原虫分离株,在非洲和亚洲很少发现[24],可能与非洲流动人员增加及非洲国家2006年后使用ACT有关,有待进一步研究。不同地理位置恶性疟种群pfmdr1多态性分布有一定差异[25]。非洲输入性恶性疟患者Pfcrt76突变与pfmdr186点突变和pfmdr1总突变呈正相关(P<0.05),与国外研究结果一致[24]。连锁不平衡分析显示,Pfcrt和pfmdr1基因突变存在连锁关系,联合突变可能性较高,但与pfmdr11042、1246位点突变差异无统计学意义(P>0.05),可能因pfmdr11042、1246位点突变数量不够,影响结果,患者症状程度与恶性疟原虫Pfcrt和pfmdr1基因位点突变与否,差异无统计学意义(P>0.05),但连锁不平衡分析显示,患者症状程度与pfmdr11042基因位点突变存在连锁关系,认为pfmdr11042、1246突变可降低虫体对氯喹的耐药性程度[25]。疟原虫药物抗性由多基因变异所致,Pfcrt76点突变是产生氯喹抗药性的关键,与氯喹抗性关系最为密切,认为与恶性疟原虫对氯喹产生抗性高度相关[24-27]。pfmdr186被认为是仅次于Pfcrt76的重要抗性位点,对恶性疟原虫基因多态性进行连续监测有助于了解某些地区的药物抗性,确定在该地区抗疟药的使用政策,并根据抗药性基因突变变化趋势防止新药物产生抗性,为氯喹等传统抗疟药重新使用的可行性提供实验依据,对合理选择抗疟药物等有重要意义。
| [1] |
Chandra RS, Orazem J, Ubben D, et al. Creative solutions to extraordinary challenges in clinical trials:methodology of a phase Ⅲ trial of azithromycin and chloroquine fixed-dose combination in pregnant women in Africa[J]. Malar J, 2013, 12: 122. DOI:10.1186/1475-2875-12-122 |
| [2] |
World Health Organization. World malaria report 2015[R]. Geneva: WHO, 2015.
|
| [3] |
Mita T, Tanabe K. Evolution of Plasmodium falciparum drug resistance:implications for the development and containment of artemisinin resistance[J]. Jpn J Infect Dis, 2012, 65(6): 465-475. DOI:10.7883/yoken.65.465 |
| [4] |
Picot S, Olliaro P, de Monbrison F, et al. A systematic review and Meta-analysis of evidence for correlation between molecular markers of parasite resistance and treatment outcome in falciparum malaria[J]. Malar J, 2009, 8: 89. DOI:10.1186/1475-2875-8-89 |
| [5] |
Mungthin M, Suwandittakul N, Chaijaroenkul W, et al. The patterns of mutation and amplification of Plasmodium falciparum Pfcrt and pfmdr1 genes in Thailand during the year 1988 to 2003[J]. Parasitol Res, 2010, 107(3): 539-545. DOI:10.1007/s00436-010-1887-x |
| [6] |
Dajem SMB, Al-Qahtani A. Analysis of gene mutations involved in chloroquine resistance in Plasmodium falciparum parasites isolated from patients in the southwest of Saudi Arabia[J]. Ann Saudi Med, 2010, 30(3): 187-192. DOI:10.4103/0256-4947.62826 |
| [7] |
Wellems TE, Panton LJ, Gluzman HY, et al. Chloroquine resistance not linked to mdr-like genes in a Plasmodium falciparum cross[J]. Nature, 1990, 345(6272): 253-255. DOI:10.1038/345253a0 |
| [8] |
Wellems TE, Walker-Jonah A, Panton LJ. Genetic mapping of the chloroquine-resistance locus on Plasmodium falciparum chromosome 7[J]. Proc Natl Sci USA, 1991, 88(8): 3382-3386. DOI:10.1073/pnas.88.8.3382 |
| [9] |
汤林华. 输入性疟疾的诊治与管理[M]. 上海: 上海科学技术出版社, 2010: 30-45.
|
| [10] |
周水茂, 杨燕, 吴凯, 等. 非洲输入性恶性疟病例裂殖子表面蛋白1等位基因型检测[J]. 中国寄生虫学与寄生虫病杂志, 2015, 33(4): 247-250. |
| [11] |
周水茂, 杨燕, 陈智, 等. 输入性恶性疟原虫Pfcrt基因76位点多态性分析[J]. 中国血吸虫病防治杂志, 2013, 25(4): 402-404. |
| [12] |
张丽, 丰俊, 张少森, 等. 2015年全国疟疾疫情分析[J]. 中国寄生虫学与寄生虫病杂志, 2016, 34(6): 477-481. |
| [13] |
郭传坤, 黎军, 林康明, 等. 广西2010-2012年输入性疟疾流行病学分析[J]. 中国媒介生物学及控制杂志, 2014, 25(4): 333-336. |
| [14] |
王亚丽, 王煊, 张彦平. 2005-2013年全国本地感染与境外输入疟疾流行病学特征分析[J]. 中国媒介生物学及控制杂志, 2015, 26(2): 120-126. |
| [15] |
官亚宜, 汤林华. 恶性疟原虫药物抗性相关的分子标记及其在药物抗性监测中的应用[J]. 中国寄生虫学与寄生虫病杂志, 2005, 23(2): 117-120. |
| [16] |
张逸龙, 潘卫庆. 恶性疟原虫对青蒿素产生抗性的研究进展[J]. 中国寄生虫学与寄生虫病杂志, 2015, 33(6): 418-424. |
| [17] |
王珊珊, 董莹, 邓艳, 等. 中缅边境恶性疟原虫pfmdr1基因多态性及pfmsp1等位基因分型研究[J]. 国际医学寄生虫病杂志, 2012, 39(2): 85-88. |
| [18] |
Lekana-Douki JB, Dinzouna Boutamba SD, Zatra R, et al. Increased prevalence of the Plasmodium falciparum pfmdr1 86N genotype among field isolates from Franceville, Gabon after replacement of chloroquine by artemether-lumefantrine and artesunate-mefloquine[J]. Infect Genet Evol, 2011, 11(2): 512-517. DOI:10.1016/j.meegid.2011.01.003 |
| [19] |
Mawili-Mboumba DP, Kun JF, Lell B, et al. Pfmdr1 alleles and response to ultralow-dose mefloquine treatment in Gabonese patients[J]. Antimicrob Agents Chemother, 2002, 46(1): 166-170. DOI:10.1128/AAC.46.1.166-170.2002 |
| [20] |
World Health Organization. Guidelines for the treatment of malaria[R]. Geneva: WHO, 2006.
|
| [21] |
Mawili-Mboumba DP, Ngomo JMN, Maboko F, et al. Pfcrt 76T and pfmdr1 86Y allele frequency in Plasmodium falciparum isolates and use of self-medication in a rural area of Gabon[J]. Trans R Soc Trop Med Hyg, 2014, 108(11): 729-734. DOI:10.1093/trstmh/tru147 |
| [22] |
Holmgren G, Hamrin J, Svärd J, et al. Selection of pfmdr1 mutations after amodiaquine monotherapy and amodiaquine plus artemisinin combination therapy in East Africa[J]. Infect Genet Evol, 2007, 7(5): 562-569. DOI:10.1016/j.meegid.2007.03.005 |
| [23] |
Lobo E, de Sousa B, Rosa S, et al. Prevalence of pfmdr1 alleles associated with artemether-lumefantrine tolerance/resistance in Maputo before and after the implementation of artemisinin-based combination therapy[J]. Malar J, 2014, 13: 300. DOI:10.1186/1475-2875-13-300 |
| [24] |
Thomas SM, Ndir O, Dieng T, et al. In vitro chloroquine susceptibility and PCR analysis of Pfcrt and pfmdr1 polymorphisms in Plasmodium falciparum isolates from Senegal[J]. Am J Trop Med Hyg, 2002, 66(5): 474-480. DOI:10.4269/ajtmh.2002.66.474 |
| [25] |
徐超, 魏庆宽, 李瑾, 等. 输入性恶性疟原虫耐药相关基因Pfcrt和pfmdr1单倍型及突变分析[J]. 中国人兽共患病学报, 2016, 32(12): 1051-1057. |
| [26] |
周瑞敏, 王轶南, 钱丹, 等. 2015年河南省输入性恶性疟原虫Pfcrt基因的多态性分析[J]. 中国寄生虫学与寄生虫病杂志, 2016, 34(5): 399-404. |
| [27] |
邓艳, 王珊珊, 董莹, 等. 中缅边境恶性疟原虫Pfcrt基因76位点突变研究[J]. 中国人兽共患病学报, 2014, 30(11): 1137-1140. |
 2018, Vol. 29
2018, Vol. 29


