扩展功能
文章信息
- 杨宇, 高艳菲, 曹旸, 王静, 邓华, 王建成, 陈雪松, 刘丽娟, 徐宝梁
- YANG Yu, GAO Yan-fei, CAO Yang, WANG Jing, DENG Hua, WANG Jian-cheng, CHEN Xue-song, LIU Li-juan, XU Bao-liang
- 内蒙古满洲里口岸地区2012-2014年蜱携带病原体调查
- Investigation on tick-borne pathogens in Inner Mongolia Manchuria port area during 2012-2014
- 中国媒介生物学及控制杂志, 2018, 29(2): 147-150, 156
- Chin J Vector Biol & Control, 2018, 29(2): 147-150, 156
- 10.11853/j.issn.1003.8280.2018.02.008
-
文章历史
- 收稿日期: 2017-10-28
- 网络出版时间: 2018-02-09 10:49
2 满洲里国际旅行卫生保健中心, 内蒙古 满洲里 021400
2 Manzhouli International Travel Health Care Center
蜱作为多种人兽共患病的传播媒介和贮存宿主,是仅次于蚊虫传播人类疾病的第二大医学媒介生物。目前,世界已发现蜱800余种,在中国已发现119种,其中硬蜱100种,软蜱10余种[1]。近30年来,国际上已报道多种新发蜱媒传染病,包括细菌、病毒和寄生虫引起的疾病等。目前,国内外共发现蜱媒传染病18种。我国主要分布有人巴贝西虫病、森林脑炎(TBE)、克里米亚-刚果出血热(CCHF)、北亚蜱媒斑点热、Q热、土拉热弗朗西丝菌病(土拉菌病)、莱姆病、蜱传回归热、人埃立克体病和蜱瘫[2]。2007年5月至2010年9月8日河南省先后发现疑似无形体病病例557例,死亡18例,2010年发热伴血小板减少综合征布尼亚病毒(SFTSV)被分离,再次使蜱传疾病成为公众关注的焦点[3]。
满洲里口岸位于中国-俄罗斯-蒙古(中俄蒙)三国交界,基于地缘及口岸优势,承担着中俄贸易70%以上的陆路运输任务,是中国最大的陆路口岸。以满洲里为节点,初步形成了“南连陆地、北接俄蒙”的陆路新经济走廊[4]。蜱传疾病在俄罗斯、蒙古等国常有流行。因此,在满洲里口岸对蜱传疾病进行监测对于保障我国居民健康和进出口动物制品的安全具有重要意义。为了解内蒙古满洲里口岸地区蜱携带病原体情况,于2012-2014年采集该地区的蜱进行病原体检测,现将结果报告如下。
1 材料与方法 1.1 试剂及仪器Taq DNA聚合酶、PCR缓冲液、dNTP mix和DL2000 DNA Marker均购自TaKaRa公司;病毒RNA提取试剂盒、基因组DNA提取试剂盒均购自QIAGEN公司;AMV酶反转录试剂盒购自Promega公司。
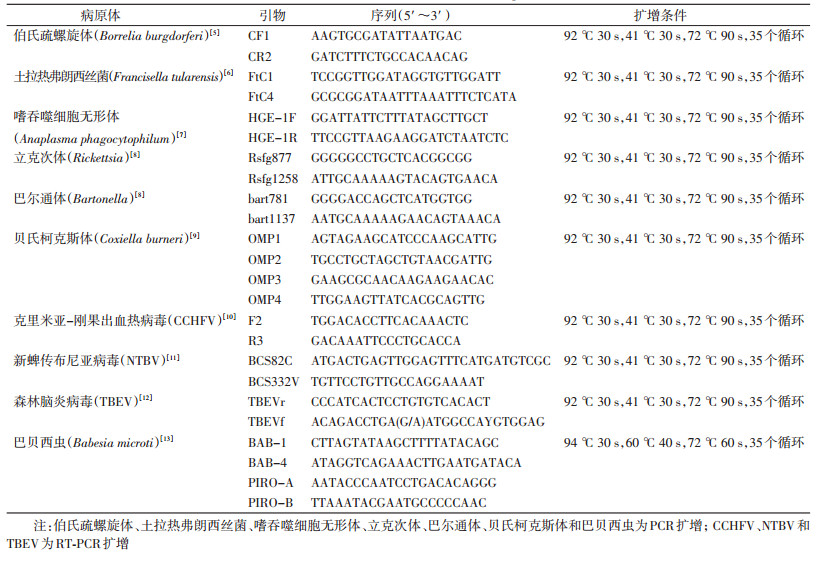
1.2 引物合成PCR所用引物均由生工生物工程(上海)有限公司合成,引物信息见表 1。
2012-2014年5-7月在满洲里口岸(117°21′14″E,49°20′24″N)及周边地区的玉镇山(121°15′7″E,48°51′3″N)、阿日哈沙特(115°30′10″E,48°20′24″N)采用人工小时布旗法和体表检视法采集蜱。采集草地和混交林地区的游离蜱,野生黄羊等动物体表采用体表寄生蜱检视法,样品于70%乙醇室温保存。参照《中国重要医学昆虫分类与鉴别》和《中国经济昆虫志.蜱螨亚纲.硬蜱科》对蜱进行分类鉴定。
1.4 基因组DNA与总RNA的提取无菌操作台上,每只蜱用75%乙醇浸泡20 min后,用pH 7.4 PBS溶液漂洗3次,分装2 ml的EP管中,加入500 μl PBS溶液,研磨后分别取200、140 μl的组织研磨液,按照试剂盒说明书提取基因组DNA和RNA。
1.5 PCR扩增检测以提取的DNA为模板,按照表 1列出的引物进行PCR扩增。扩增反应体系包括:Taq DNA聚合酶0.5 μl,10×PCR Buffer 5 μl,dNTPs mixture 4 μl,10 μmol/L的正、反向引物各1 μl,模板DNA 2 μl,补充ddH2O使总体积达50 μl。94 ℃预变性5 min,然后按照表 1扩增条件进行PCR循环,最后72 ℃延伸10 min。贝氏柯克斯体第2次PCR反应体系与第1次相同,模板为3.0 μl的第1次PCR产物。
1.6 RT-PCR扩增以提取的RNA为模板进行反转录,8 μl模板RNA和2 μl随机引物95 ℃孵育2 min,冰浴10 min,加入15 μl反转录缓冲液(含200 μmol/L dNTPs、20 U RNAsin、10 U AMV反转录酶)42 ℃孵育1.5 h,72 ℃ 10 min。取2 μl反转录产物PCR扩增,用于检测森林脑炎病毒(TBEV)、克里米亚-刚果出血热病毒(CCHFV)和新蜱传布尼亚病毒(NTBV),按照表 1列出的引物和扩增条件进行PCR扩增,反应体系同1.5。
1.7 统计学处理利用SPSS 19.0软件处理数据,采用χ2检验或Fisher确切概率法对样本的构成比及病原体的检出率进行统计学分析。P<0.05为差异有统计学意义。
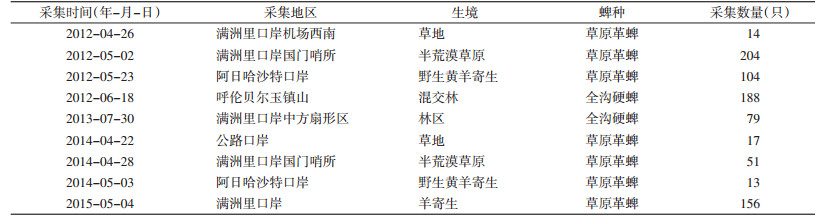
2 结果 2.1 蜱采集情况2012-2014年共采集蜱826只,经鉴定为全沟硬蜱(Ixodes persulcatus)和草原革蜱(Dermacentor nuttalli),见表 2。
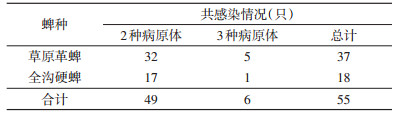
利用10对引物分别对随机挑选的263只草原革蜱、125只全沟硬蜱进行病原体检测,发现携带TBEV的蜱9只、CCHFV 41只、NTBV 2只、伯氏疏螺旋体20只、立克次体77只、巴尔通体2只、嗜吞噬细胞无形体66只、贝氏柯克斯体6只,土拉菌和巴贝西虫检测结果为阴性。155只阳性蜱中,同时感染2种病原体的蜱49只,感染3种病原体的蜱6只,见表 3。
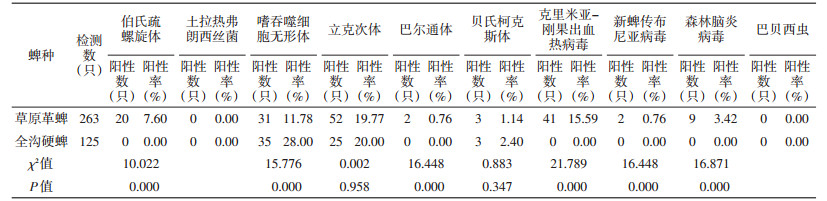
由表 4可见,草原革蜱中以立克次体检出率最高,为19.77%,土拉菌和巴贝西虫未检出;全沟硬蜱中嗜吞噬细胞无形体、立克次体和贝氏柯克斯体的检出率分别为28.00%、20.00%和2.40%,其他病原体均未检出。伯氏疏螺旋体、嗜吞噬细胞无形体、巴尔通体、CCHFV、NTBV和TBEV在2种蜱中的检出率差异有统计学意义(均P=0.000);立克次体和贝氏柯克斯体的检出率差异无统计学意义(P>0.05)(表 4)。
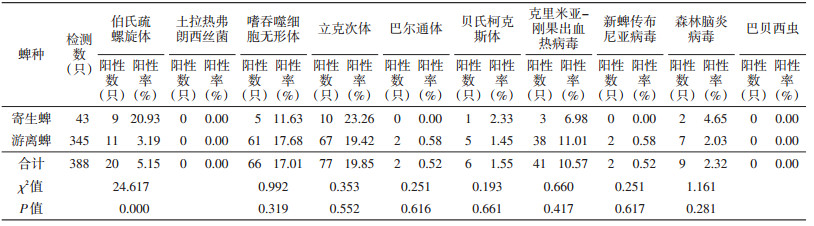
共捕获寄生蜱43只,游离蜱345只,2种生境蜱的总检出率为5.15%(20/388)。野生黄羊体表寄生蜱携带的病原体检出率以立克次体最高,为23.26%,未检出土拉菌、巴尔通体、NTBV和巴贝西虫;野外游离蜱携带的病原体检出率亦以立克次体最高,为19.42%,未检出土拉菌和巴贝西虫,见表 5。伯氏疏螺旋体在2种生境蜱的检出率差异有统计学意义(χ2=24.617,P=0.000);嗜吞噬细胞无形体、立克次体、巴尔通体、贝氏柯克斯体、CCHFV、NTBV和TBEV在2种生境蜱的检出率差异均无统计学意义(P>0.05)。
|
本调查显示,草原革蜱和全沟硬蜱为满洲里口岸及周边地区的优势种,分布广泛且存在明显的环境分布优势。草原及野生黄羊体表的寄生蜱均为草原革蜱,为典型草原种,可自然感染西伯利亚立克次体(R. sibirica)、布鲁氏菌(Brucella)和伯氏疏螺旋体,在我国境内主要分布于河北、内蒙古、辽宁、吉林、黑龙江、陕西、甘肃、青海、宁夏、新疆等省(自治区)。在满洲里口岸周边林区采集的蜱均为全沟硬蜱,为东北林区优势种[14],是TBE和莱姆病的主要传播媒介,在我国境内主要分布于北京、河北、山西、辽宁、吉林、黑龙江、内蒙古、江西、西藏、甘肃、宁夏、新疆等省(直辖市、自治区)。2种蜱在日本、朝鲜、东欧和俄罗斯等国也有分布[15]。
立克次体和嗜吞噬细胞无形体在草原革蜱和全沟硬蜱中具有普遍感染性,立克次体在本次调查的10种病原体中检出率最高,达19.85%。立克次体在蜱体内可长期生长繁殖,并广泛分布全身多组织,同时可经卵垂直传递至下一代,起到传播媒介和储存宿主的双重作用[16]。嗜吞噬细胞无形体的检出率仅次于立克次体,为17.01%,其可通过叮咬传播病原体,在蜱的体内持续存在并繁衍,携带病毒的蜱具有感染新宿主的能力[17-20]。同时,伯氏疏螺旋体、巴尔通体、CCHFV、TBEV和NTBV仅在草原革蜱中发现,而嗜吞噬细胞无形体、立克次体、贝氏柯克斯体3种病原体在2种蜱中均有检出,说明不同蜱携带病原体的种类有所区别。对游离蜱和寄生蜱携带的病原体检测发现,伯氏疏螺旋体在寄生蜱中的检出率明显高于游离蜱,其他7种病原体的感染率差异无统计学意义,提示本次监测的野生黄羊群体可能为莱姆病自然感染,需继续加强野生动物种群该疾病的监测力度,并应加强相应地区饲养动物莱姆病的监测,预防人群感染[21]。同时,本研究发现,病原体的复合感染在蜱传疾病中比较常见,为传染病的诊断和治疗带来诸多困难,但同一只蜱可携带多种病原体而导致蜱传疾病在人群的共感染成因尚不明确[22]。蜱传病原体复合感染相关报道和研究将有助于更加深入地了解蜱传疾病病原体复合感染的流行病学特点和传播规律。
综上所述,满洲里口岸紧邻的东北地区及周边俄蒙口岸是重要的蜱媒传染病的自然疫源地。以往调查显示,媒介蜱和宿主动物携带多种蜱媒病原体,包括嗜吞噬细胞无形体、立克次体、伯氏疏螺旋体、巴贝西虫和TBEV等[16],与本次调查结果相吻合。因此,应持续开展满洲里口岸及周边地区媒介蜱的检测及携带病原体的监测工作,在人群中开展血清学调查,掌握该地区蜱传疾病的流行情况,为蜱传疾病的防控提供依据。
| [1] |
杨晓军, 陈泽, 刘敬泽. 蜱类系统学研究进展[J]. 昆虫学报, 2007, 50(9): 941-949. |
| [2] |
代旭磊, 宝福凯, 柳爱华. 新发蜱媒传染病的国内外研究概况[J]. 寄生虫与医学昆虫学报, 2013, 20(3): 202-209. |
| [3] |
Yu XJ, Liang MF, Zhang SY, et al. Fever with thrombocytopenia associated with a novel bunyavirusin China[J]. N Engl J Med, 2011, 364(16): 1523-1532. DOI:10.1056/NEJMoa1010095 |
| [4] |
内蒙古自治区党委宣传部. 畅通草原"新丝路"筑牢"一带一路"桥头堡[J]. 实践:思想理论版, 2016(6): 38-39. |
| [5] |
Shih CM, Chao LL. Genetic analysis of the outer surface protein C gene of Lyme disease spirochaetes(Borrelia burgdorferisensu lato) isolated from rodents in Taiwan[J]. J Med Microbiol, 2002, 51(4): 318-325. DOI:10.1099/0022-1317-51-4-318 |
| [6] |
Johansson A, Ibrahim A, Göransson I, et al. Evaluation of PCR-based methods for discrimination of Francisella species and subspecies and development of a specific PCR that distinguishes the two major subspecies of Francisella tularensis[J]. J Clin Microbiol, 2000, 38(11): 4180-4185. |
| [7] |
Chu FK. Rapid and sensitive PCR-based detection and differentiation of aetiologic agents of human granulocytotropic and monocytotropic ehrlichiosis[J]. Mol Cell Probes, 1998, 12(2): 93-99. DOI:10.1006/mcpr.1998.0150 |
| [8] |
Regnery RL, Spruill CL, Plikaytis BD. Genotypic identification of rickettsiae and estimation of intraspecies sequence divergence for portions of two rickettsial genes[J]. J Bacteriol, 1991, 173(5): 1576-1589. DOI:10.1128/jb.173.5.1576-1589.1991 |
| [9] |
Lee JH, Park HS, Jong WJ, et al. Identification of the Coxiella sp. detected from Haemaphysalis longicornis ticks in Korea[J]. Microbiol Immunol, 2004, 48(2): 125-130. DOI:10.1111/mim.2004.48.issue-2 |
| [10] |
Drosten C, Kümmerer BM, Schmitz H, et al. Molecular diagnostics of viral hemorrhagic fevers[J]. Antiviral Res, 2003, 57(1/2): 61-87. |
| [11] |
Kuno G, Mitchell CJ, Chang GJ, et al. Detecting bunyaviruses of the Bunyamwera and California serogroups by a PCR technique[J]. J Clin Microbiol, 1996, 34(5): 1184-1188. |
| [12] |
Alekseev AN, Dubinina HV. Multiple infections of tick-borne pathogens in Ixodes spp. (Acarina, Ixodidae)[J]. Acta Zool Lituan, 2003, 13(3): 311-321. DOI:10.1080/13921657.2003.10512687 |
| [13] |
孙毅, 刘国平, 杨丽炜, 等. 黑龙江省部分林区全沟硬蜱复合感染重要蜱媒病原的调查研究[J]. 寄生虫与医学昆虫学报, 2007, 14(4): 231-240. |
| [14] |
李颖. 我国东北森林景区媒介蜱感染与传播无形体的研究[D]. 苏州: 苏州大学, 2012.
|
| [15] |
张际文. 中国国境口岸医学媒介生物鉴定图谱[M]. 天津: 天津科学技术出版社, 2015, 450, 465.
|
| [16] |
马兰. 人感染新斑点热群立克次体的发现及自然疫源地调查研究[D]. 北京: 中国人民解放军军事医学科学院, 2015.
|
| [17] |
马米玲, 李海建, 庆保平. 我国蜱媒传播的人兽共患病[J]. 青海畜牧兽医杂志, 2012, 42(1): 41-42. |
| [18] |
孙明, 曾巧英, 殷宏, 等. 实验室条件下小亚璃眼蜱生活史观察[J]. 中国媒介生物学及控制杂志, 2011, 22(4): 344-347. |
| [19] |
Chen Z, Yang XJ, Bu FJ, et al. Ticks(Acari:Ixodoidea:Argasidae, Ixodidae)of China[J]. Exp Appl Acarol, 2010, 51(4): 393-394. DOI:10.1007/s10493-010-9335-2 |
| [20] |
马广鹏, 孙传范, 赵娜, 等. 中国蜱传病主要流行趋势及防控科技对策[J]. 中国农业科技导报, 2011, 13(2): 105-109. |
| [21] |
孙响, 张桂林, 郑重, 等. 新疆北部林区工作人员蜱传疾病的血清学调查研究[J]. 寄生虫与医学昆虫学报, 2016, 23(3): 158-163. |
| [22] |
Swanson SJ, Neitzel D, Reed KD, et al. Coinfections acquired from Ixodes ticks[J]. Clin Microbiol Rev, 2006, 19(4): 708-727. DOI:10.1128/CMR.00011-06 |
 2018, Vol. 29
2018, Vol. 29