扩展功能
文章信息
- 刘倩倩, 吴炳耀, 何江, 胡双双, 杨庆贵, 孙立新
- LIU Qian-qian, WU Bing-yao, HE Jiang, HU Shuang-shuang, YANG Qing-gui, SUN Li-xin
- 江苏口岸常见蚊虫沃尔巴克氏体感染调查研究
- Investigation on Wolbachia infection of mosquitoes in Jiangsu ports
- 中国媒介生物学及控制杂志, 2018, 29(2): 138-142
- Chin J Vector Biol & Control, 2018, 29(2): 138-142
- 10.11853/j.issn.1003.8280.2018.02.006
-
文章历史
- 收稿日期: 2017-11-27
- 网络出版时间: 2017-12-09 10:46
2 江苏先声医学诊断有限公司, 南京 210000;
3 江苏国际旅行卫生保健中心, 南京 210001
2 Jiangsu Xiansheng Medical Diagnosis Co., Ltd;
3 Jiangsu International Travel Health Center
蚊虫作为重要的媒介生物,可传播流行性乙型脑炎(乙脑)、疟疾、登革热、黄热病、寨卡病毒病等虫媒传染病,是控制的重点对象。随着生物防治蚊虫技术的发展,基于昆虫共生菌沃尔巴克氏体(Wolbachia)的蚊媒和蚊媒传染病控制逐渐成为研究及应用的热点[1-2]。Wolbachia属于α变性菌,是可以通过雌性昆虫进行传播的一种革兰阴性菌。因Wolbachia可以通过诱导宿主间杂交的胞质不相容[3],诱导单性生殖[4]、雌性化[5]和杀雄性[6]等机制改变和影响其宿主的繁殖,且部分感染Wolbachia的蚊虫表现出对登革热病毒、基孔肯雅病毒、黄热病毒甚至疟原虫的抗性[7-8],因此人们利用其进行生物控制[1, 9]。研究者发现,Wolbachia广泛分布于昆虫和蜱、螨、蜘蛛、蝎及线虫等节肢动物[10]。已有多个基因序列被应用于该微生物的系统发育中,其中1种编码Wolbachia主要表面蛋白的基因—wsp基因,是目前被认为进化最快的,并建立了依据其基因序列对Wolbachia株进行PCR分类检测的方法和进行系统发育分析[11-12]。
江苏省位于亚热带与温带的过渡地区,仍面临各种虫媒传染病的持续性威胁。调查了解江苏口岸蚊虫Wolbachia的感染情况,为将来利用Wolbachia的胞质不相容性及对虫媒病毒的抗性来控制蚊虫的繁殖和疾病的传播奠定基础。
1 材料与方法 1.1 样品采集2015年6-9月在江苏省苏州、常州、无锡、南京、南通、扬州、泰州、连云港、徐州和淮安10个口岸地区,采用诱蚊灯法和二氧化碳诱捕法捕获蚊虫,每个地区每个蚊种尽可能选取32只进行后续研究,<32只则选取全部样本参与检测。
1.2 试剂DNeasy Blood and Tissue Kit DNA提取试剂(QIAGEN,德国),OMEGA Cycle-Pure Kit(200)纯化试剂盒,OMEGA Mag-Bind SEDTR Kit试剂盒,Applied Biosystems Hi-Di Formamide,DL 1 000 Marker、10×PCR Buffer(无Mg2+)、MgCl2(25 mmol/L)、dNTP Mixture(各2.5 mmol/L)、Taq DNA聚合酶(5 U/μl)(TaKaRa)。
1.3 方法 1.3.1 提取DNA将上述采集到的各种蚊虫标本进行编号,每只按照DNeasy Blood & Tissue Kit(QIAGEN,德国)说明书单独提取DNA。
1.3.2 PCR依据Wolbachia wsp基因序列的特异性引物[13],正向引物为81F:5′-TGG TCC AAT AAG TGA TGA AGA AAC,反向引物为691R:5′-AAA AAT TAA ACG CTA CTC CA,该引物为Wolbachia的通用引物,其PCR产物为590~632 bp。在35 μl的体系中,10×Buffer 3.5 μl,正、反向引物各1.5 μl,dNTP 3 μl,MgCl2溶液3 μl,模板3 μl,Taq DNA聚合酶0.4 μl(5 U/μl),灭菌去离子水补足至35 μl。扩增条件:94 ℃预变性5 min;94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1 min,共35个循环;72 ℃终延伸10 min。
1.3.3 产物纯化PCR产物用毛细管电泳仪分析,利用OMEGA Cycle-Pure Kit(200)纯化试剂盒,选择目的条带清晰的扩增产物进行纯化。
1.3.4 测序反应在10 μl的测序反应体系中,Big Die 0.5 μl,5×Buffer 1.75 μl,单向引物0.5 μl,灭菌去离子水6.25 μl,再加入DNA模板1 μl。反应条件:96 ℃预变性1 min;96 ℃变性10 s,50 ℃退火5 s,60 ℃延伸4 min,共25个循环;4 ℃终延伸7 min。测序反应后,根据OMEGA Mag-Bind SE DTR Kit试剂盒说明书进行测序反应后纯化。将纯化后产物溶于Applied Biosystems Hi-Di Formamide试剂,测序。
1.3.5 序列分析首先在Chromos软件中观察测序峰图,评价测序质量。通过Lasergene 7.0软件的Seqman模块进行双向序列自动拼接与适当的手工调整。然后将测定的序列在美国国立生物技术信息中心(NCBI)上通过BLAST程序进行序列同源性比较,以确保所获得的序列是目标序列。将所有序列在MEGA 6.0软件的Clustal W模块中对齐,通过DnaSP 5.10软件分析比较序列间的多态性信息,基于赤池信息标准(Akaike information criterion,AIC),通过Modeltest v2.1.7软件筛选最佳进化模型,在MEGA 6.0软件中采用最大似然法(Maximum-Likelihood,ML)构建wsp基因的ML系统树,各分支的置信度由1 000次自举法(Bootstrap)重复检测。
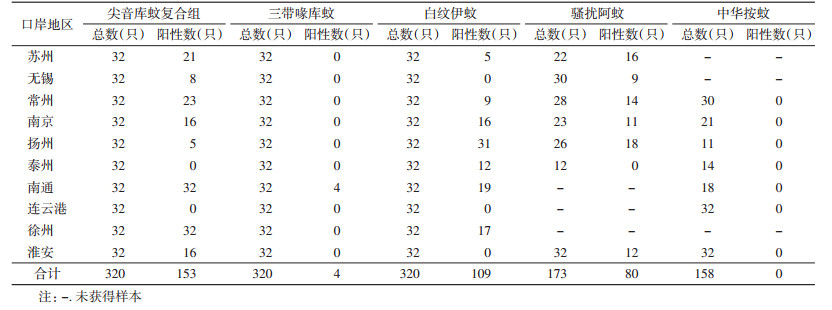
2 结果 2.1 蚊虫采集情况2015年6-9月共采集5种蚊虫,分别为尖音库蚊复合组(Culex pipiens complex)、三带喙库蚊(Cx. tritaeniorhynchus)、白纹伊蚊(Aedes albopictus)、骚扰阿蚊(Armigeres subalbatus)和中华按蚊(Anopheles sinensis)。其中尖音库蚊复合组蚊虫、三带喙库蚊和白纹伊蚊在10个口岸均有分布且数量较多,而骚扰阿蚊和中华按蚊捕获数量较少,南通、连云港和徐州口岸未捕获骚扰阿蚊,无锡、苏州和徐州口岸未捕获中华按蚊(表 1)。
|
分别从采集的蚊虫标本中扩增出Wolbachia wsp基因序列,琼脂糖凝胶电泳显示,PCR产物片段大小约600 bp,与目的片段大小一致(图 1)。通过对蚊虫中Wolbachia wsp基因的筛查,即可获得各口岸地区每种蚊虫Wolbachia感染情况。江苏口岸蚊虫总感染率为26.80%(346/1 291),以尖音库蚊复合组蚊虫的感染率(47.81%)最高,其次为骚扰阿蚊(46.24%)、白纹伊蚊(34.06%)和三带喙库蚊(1.25%),各口岸中华按蚊均未感染。

|
| 注:M. DNA分子质量标准;-.阴性对照;1~4.尖音库蚊复合组、白纹伊蚊、骚扰阿蚊和三带喙库蚊样本 图 1 江苏各口岸常见蚊虫Wolbachia wsp基因扩增产物的电泳结果 Figure 1 Electrophoretic results of Wolbachia wsp gene amplification products of common mosquitoes in Jiangsu port |
| |
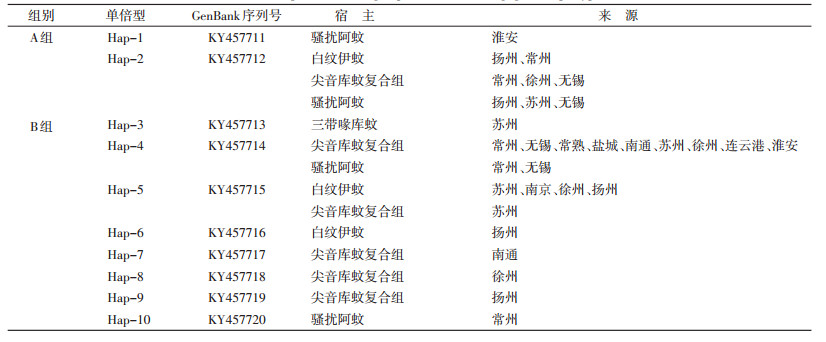
对所有阳性片段进行双向测序,拼接后获得346条wsp基因,经BLAST与GenBank中相关序列进行同源性分析,各序列与Wolbachia wsp基因的相似性均>99%。江苏不同口岸蚊虫Wolbachia wsp基因共享10个单倍型,见表 2。单倍型间的遗传距离在0.002~0.263之间,Hap-1与Hap-2间同源性最低,Hap-2与Hap-6间同源性最高。从单倍型的来源发现,Hap-1与Hap-10为淮安和常州口岸骚扰阿蚊携带Wolbachia所独有的单倍型,Hap-7、Hap-8和Hap-9为南通、徐州和扬州口岸尖音库蚊复合组蚊虫携带Wolbachia所独有的单倍型。Hap-6仅在扬州口岸白纹伊纹携带的Wolbachia中发现,Hap-3仅在苏州口岸三带喙库蚊携带的Wolbachia中出现。Hap-2、Hap-4和Hap-5在江苏不同口岸蚊虫中出现的频率较高。
|
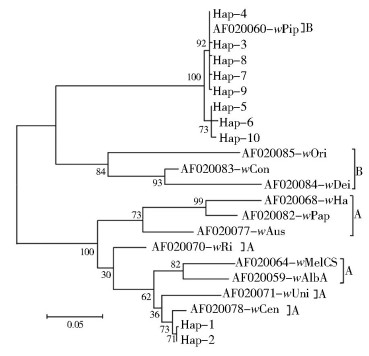
通过GenBank下载获得12种Wolbachia的wsp基因,将这些基因与江苏不同口岸常见蚊虫的10个单倍型进行系统发育分析显示,10个单倍型分别被划分在2个超级组别的2个进化分支中。Hap-3~Hap-10与AF020060的wPip聚在同一分支,归属于B大组,其中Hap-3、Hap-4、Hap-7、Hap-8、Hap-9与Hap-5、Hap-6、Hap-10进一步分化成2个小的分支;而Hap-1和Hap-2与AF020078的wCen聚在同一分支,归属于A大组,见图 2。
|
| 图 2 江苏各口岸常见蚊虫Wolbachia wsp基因间的 系统发育关系 Figure 2 Phylogenetic relationships among Wolbachia wsp genes in common mosquitoes in Jiangsu port |
| |
Wolbachia属于变形菌门的α亚群,节肢动物体内共生的Wolbachia分为A和B两大组以及大组下的组[11-12]。我国蚊虫体内普遍存在Wolbachia感染[14],其中28.10%的蚊种(包括29.60%伊蚊、42.10%库蚊和50.00%曼蚊)携带Wolbachia[6-7],但对于特定地区每种蚊虫感染率的调查较少。本研究调查了江苏不同口岸的5种常见蚊虫,其蚊虫总感染率为26.80%。
Zhou等[12]利用Wolbachia外壳蛋白基因进行了系统进化研究,研究表明Wolbachia pipientis簇可以划分成12个小组,其中8个组成A大组,4个组成B大组。本研究共获得10种wsp基因单倍型,共划分成3个小组,其中1个小组来自A大组,2个小组来自B大组。其中Hap-3~Hap-10聚类于wPip小组;而Hap-1和Hap-2聚在wCen小组,这些序列的变异均未超出目前公布的序列范围,可见江苏不同口岸常见蚊虫主要分布2种Wolbachia。通过对所有wsp基因片段测序分析,共获得10个单倍型,其中3个单倍型(Hap-7、Hap-8和Hap-9)由尖音库蚊复合组蚊虫独有,Hap-6单倍型由白纹伊蚊独有,Hap-3由三带喙库蚊独有[15]。蚊种内分布多样,具有很多特定的单倍型,Hap-1仅存在于淮安口岸的骚扰阿蚊,Hap-3仅存在于苏州口岸的三带喙库蚊,Hap-6仅存在于扬州口岸的白纹伊蚊,Hap-7仅存在于南通口岸的尖音库蚊复合组,Hap-8仅存在于徐州地区的尖音库蚊复合组,Hap-9仅存在于扬州口岸的尖音库蚊复合组,Hap-10仅存在于常州口岸的骚扰阿蚊。同种蚊虫也存在多种Wolbachia感染,如尖音库蚊复合组具有6种单倍型(Hap-2、Hap-4、Hap-5、Hap-7、Hap-8和Hap-9),来自3种不同组的Wolbachia。而Hap-2、Hap-4和Hap-5在江苏各口岸不同蚊种间共享,Hap-2在尖音库蚊复合组蚊虫、白纹伊蚊和骚扰阿蚊3种蚊虫间共享,Hap-4在尖音库蚊复合组蚊虫和骚扰阿蚊2种蚊虫间共享,而Hap-5在尖音库蚊复合组蚊虫和白纹伊蚊2种蚊虫间共享[16]。可见蚊种间存在同一类型的Wolbachia,暗示Wolbachia可能存在蚊虫间传播机制。Wolbachia是一群细胞内寄生的细菌,不同的生殖表型与细胞质不相容、单性生殖和雄性雌性化等有关。
江苏省地处长江中下游流域,是我国尖音库蚊复合组中淡色库蚊与致倦库蚊的重要杂交带,2种蚊虫很难杂交产生后代,故2种蚊虫的分类一直存在争议[17]。本次调查发现,尖音库蚊复合组Wolbachia的感染情况最为复杂,存在6种单倍型(Hap-2、Hap-4、Hap-5、Hap-7、Hap-8和Hap-9),可能尖音库蚊复合组携带的Wolbachia诱导宿主间杂交的胞质不相容干扰了杂交结果,进而影响其分类研究。
蚊虫防制是阻断蚊媒病传播的重要环节,长期使用杀虫剂可能会导致蚊虫对其产生抗性。由于Wolbachia可以影响宿主的生殖表型,基于共生菌Wolbachia的生物控制策略具有持效性控制效果,无需担心抗药性问题及对环境的污染。但该技术的应用具有蚊种特异性,对于干预地点存在多种媒介蚊类种群均可传播虫媒传染病的情况,需要对每种虫媒单独设计和应用控制方法。掌握目标区域各蚊种的Wolbachia感染情况是生物防治的基础。通过调查基本掌握了江苏不同口岸蚊虫Wolbachia的感染情况,实现了对特定地区蚊虫Wolbachia感染的总体调查,为将来基于Wolbachia特性的蚊媒及蚊媒病控制奠定了基础,对进行生物防控策略具有重要意义。
| [1] |
Werren JH. Biology of Wolbachia[J]. Annu Rev Entomol, 1997, 42: 587-609. DOI:10.1146/annurev.ento.42.1.587 |
| [2] |
Bourtzis K, Dobson SL, Xi ZY, et al. Harnessing mosquito-Wolbachia symbiosis for vector and disease control[J]. Acta Trop, 2014, 132(Suppl): S150-163. |
| [3] |
赵彤言, 陆宝麟. 中国尖音库蚊复合组生物分类学的研究:雄蚊阳茎DV/D的数值分析[J]. 昆虫学报, 1994, 37(4): 446-449. |
| [4] |
张金光, 霍新北. 淡色库蚊的抗性机制研究进展及控制策略[J]. 预防医学论坛, 2011, 17(4): 355-356, 358. |
| [5] |
刘维德. 蚊类抗药性及其测定[M]. 北京: 科学出版社, 1979, 53-63.
|
| [6] |
中华人民共和国卫生部. GB/T 26347-2010蚊虫抗药性检测方法生物测定法[S]. 北京: 中国标准出版社, 2011.
|
| [7] |
Iturbe-Ormaetxe I, Walker T, O'Neill SL. Wolbachia and the biological control of mosquito-borne disease[J]. EMBO Rep, 2011, 12(6): 508-518. DOI:10.1038/embor.2011.84 |
| [8] |
van den Hurk AF, Hall-Mendelins, Pyke AT, et al. Impact of Wolbachia on infection with Chikungunya and yellow fever viruses in the mosquito vector Aedes aegypti[J]. PLoS Negl Trop Dis, 2012, 6(11): e1892. DOI:10.1371/journal.pntd.0001892 |
| [9] |
Werren JH, Windsor DW, Guo LR, et al. Distribution of Wolbachia among neotropical arthropods[J]. Proc Roy Soc B Biol Sci, 1995, 262(1364): 197-204. DOI:10.1098/rspb.1995.0196 |
| [10] |
潘晓玲, 刘起勇, 奚志勇. 基于昆虫共生菌沃尔巴克氏体的蚊媒和蚊媒病控制研究进展[J]. 中国媒介生物学及控制杂志, 2014, 25(1): 1-7. DOI:10.11853/j.issn.1003.4692.2014.01.001 |
| [11] |
Braig HR, Zhou WG, Dobson SL, et al. Cloning and characterization of a gene encoding the major surface protein of the bacterial endosymbiont Wolbachia pipientis[J]. J Bacteriol, 1998, 180(9): 2373-2378. |
| [12] |
Zhou WG, Rousset F, O'Neill S, et al. Phylogeny and PCR-based classification of Wolbachia strains using wsp gene sequences[J]. Proc Roy Soc B Biol Sci, 1998, 265(1395): 509-515. DOI:10.1098/rspb.1998.0324 |
| [13] |
宋社吾, 赵彤言, 董言德, 等. 我国蚊虫体内感染的Wolbachia的wsp基因序列测定与分析[J]. 昆虫学报, 2002, 45(5): 571-577. |
| [14] |
宋社吾, 赵彤言, 董言德, 等. 我国蚊虫中昆虫共生微生物Wolbachia感染的研究[J]. 中国媒介生物学及控制杂志, 2002, 13(1): 19-21. |
| [15] |
Kittayapong P, Baisley KJ, Baimai V, et al. Distribution and diversity of Wolbachia infections in Southeast Asian mosquitoes (Diptera:Culicidae)[J]. J Med Entomol, 2000, 37(3): 340-345. DOI:10.1093/jmedent/37.3.340 |
| [16] |
Ricci I, Cancrini G, Gabrielli S, et al. Searching for Wolbachia (Rickettsiales:Rickettsiaceae) in mosquitoes (Diptera:Culicidae):large polymerase chain reaction survey and new identifications[J]. J Med Entomol, 2002, 39(4): 562-567. DOI:10.1603/0022-2585-39.4.562 |
| [17] |
赵彤言, 董言德, 朱礼华, 等. 骚扰库蚊与尖音库蚊复合组其它亚种杂交的研究[J]. 寄生虫与医学昆虫学报, 1998, 5(1): 41-44. |
 2018, Vol. 29
2018, Vol. 29


