扩展功能
文章信息
- 刘蓬勃, 孙琬琬, 王君, 刘起勇, 宋秀平, 郭玉红, 鲁亮
- LIU Peng-bo, SUN Wan-wan, WANG Jun, LIU Qi-yong, SONG Xiu-ping, GUO Yu-hong, LU Liang
- 滇西南地区埃及伊蚊种群微卫星标记筛选研究
- Isolation of microsatellite markers in Aedes aegypti population from southwest Yunnan
- 中国媒介生物学及控制杂志, 2018, 29(2): 130-133
- Chin J Vector Biol & Control, 2018, 29(2): 130-133
- 10.11853/j.issn.1003.8280.2018.02.004
-
文章历史
- 收稿日期: 2018-01-05
- 网络出版时间: 2018-02-09 10:47
埃及伊蚊(Aedes aegypti)属双翅目(Diptera)蚊科(Culicidae)伊蚊属(Aedes)覆蚊亚属(Stegomyia)A组,起源于非洲,主要分布于热带和亚热带地区[1],在15-17世纪通过贸易和航运入侵到其他洲。货船甲板上的盛水容器为埃及伊蚊的繁殖提供了条件,使其在19世纪扩增到东南亚国家[2-3]。埃及伊蚊是登革热传播的主要媒介之一,同时也是城市型黄热病、基孔肯雅热和裂谷热的传播媒介,每年超过100个国家25亿人处于这些传染病暴发风险中[4]。近年来,登革热发病率呈明显上升趋势,人们对埃及伊蚊的关注更加密切。
我国埃及伊蚊原主要分布于22° N以南地区。云南省位于我国西南边陲,国境线长,口岸较多,与缅甸、老挝、越南等登革热高发的东南亚国家接壤,受孟加拉高压气流影响形成的高原季风气候,具有典型的热带和亚热带气候特征,适合蚊虫的大量孳生繁衍[5]。自2002年首次在瑞丽市姐告口岸捕获埃及伊蚊幼虫以来,相继在芒市、勐腊、勐海、景洪、盈江、陇川和耿马等县(市)发现埃及伊蚊,说明其在云南省的入侵和扩散日益严峻。2008年以前云南省无登革热本地病例,之后登革热病例数增加,分布范围扩大,尤其是2013-2014年在西双版纳傣族自治州景洪市、勐腊县和德宏傣族景颇族自治州(德宏州)瑞丽市暴发的4起因输入性病例引起的本地感染登革热疫情,共报告病例1 849例,其中本地病例1 579例。从近年来登革热暴发的流行情况看,在疫情区域监测到较高密度的埃及伊蚊且分布区与本地登革热流行区一致,在流行特征上具有家庭聚集性特点,说明近年来埃及伊蚊已成为云南省登革热流行的主要媒介,医学重要性尤其显著[1]。
现代分子生物学技术在种群生态学研究中提供了许多客观性较好的中性遗传标记,微卫星序列位于核基因的非编码区,呈现双亲遗传,与线粒体基因比较,其可提供更丰富的遗传信息,且微卫星标记具有高度多态性,在群体中变异范围大、杂合度高、分布广、重组率低[6-7]。自2001年其首次分离自埃及伊蚊体内后,已被广泛应用于埃及伊蚊的种群遗传研究。通过对埃及伊蚊微卫星信息进行研究,可以了解其种群结构、基因流模式及入侵新区域的定居和扩展过程,有助于控制虫媒传染病的传播[8-9]。前期研究利用文献报道的用于研究其他地区埃及伊蚊种群结构的9对引物(包括特立尼达的BbH08、BbA10[10],越南的38/38、34/72、C2A8、T3A7、AED19[11],泰国的AG5、AC1[12]),对滇西南地区埃及伊蚊种群遗传结构进行分析发现,上述9个位点的引物仅AG5位点可扩增出合格的核酸序列,其他位点的引物因不能扩增出目标条带或扩增的条带不具有多态性而无法作为微卫星标记用于研究该地区埃及伊蚊的种群结构。故本研究旨在筛选可以体现滇西南地区埃及伊蚊种群遗传结构的微卫星标记引物。
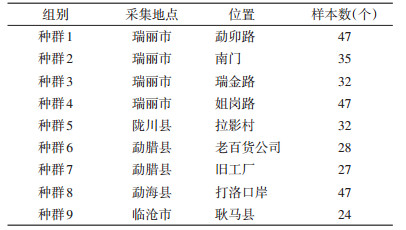
1 材料与方法 1.1 样本来源2016年9月采集自云南省勐海县打洛口岸、勐腊县、德宏州瑞丽市、陇川县拉影村和临沧市耿马县,9个种群共319个样本,见表 1。
利用磁珠法对采集到的埃及伊蚊成蚊及幼虫进行DNA提取,利用分光光度计测定其浓度和纯度,置4 ℃保存。
1.2.2 微卫星序列的获取从美国国立生物技术信息中心GenBank下载埃及伊蚊全基因组序列,共17条(NW_001811573、NW_001811474、NW_001811585、NW_001811640、NW_001811662、NW_001811282、NW_001811446、NW_001811505、NW_001811564、NW_001811703、NW_001811438、NW_001811473、NW_001811525、NW_001811558、NW_001809819、NW_001837458和NW_001837337)。选取1段目标序列如(AC)10,利用Tandem Repeats Finder软件查找全基因组中的微卫星序列,设置参数:Alignmengt Parameters﹝match,mismatch,indel﹞=2,7,7;Mininum Alignment Score To Report Repeat=40;Maxinum Period Size=4;选择重复单位为2~4 bp且重复数<30的微卫星序列保存,以3个碱基的重复序列为主。选取400~600 bp的微卫星侧翼序列进行BLAST比对,舍弃非单拷贝的微卫星位点。
1.2.3 引物的设计和筛选将微卫星序列转换为FASTA格式后用引物在线设计软件Batch Primer 3(http://batchprimer3.bioinformatics.ucdavis.edu/)设计引物,扩增产物长度设定在100~400 bp之间。将得到的引物进行BLAST比对,选取在基因组中单拷贝的引物序列送至北京天一辉远生物科技有限公司合成。初步摸索引物的PCR扩增条件,确定最合适退火温度(Tm),选取不同地区最大样本量[13]的埃及伊蚊扩增相应微卫星片段,利用变性聚丙烯酰胺凝胶电泳检测多态性。将扩增产物具有多态性的引物进一步合成荧光引物,用于种群遗传学研究。
2 结果 2.1 微卫星序列和多态性引物结果从17个埃及伊蚊全基因组中获得80条微卫星序列,其中侧链为单拷贝的39条,设计引物为单拷贝的22条,可稳定扩增引物的17对,其中11对具有多态性,引物相关信息见表 2。经检测筛选,11对引物均可以扩增出稳定的预期目标条带,多态性较高,可用于遗传多样性、种群结构和基因流等研究。
由表 3可以看出,等位基因数(Na)最高的是瑞丽市勐卯路种群(种群1),为(5.727±0.675)个,最低的为勐腊县旧工厂(种群7)和老百货公司种群(种群6),分别为(3.727±0.574)和(3.727±0.648)个。9个种群的观察杂合度(Ho)平均值为(0.394±0.026),其中,陇川县拉影村种群(种群5)最高,勐腊县旧工厂种群(种群7)最低。期望杂合度(He)最高的是临沧市耿马县种群(种群9),为(0.587±0.051),最低的是勐腊县旧工厂种群(种群7),为(0.434±0.086),各种群的期望杂合度均大于观察杂合度。9个种群的香农信息指数(I)平均值为(0.975±0.049),其中最高的是临沧市耿马县种群(种群9),最低的是勐腊县老百货公司种群(种群6),表明耿马县种群的遗传多样性最高,老百货公司种群遗传多样性最低。综合各指标,勐腊县2个种群的多样性较低,而临沧市耿马县种群的遗传多样性最高。
利用其他地区埃及伊蚊种群的微卫星引物研究滇西南种群的扩增失败率较高,主要因埃及伊蚊微卫星位点的侧翼序列不够保守且特异性较差[14-15],适用于某种群的微卫星位点并不通用于其他种群,具体情况视种群亲缘关系而定。南美洲的特立尼达种群与中国云南地区种群关系较远,导致2对引物无法扩增出目标条带;而越南和缅甸种群与中国云南埃及伊蚊亲缘关系较近,部分引物可以扩增出目标条带,但多态性较差。
传统获取微卫星位点的方法是先构建微卫星富集文库,继而用探针杂交获得目的片段,比较复杂且昂贵并需要较长时间,该方法工作量大,假阳性率高,冗余序列和不能设计引物的无效克隆占一定比例[16]。磁珠富集法虽极大地提高了克隆阳性率,并成为大规模筛选微卫星位点的常用方法,但仍存在周期过长、成本过高等缺点。本研究所用方法可系统、高效地从埃及伊蚊全基因组序列中寻找到合格的微卫星序列,缩短了获取微卫星序列引物的时间,且极大地降低了成本。
与哺乳动物不同,微卫星类型以2个核苷酸碱基(A和C)含量最高,在埃及伊蚊基因组中,3对碱基重复的微卫星序列较多且多态性也较高[16]。本研究得到的11对引物中,3对碱基重复的微卫星位点有5个,多态性均值达到7.6,可以满足后期种群遗传学的研究需要。
| [1] |
石清明, 赵彤言. 云南省登革热媒介埃及伊蚊入侵扩散现状[J]. 寄生虫与医学昆虫学报, 2016, 23(3): 175-182. |
| [2] |
Jansen CC, Beebe NW. The dengue vector Aedes aegypti:what comes next[J]. Microbes Infect, 2010, 12(4): 272-279. DOI:10.1016/j.micinf.2009.12.011 |
| [3] |
Gloria-Soria A, Ayala D, Bheecarry A, et al. Global genetic diversity of Aedes aegypti[J]. Mol Ecol, 2016, 25(21): 5377-5395. DOI:10.1111/mec.2016.25.issue-21 |
| [4] |
Faucon F, Gaude T, Dusfour I, et al. In the hunt for genomic markers of metabolic resistance to pyrethroids in the mosquito Aedes aegypti:an integrated next-generation sequencing approach[J]. PLoS Negl Trop Dis, 2017, 11(4): e0005526. DOI:10.1371/journal.pntd.0005526 |
| [5] |
王丕玉, 周红宁, 吴超, 等. 云南省登革热媒介埃及伊蚊的分布调查[J]. 中国媒介生物学及控制杂志, 2006, 17(6): 507-508. |
| [6] |
郭颂, 鲁亮, 马怀雷, 等. 黄胸鼠微卫星分子标记的筛选[J]. 中国媒介生物学及控制杂志, 2012, 23(3): 198-201. |
| [7] |
方义亮, 张山鹰, 谢汉国. 登革热媒介伊蚊种群多样性研究进展[J]. 中国人兽共患病学报, 2009, 25(5): 469-472. |
| [8] |
Huber K, Mousson L, Rodhain F, et al. Short report:microsatellite sequences as markers for population genetic studies of the mosquito Aedes aegypti, the vector of dengue viruses[J]. Am J Trop Med Hyg, 1999, 61(6): 1001-1003. DOI:10.4269/ajtmh.1999.61.1001 |
| [9] |
Bataille A, Horsburgh GJ, Dawson DA, et al. Microsatellite markers characterized in the mosquito Aedes taeniorhynchus(Diptera, Culicidae), a disease vector and major pest on the American coast and the Galápagos Islands[J]. Infect Genet Evol, 2009, 9(5): 971-975. DOI:10.1016/j.meegid.2009.04.003 |
| [10] |
Chambers EW, Meece JK, Mcgowan JA, et al. Microsatellite isolation and linkage group identification in the yellow fever mosquito Aedes aegypti[J]. J Hered, 2007, 98(3): 202-210. DOI:10.1093/jhered/esm015 |
| [11] |
Huber K, Mousson L, Rodhain F, et al. Isolation and variability of polymorphic microsatellite loci in Aedes aegypti, the vector of dengue viruses[J]. Mol Ecol Resour, 2001, 1(4): 219-222. |
| [12] |
Slotman MA, Kelly NB, Harrington LC, et al. Polymorphic microsatellite markers for studies of Aedes aegypti (Diptera:Culicidae), the vector of dengue and yellow fever[J]. Mol Ecol Resour, 2007, 7(1): 168-171. |
| [13] |
闫路娜, 张德兴. 种群微卫星DNA分析中样本量对各种遗传多样性度量指标的影响[J]. 动物学报, 2004, 50(2): 279-290. |
| [14] |
Lovin DD, Washington KO, deBruyn B, et al. Genome-based polymorphic microsatellite development and validation in the mosquito Aedes aegypti and application to population genetics in Haiti[J]. BMC Genomics, 2009, 10: 590. DOI:10.1186/1471-2164-10-590 |
| [15] |
Hickner PV, deBruyn B, Lovin DD, et al. Genome-based microsatellite development in the Culex pipiens complex and comparative microsatellite frequency with Aedes aegypti and Anopheles gambiae[J]. PLoS One, 2010, 5(9): e13062. DOI:10.1371/journal.pone.0013062 |
| [16] |
孙波, 鲍毅新, 赵庆洋, 等. 微卫星位点获取方法的研究进展[J]. 生态学杂志, 2009, 28(10): 2130-2137. |
 2018, Vol. 29
2018, Vol. 29