扩展功能
文章信息
- 开文龙, 师灿南, 赵春春, 刘起勇, 宋秀平, 任东升, 李洪斌, 范建华, 周红宁, 孟凤霞
- KAI Wen-long, SHI Can-nan, ZHAO Chun-chun, LIU Qi-yong, SONG Xiu-ping, REN Dong-sheng, LI Hong-bin, FAN Jian-hua, ZHOU Hong-ning, MENG Feng-xia
- 除虫脲对登革热媒介伊蚊拟除虫菊酯类抗性种群的作用效果研究
- Study on the effect of diflubenzuron on pyrethroid-resistant dengue vector Aedes mosquitoes
- 中国媒介生物学及控制杂志, 2018, 29(2): 126-129
- Chin J Vector Biol & Control, 2018, 29(2): 126-129
- 10.11853/j.issn.1003.8280.2018.02.003
-
文章历史
- 收稿日期: 2018-01-16
- 网络出版时间: 2018-03-02 11:39
2 西双版纳傣族自治州疾病预防控制中心, 云南 景洪 666100;
3 云南省寄生虫病防治研究所, 云南 普洱 665000
2 Xishuangbanna Center for Disease Control and Prevention;
3 Yunnan Institute of Parasitic Disease
白纹伊蚊(Aedes albopictus)和埃及伊蚊(Ae. aegypti)是重要的医学媒介昆虫,可传播登革热、黄热病和寨卡病毒病等多种新发及再发传染病[1-2]。在登革热疫情暴发时,使用速杀性化学杀虫剂(如有机磷、氨基甲酸酯和拟除虫菊酯类等)进行超低容量喷雾和滞留喷洒迅速杀灭成蚊是控制疫情的重要手段[3]。但长期大量使用该类杀虫剂可导致抗药性和环境污染等问题产生。综合治理可有效地减少化学杀虫剂的使用,孳生地蚊虫控制是重要的综合治理手段之一,能够可持续地降低蚊密度。在不能通过翻盆倒罐或填埋方式清除的积水中可以投放灭幼杀虫剂,可安全高效地防控蚊虫孳生。
除虫脲作为几丁质合成抑制剂,使用后可使昆虫身体和器官不能成型、体液外泄而死亡[4-5]。多年来,多数除虫脲已在国内外农作物、蔬菜和果树害虫控制中被广泛应用。而且在美国已经用于蚊幼虫和摇蚊幼虫的控制。本研究在实验室条件下,以登革热媒介白纹伊蚊和埃及伊蚊敏感品系和抗性种群为研究对象,测定其对昆虫生长调节剂除虫脲的敏感性及作用特点,为除虫脲在登革热媒介伊蚊的抗性综合治理方面提供基础资料。
1 材料与方法 1.1 试虫来源 1.1.1 白纹伊蚊和埃及伊蚊抗性种群均为2015年10-11月采自景洪市登革热疫区,且对常用拟除虫菊酯类杀虫剂具有40~1 500倍的抗性[6]。
1.1.2 敏感品系白纹伊蚊敏感品系JS?SUS最初于1989年采集自四川省成都市郊区;埃及伊蚊为ICDC-SUS敏感品系。所用敏感品系均为本实验室在不接触任何杀虫剂的情况下长期饲养,并对常用化学杀虫剂均敏感。
1.2 杀虫剂98.7%除虫脲原药由拜耳作物科学(中国)有限公司惠赠。
1.3 测定方法采用WHO推荐的昆虫生长调节剂的抗药性测定方法[7]。按照师灿南等[3]测定吡丙醚对登革热媒介伊蚊敏感性实验的操作步骤,在相同控制条件下、用相同的死亡或抑制的判断标准,测定除虫脲对白纹伊蚊及埃及伊蚊的作用效果。
1.4 抗性判定标准抗性水平用相对抗性倍数(RR)表示,RR=抗性种群半数抑制剂量(IE50)/敏感品系IE50,RR<3为敏感;3≤RR<10为低抗;10≤RR<40为中抗;RR≥40为高抗[8]。
1.5 统计学分析利用SPSS 24.0软件进行概率回归分析,计算除虫脲对测试蚊虫的IE50、IE90、IE99及其95%CI等。
2 结果 2.1 埃及伊蚊抗性种群对除虫脲的敏感性由表 1可知,埃及伊蚊抗性种群和敏感品系IE50及其95%CI分别为0.002 33(0.001 98~0.003 12)和0.001 32(0.001 05~0.001 49)μg/ml,抗性倍数为1.77倍;抗性种群及敏感品系的b值分别为5.826和4.809。表 1显示,具有对拟除虫菊酯类杀虫剂高抗性的埃及伊蚊,对几丁质合成抑制剂除虫脲仍然敏感(RR为1.77倍),景洪种群埃及伊蚊对保幼激素类似物吡丙醚也非常敏感[3]。
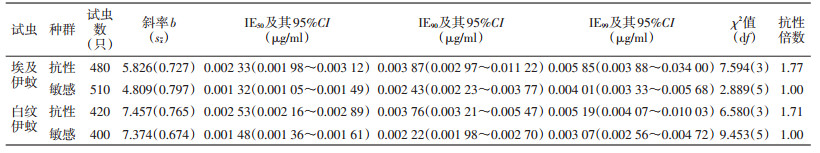
|
由表 1可见,白纹伊蚊抗性种群和敏感品系IE50及其95%CI分别为0.002 53(0.002 16~0.002 89)和0.001 48(0.001 36~0.001 61)μg/ml,抗性倍数为1.71倍;抗性种群及敏感品系的b值分别为7.457和7.374。表 1显示,具有对拟除虫菊酯类杀虫剂高抗性的白纹伊蚊,对几丁质合成抑制剂除虫脲仍然敏感(RR为1.71倍),但景洪种群白纹伊蚊对保幼激素类似物吡丙醚产生中抗(RR为5.5倍)[3]。
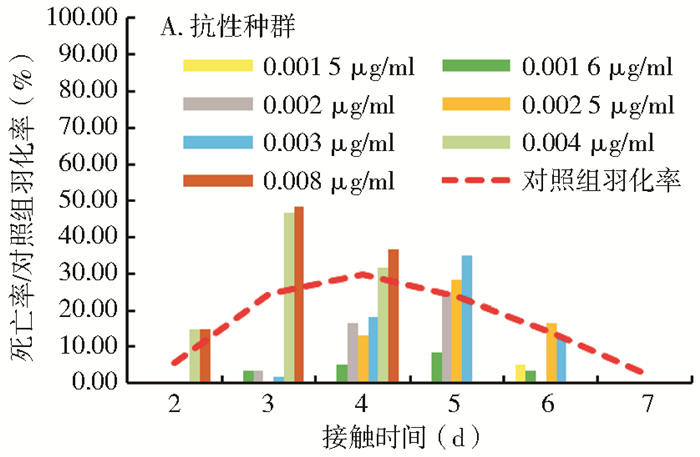
2.3 埃及伊蚊在不同浓度除虫脲作用下的死亡时间分布埃及伊蚊抗性种群和敏感品系分别在第3~5天和第5~6天形成死亡高峰,对照组和各浓度处理组在第7天均无试虫存活(图 1A、B)。
|
| 图 1 埃及伊蚊抗性种群(A)和敏感品系(B)接触不同浓度除虫脲的死亡时间分布 Figure 1 The death time distribution of the resistant(A) and sensitive(B)strains of Aedes aegypti in different concentrations of diflubenzuron |
| |
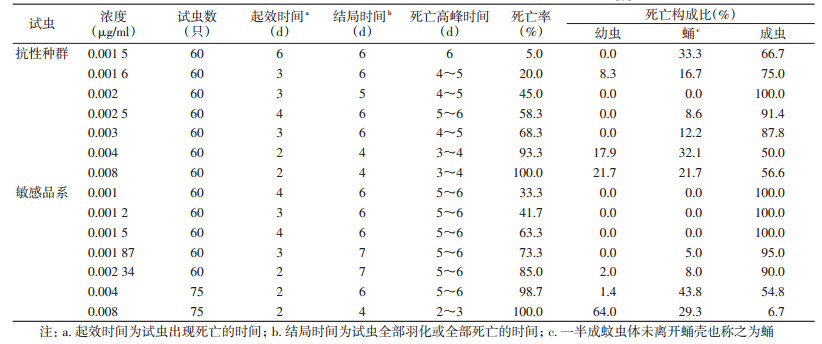
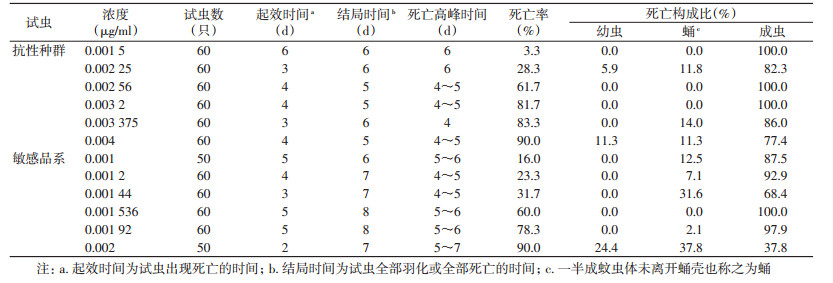
在0.001~0.001 5 μg/ml低浓度作用下,埃及伊蚊敏感品系在成虫阶段出现死亡,当浓度上升至0.001 87 μg/ml时,蛹开始出现死亡,占该浓度死亡总数的5.0%;当浓度达到0.002 34 μg/ml时,蚊幼虫出现死亡。除虫脲浓度为0.001 5 μg/ml时,埃及伊蚊抗性种群出现蛹的死亡,当浓度达0.004 μg/ml时,蚊幼虫出现大量死亡,占总死亡数的17.9%,2个品系的蚊幼虫死亡数所占比例均具有随浓度升高而增加的趋势,见表 2。
|
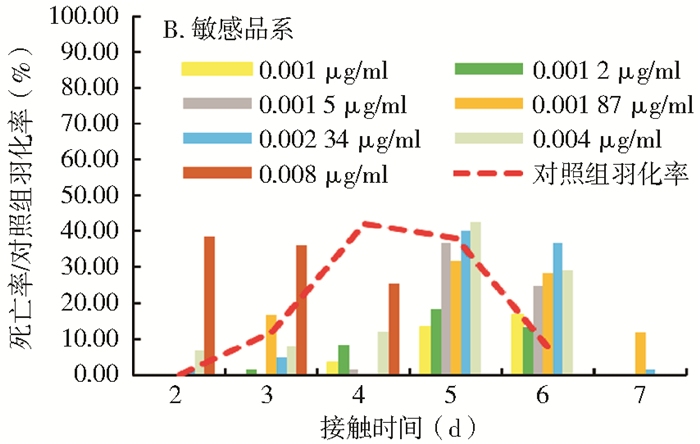
白纹伊蚊抗性种群在第3天出现少量死亡,第4~5天形成死亡高峰,在第7天全部羽化或死亡(图 2A);敏感品系在第2天开始出现死亡,接触第5~6天达到死亡高峰,一直持续到第8天(图 2B)。
|
| 图 2 白纹伊蚊抗性种群(A)和敏感品系(B)接触不同浓度除虫脲的死亡时间分布 Figure 2 The death time distribution of the resistant(A)and sensitive(B)strains of Aedes albopictus in different concentrations of diflubenzuron |
| |
在0.001~0.001 92 μg/ml浓度下,白纹伊蚊敏感品系出现蛹及成虫的死亡,当浓度达到0.002 μg/ml时,蚊幼虫开始出现死亡,占死亡总数的24.4%;在浓度为0.001 5~0.003 375 μg/ml时,白纹伊蚊抗性种群出现蛹及成虫的死亡,当浓度达到0.004 μg/ml时,蚊幼虫出现死亡,见表 3。
|
图 1、2和表 2、3显示,埃及伊蚊及白纹伊蚊景洪种群的结局时间和死亡高峰时间较敏感品系早,在浓度相同或相近时,埃及伊蚊抗性种群的起效时间为2~3 d,结局时间为5~6 d,死亡高峰时间为4~5 d;埃及伊蚊敏感品系的起效时间为2~3 d,结局时间为6~7 d,死亡高峰时间为5~6 d。同样,白纹伊蚊抗性种群的起效时间为3~4 d,结局时间为5~6 d,死亡高峰时间为4~5 d;白纹伊蚊敏感品系的起效时间为3~5 d,结局时间为7~8 d,死亡高峰时间为5~6 d。整体而言,敏感品系的发育时间较抗性种群晚,因此,除虫脲对敏感品系的作用时间较抗性种群也要缓慢一些。
3 讨论本研究所用的抗性种群于2015年采自景洪市登革热疫区,其化学杀虫剂抗药性背景清晰。景洪市白纹伊蚊幼虫和埃及伊蚊幼虫对拟除虫菊酯类的抗性均高达几百倍甚至上千倍,如景洪市白纹伊蚊幼虫对氯菊酯抗性倍数为1 559.7倍,景洪市埃及伊蚊幼虫对氯菊酯抗性倍数为865.5倍[6]。本研究显示,2个抗性种群与敏感品系对除虫脲的敏感性接近,表明除虫脲与拟除虫菊酯类杀虫剂无交互抗性,与Belinato和Valle[9]的研究结果一致。
本研究结果显示,除虫脲作用比较缓慢,作用时间较长,一般持续时间为1周左右;而常用的化学杀虫剂使用24 h即能看到作用效果,因而在现场使用除虫脲时并不能达到立竿见影的效果,而是一个持续缓慢的过程。
通过表 1推荐使用埃及伊蚊抗性种群除虫脲IE99剂量(约0.006 μg/ml)作为控制剂量处理伊蚊孳生水体,抗性种群的抑制效果>99%。本研究埃及伊蚊初步的诊断剂量为0.008 02 μg/ml,白纹伊蚊的诊断剂量为0.006 14 μg/ml。尽管有关蚊幼虫对除虫脲抗药性发生研究仅见于20世纪70-80年代,是一种低风险性杀虫剂[10],但蚊虫媒介对所有杀虫剂均存在抗药性产生的风险,所以应制定预防抗药性产生的相关策略,如交替、复配使用杀虫剂,并随时监测抗药性动态,从而有效地延长其使用寿命,实现蚊虫的可持续控制。
| [1] |
张硕, 李德新. 寨卡病毒和寨卡病毒病[J]. 病毒学报, 2016, 32(1): 121-127. |
| [2] |
陆宝麟. 中国动物志.昆虫纲.第8卷.双翅目:蚊科[M]. 北京: 科学出版社, 1997, 222-224.
|
| [3] |
师灿南, 开文龙, 刘起勇, 等. 景洪市登革热媒介伊蚊对吡丙醚的敏感性及其作用特点[J]. 中国媒介生物学及控制杂志, 2017, 28(2): 108-112. DOI:10.11853/j.issn.1003.8280.2017.02.003 |
| [4] |
苏天运. 生物理念杀蚊幼剂的历史与现状及未来[J]. 中华卫生杀虫药械, 2014, 20(1): 1-5, 9. |
| [5] |
苏天运. 蚊虫对微生物和昆虫生长调节剂杀幼剂的抗药性及其管理[J]. 中国媒介生物学及控制杂志, 2014, 25(3): 193-199. DOI:10.11853/j.issn.1003.4692.2014.03.001 |
| [6] |
师灿南. 景洪市登革热媒介伊蚊对常用杀虫剂的抗药性及机制的初步研究[D]. 北京: 中国疾病预防控制中心, 2017.
|
| [7] |
World Health Organization. Guideline for laboratory and field testing of mosquito larvicides[R]. Geneva: WHO, 2005: 13.
|
| [8] |
Zhang K, Zhang W, Zhang S, et al. Susceptibility of Sogatella furcifera and Laodelphax striatellus(Hemiptera:Delphacidae)to six insecticides in China[J]. J Econ Entomol, 2014, 107(5): 1916-1922. DOI:10.1603/EC14156 |
| [9] |
Belinato TA, Valle D. The impact of selection with diflubenzuron, a chitin synthesis inhibitor, on the fitness of two Brazilian Aedes aegypti field populations[J]. PLoS One, 2015, 10(6): e0130719. DOI:10.1371/journal.pone.0130719 |
| [10] |
Walker AL, Wood RJ. Laboratory selected resistance to diflubenzuronin larvae of Aedes aegypti[J]. Pest Manag Sci, 1986, 17(5): 495-502. DOI:10.1002/ps.v17:5 |
 2018, Vol. 29
2018, Vol. 29


