扩展功能
文章信息
- 陈翰明, 高景鹏, 姜进勇, 彭恒, 马雅军
- CHEN Han-ming, GAO Jing-peng, JIANG Jin-yong, PENG Heng, MA Ya-jun
- 我国白纹伊蚊现场群体击倒抗性基因I1532和F1534突变检测及I1532T突变等位基因报告
- Detection of the I1532 and F1534 kdr mutations and a novel mutant allele I1532T in VGSC gene in the field populations of Aedes albopictus from China
- 中国媒介生物学及控制杂志, 2018, 29(2): 120-125
- Chin J Vector Biol & Control, 2018, 29(2): 120-125
- 10.11853/j.issn.1003.8280.2018.02.002
-
文章历史
- 收稿日期: 2018-01-18
- 网络出版时间: 2018-01-22 13:30
2 云南省寄生虫病防治所, 云南 普洱 665099
2 Yunnan Institute of Parasitic Diseases
白纹伊蚊(Aedes albopictus)广泛分布于热带、亚热带和温带地区,是我国常见蚊种。北至辽宁省,南至海南省,西至西藏自治区,均有白纹伊蚊分布,其中30°N以南地区密度较高[1]。白纹伊蚊可传播多种疾病,如登革热、基孔肯雅热和寨卡病毒病等。WHO估计全球约25亿人受登革热威胁,每年超过1亿例感染登革热病毒[2]。近年来,我国登革热疫情形势严峻,尤其是2014年广东省大规模暴发流行登革热疫情,报告病例超过45 000例[3]。2017年我国多地出现新的登革热本地病例,如上海市[4]和浙江省[5],甚至北至山东省济宁市[6]。媒介控制是蚊媒传染病防控的关键,疫情暴发时,以化学杀虫剂控制媒介为主要措施。拟除虫菊酯类(菊酯类)杀虫剂具有高效低毒的特点。近年来,大量、广泛使用菊酯类化学杀虫剂,导致我国多地白纹伊蚊群体对其产生了不同程度的抗药性[7],为蚊媒疾病防控带来巨大挑战。
蚊虫抗性机制主要包括行为抗性、代谢抗性和击倒抗性(knockdown resistance,kdr)等[8]。击倒抗性又称靶标抗性,因杀虫剂的作用靶点突变导致蚊虫的敏感性下降,产生抗药性。研究证实,击倒抗性的分子机制为蚊虫神经细胞膜上电压门控钠离子通道(voltage-gated sodium channel,VGSC)编码基因出现点突变,导致相应氨基酸改变,钠通道结构变化,与杀虫剂的结合能力减弱,敏感性降低。有研究发现,VGSC基因突变与不同蚊种的抗性表型存在相关性[9-17]。但目前白纹伊蚊的kdr基因突变研究报告较少,Kasai等[10]参考埃及伊蚊(Ae. aegypti)相关信息,对采自新加坡的白纹伊蚊抗性群体的kdr基因进行初步研究,首次发现有73.10%个体为F1534C突变。本课题组收集海南省海口市白纹伊蚊多个群体,在对多种菊酯类杀虫剂敏感性进行生物测定的基础上检测kdr基因突变,发现F1534S与白纹伊蚊对菊酯类杀虫剂的抗性表型密切相关,并首次记录kdr新的等位基因TCC/S和TTG/L[9, 13];F1534S和F1534L在广东省白纹伊蚊群体中也有发现[12, 18]。然而,我国其他地区白纹伊蚊群体的kdr突变基因类型及其频率尚未见报道。本研究采集上海市杨浦区、江苏省南京市、浙江省杭州市和云南省景洪市等地的白纹伊蚊,检测其kdr基因突变情况,以期丰富我国白纹伊蚊群体kdr基因突变数据,探讨抗药性基因适应性进化特点,为kdr突变作为白纹伊蚊菊酯类抗药性检测和监测的分子标志奠定基础。
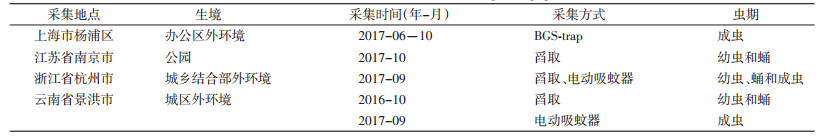
1 材料与方法 1.1 试虫来源2016年10月及2017年6-10月,在上海市杨浦区、江苏省南京市、浙江省杭州市和云南省景洪市外环境或公园白纹伊蚊孳生地舀取蚊幼虫和蛹,带回实验室饲养至成蚊(表 1),每个群体来源于5个以上的孳生地采集的幼虫或蛹。饲养条件为温度(26±1)℃,相对湿度(65±5)%,光周期(L:D)=12 h:12 h。成虫用BGS?trap收集装置[19]或电动吸蚊器直接吸取,75%乙醇浸泡,-20 ℃保存。依据形态特征鉴定蚊虫种类[20]。
DNAzol购自美国Invitrogen Life Technologies公司;基因组提取试剂盒、TaqPCR预混液和DNA标记物均购自北京艾德莱生物科技有限公司。
1.3 kdr基因扩增及测序经形态鉴定为白纹伊蚊的单只成虫样本,置60 μl DNAzol中,按照说明书抽提基因组DNA。以基因组DNA为模板扩增白纹伊蚊的VGSC基因部分片段[17],参照文献[10]合成引物,引物序列:正向aegSCF7 5′-GAG AAC TCG CCG ATG AAC TT-3′,反向albSCR9 5′-CTG ATC CTC CGT CAT GAA CA-3′。PCR反应体系中包含2×TaqPCR预混液12.5 μl,10 μmol/L正、反向引物各1 μl,模板1 μl,加双蒸水至25 μl。反应条件:94 ℃ 2 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,共35个循环;72 ℃ 8 min。扩增产物经1%琼脂糖凝胶电泳检测后,送铂尚生物技术(上海)有限公司合成,应用四色荧光标记的双脱氧末端终止法,以正、反向引物双向测序。
1.4 序列比对和统计学分析应用Seqman、BioEdit和ClustalX软件对测得的VGSC基因部分序列进行峰图比对和分析,观察各位点的突变情况,确定等位基因类型和基因型,分别统计和计算各采集地样本kdr等位基因和基因型频率。应用GENPOP 3.4软件包检验位点间连锁不平衡情况和偏离哈代-温伯格平衡的位点。
2 结果 2.1 kdr基因的等位基因和基因型本研究扩增和测定的序列长度约为350 bp,在GenBank上进行BLAST比对,与白纹伊蚊VGSC基因第3编码区的部分序列(KC152046.1)一致性达99.00%,证实所得序列为白纹伊蚊kdr基因部分片段。
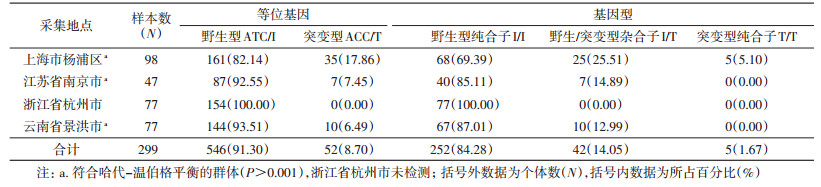
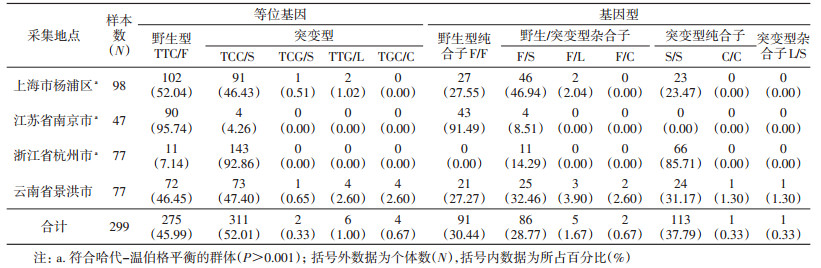
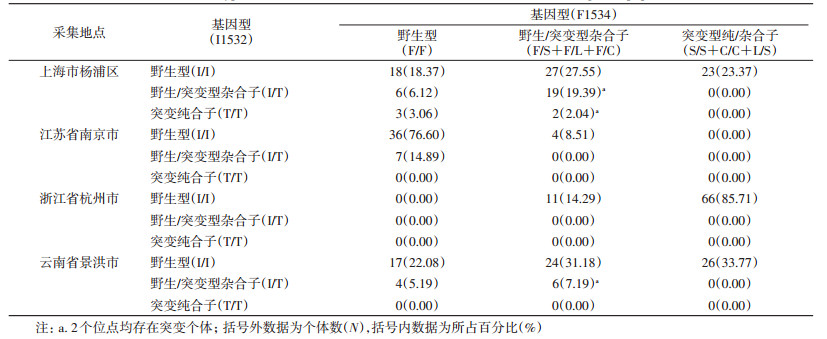
对获得的299个白纹伊蚊kdr基因部分片段进行序列比对分析发现,I1532和F1534位点存在突变。1532位点共有2种等位基因,即野生型ATC/I(91.30%)和突变型ACC/T(8.70%);3种基因型,即野生型纯合子I/I(84.28%)、野生/突变型杂合子I/T(14.05%)和突变型纯合子T/T(1.67%),见表 2。1534位点共有5种等位基因,即野生型TTC/F(45.99%),突变型TCC/S(52.01%)、TCG/S(0.33%)、TTG/L(1.00%)和TGC/C(0.67%);7种基因型分别为野生型纯合子F/F(30.44%)、野生/突变型杂合子F/S(28.77%)、F/L(1.67%)和F/C(0.67%),突变型纯合子S/S(37.79%)、C/C(0.33%)和杂合子L/S(0.33%),见表 3。其中,1532和1534位点同时突变(包括野生/突变型杂合子和突变型纯合子)的个体共27个。
|
|
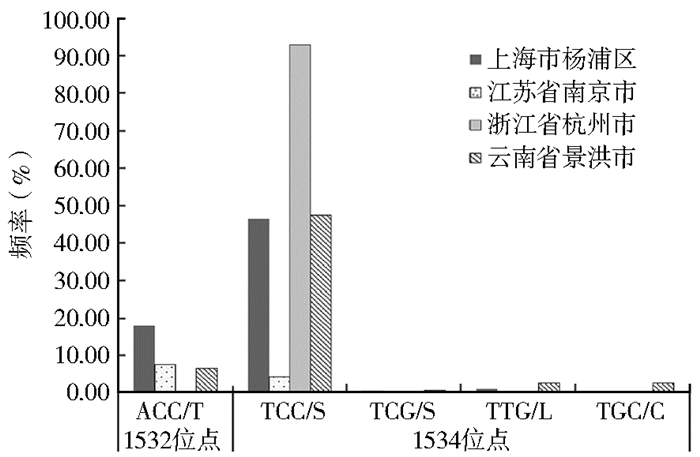
白纹伊蚊4个现场群体1532和1534位点突变情况见图 1。其中1532位点的突变等位基因仅有1种类型,见表 2、图 1,以杨浦区白纹伊蚊群体的突变频率最高(17.86%),南京和景洪市的突变频率分别为7.45%和6.49%,而浙江省杭州市群体未发现1532位点突变。
|
| 图 1 白纹伊蚊现场群体kdr突变等位基因的类型和频率 Figure 1 Types and frequency of kdr mutant alleles in Aedes albopictus populations |
| |
1534位点突变较1532位点更为频繁,类型多样,见表 3、图 1。突变等位基因共4个类型,以TCC/S为主,杨浦区和景洪市群体等位基因TCC/S频率分别为46.43%和47.40%,杭州市群体高达92.86%,南京市群体最低,为4.26%;其他突变类型频率均较低(<3%)。突变的等位基因类型在景洪市的群体中最为复杂,存在TCC/S、TCG/S、TTG/L和TGC/C 4种类型;其次是杨浦区,有3种类型,而南京和杭州市的群体仅存在TCC/S突变。
2.3 kdr基因的I1532与F1534位点同时突变分析kdr基因部分片段I1532和F1534两个位点同为野生基因型的个体共71个(23.75%);分别为野生型和野生/突变基因型的有201个(67.22%);同为突变基因型的共27个(9.03%),见表 4。两个位点同时突变的基因型仅在上海市杨浦区(21.43%)和云南省景洪市(7.19%)的群体中发现;所有样本中,未发现2个位点均为突变纯合子的个体。连锁不平衡检验结果显示,若以群体(除浙江省杭州市外)分析,仅上海市杨浦区白纹伊蚊群体存在2个位点的连锁关联(P<0.01);若将所有样本合并分析,2个位点间为连锁关联关系(P<0.01)。
|
白纹伊蚊是多种蚊媒传染病的传播媒介,本研究采集地上海和杭州市在2017年均有本地登革热病例报道,景洪市近年来登革热疫情形势也十分严峻[21],因此,上述地区的白纹伊蚊防控工作非常严峻和紧迫。目前,菊酯类杀虫剂空间喷洒仍是控制白纹伊蚊成蚊的重要手段[22-23],而抗药性的产生、扩散和抗性水平的逐渐升高[24-26],为蚊媒防制带来巨大挑战。密切监测现场蚊虫的抗药性水平,可为当地制定科学有效的防制策略提供科学依据。
研究与抗性表型密切相关的基因突变,有助于客观地评价蚊虫的抗药性。目前,相关研究主要集中在埃及伊蚊[9-10, 12-13],如埃及伊蚊VGSC基因3个突变位点(I1011M/V、V1016G/I和F1534C)与DDT和菊酯类杀虫剂抗性相关[17, 27-31];S989P仅与菊酯类杀虫剂抗性有关[32];F1534C与氯菊酯的抗性关系更加密切[10, 13, 33-35];而新的研究提示,在S989P+V1016G高突变频率的地区应避免使用DDT,kdr突变与菊酯类杀虫剂的化学结构并无显著关系[11]。关于白纹伊蚊的相关研究是Kasai等[10]最早在新加坡的抗性群体中发现F1534C突变;本课题组在海南省海口市的白纹伊蚊菊酯类杀虫剂抗性群体中检测到F1534S(31.54%)和F1534L(0.71%),且发现前者与抗性表型密切相关[9, 13],广东省广州市也有类似的结果[18]。此外,Xu等[12]检测了全球多地白纹伊蚊的kdr基因突变情况,发现在美国佛罗里达(F1534S)、希腊雅典(F1534C)和意大利阿科(F1534L)的群体也存在一定比例的kdr基因突变,并在意大利罗马群体中检测到I1532T(19.70%),但未发现存在2个位点同时突变的情况。本研究检测的我国东部和西南4个现场白纹伊蚊群体的kdr突变等位基因频率范围分别为0~17.86%(I1532)和4.26%~92.86%(F1534),不同群体间存在差异,而且F1534突变等位基因的类型也不同。已有的研究证实,F1534S与白纹伊蚊对菊酯类杀虫剂的抗性表型具有显著相关性[9, 18]。本研究检测的F1534S等位基因频率除江苏省南京市群体外,其他3个地点均>45.00%,甚至高达92.86%(浙江省杭州市),提示当地白纹伊蚊群体对菊酯类杀虫剂具有相当程度的抗药性,相关的生物测定数据支持上述结果[36-38]。因此,深入研究白纹伊蚊kdr基因的突变,有助于开发其为检测抗药性的分子标志,显著提升蚊虫抗性监测工作的质量和效率。
本研究的白纹伊蚊现场群体来自4个地点,采集的虫期包括成虫和幼虫或蛹。为保证群体具有地区的代表性,上海市杨浦区的样本采集历时5个月,云南省景洪市的样本来自2个年份,浙江省杭州市和江苏省南京市的样本虽然采集时间局限,但幼虫和蛹均来自方圆500 m以上、至少5个孳生地。哈代-温伯格平衡检验结果也显示,研究的样本几乎均来自随机交配的群体,可见本研究白纹伊蚊现场群体样本具有较强的代表性。在研究中还发现不同群体的白纹伊蚊遗传背景并不单一,如kdr基因非编码区存在多态性,编码区的同义突变在不同群体中差异较大(未发表数据)。群体的遗传背景与选择压力下kdr的突变及其频率密切相关,故阐明kdr基因在群体中的起源、维持和扩散的适应性进化机制,需要首先了解白纹伊蚊群体的遗传差异和结构。
本研究仅在上海市杨浦区及云南省景洪市白纹伊蚊群体中发现kdr基因I1532和F1534两个位点同时突变的个体,频率分别为21.43%和7.19%,推测当地使用菊酯类杀虫剂的种类和数量均较多,使其暴露在较强的选择压力之下导致。类似的多个位点同时突变的情况,在埃及伊蚊群体(S989P+V1016G)中也有发现,且已证明可产生降低蚊虫对杀虫剂敏感性的叠加效应[11, 39]。白纹伊蚊的I1532和F1534两个位点在VGSC基因中仅相隔3个碱基,连锁不平衡检验结果显示,其在遗传中存在连锁关联关系。另外,我们在浙江省杭州市白纹伊蚊群体中未检测到I1532T,但F1534S的比例很高,推测可能因I1532T尚未从上海市扩散到杭州市,或因较强的选择清扫致使其多态性下降[40]。另外,两个位点同时突变在白纹伊蚊对菊酯类杀虫剂抗药性中的贡献问题,需继续收集更多样本深入研究。
志谢: 浙江省CDC姚立农、中国CDC寄生虫病预防控制所张丽等协助采集现场标本,一并志谢| [1] |
杨舒然, 刘起勇. 白纹伊蚊的全球分布及扩散趋势[J]. 中国媒介生物学及控制杂志, 2013, 24(1): 1-4. |
| [2] |
Kraemer MUG, Sinka ME, Duda KA, et al. The global distribution of the arbovirus vectors Aedes aegypti and Ae. albopictus[J]. eLife, 2015, 4: e08347. |
| [3] |
Xiao JP, He JF, Deng AP, et al. Characterizing a large outbreak of dengue fever in Guangdong province, China[J]. Infect Dis Poverty, 2016, 5: 44. DOI:10.1186/s40249-016-0131-z |
| [4] |
上海市卫生和计划生育委员会. 本市报告发现首例本地感染登革热病例[EB/OL]. (2017-09-26)[2018-01-10]. http://www.wsjsw.gov.cn/wsj/n422/n424/u1ai142084.html?from=groupmessage&isappinstalled=0.
|
| [5] |
浙江新闻. 杭州市累计报告登革热病例1008例[EB/OL]. (2017-09-29)[2018-01-10]. http://zjnews.zjol.com.cn/zjnews/hznews/201709/t20170929_5237768.shtml.
|
| [6] |
嘉祥县人民政府办公室. 嘉祥县人民政府办公室关于终止登革热暴发疫情应急响应的通知[EB/OL]. (2017-10-13)[2018-01-10]. http://www.jiaxiang.gov.cn/content.jsp?id=bc5372855f484da0015f57270e0b01cc&classid=2c17a4be401f4817aecce1ab7fb2d1be.
|
| [7] |
孟凤霞, 王义冠, 冯磊, 等. 我国登革热疫情防控与媒介伊蚊的综合治理[J]. 中国媒介生物学及控制杂志, 2015, 26(1): 4-10. DOI:10.11853/j.issn.1003.4692.2015.01.002 |
| [8] |
Hemingway J, Ranson H. Insecticide resistance in insect vectors of human disease[J]. Annu Rev Entomol, 2000, 45: 371-391. DOI:10.1146/annurev.ento.45.1.371 |
| [9] |
Chen HY, Li KL, Wang XH, et al. First identification of kdr allele F1534S in VGSC gene and its association with resistance to pyrethroid insecticides in Aedes albopictus populations from Haikou city, Hainan Island, China[J]. Infect Dis Poverty, 2016, 5: 31. DOI:10.1186/s40249-016-0125-x |
| [10] |
Kasai S, Ng LC, Lam-Phua SG, et al. First detection of a putative knockdown resistance gene in major mosquito vector, Aedes albopictus[J]. Jpn J Infect Dis, 2011, 64(3): 217-221. |
| [11] |
Smith LB, Kasai S, Scott JG. Voltage-sensitive sodium channel mutations S989P + V1016G in Aedes aegypti confer variable resistance to pyrethroids, DDT and oxadiazines[J]. Pest Manag Sci, 2017. DOI:10.1002/ps.4771.(inPress) |
| [12] |
Xu JB, Bonizzoni M, Zhong DB, et al. Multi-country survey revealed prevalent and novel F1534S mutation in voltage-gated sodium channel(VGSC)gene in Aedes albopictus[J]. PLoS Negl Trop Dis, 2016, 10(5): e0004696. DOI:10.1371/journal.pntd.0004696 |
| [13] |
王晓花, 陈辉莹, 杨新艳, 等. 海口市白纹伊蚊对菊酯类杀虫剂的抗药性及击倒抗性基因突变分析[J]. 第二军医大学学报, 2015, 36(8): 832-838. |
| [14] |
Wang Y, Yu WQ, Shi H, et al. Historical survey of the kdr mutations in the populations of Anopheles sinensis in China in 1996-2014[J]. Malar J, 2015, 14: 120. DOI:10.1186/s12936-015-0644-0 |
| [15] |
Chang XL, Zhong DB, Fang Q, et al. Multiple resistances and complex mechanisms of Anopheles sinensis mosquito:a major obstacle to mosquito-borne diseases control and elimination in China[J]. PLoS Negl Trop Dis, 2014, 8(5): e2889. DOI:10.1371/journal.pntd.0002889 |
| [16] |
Tan WL, Wang ZM, Li CX, et al. First report on co-occurrence knockdown resistance mutations and susceptibility to beta-cypermethrin in Anopheles sinensis from Jiangsu province, China[J]. PLoS One, 2012, 7(1): e29242. DOI:10.1371/journal.pone.0029242 |
| [17] |
Saavedra-Rodriguez K, Urdaneta-Marquez L, Rajatileka S, et al. A mutation in the voltage-gated sodium channel gene associated with pyrethroid resistance in Latin American Aedes aegypti[J]. Insect Mol Biol, 2007, 16(6): 785-798. DOI:10.1111/j.1365-2583.2007.00774.x |
| [18] |
Li YJ, Xu JB, Zhong DB, et al. Evidence for multiple-insecticide resistance in urban Aedes albopictus populations in southern China[J]. Parasit Vectors, 2018, 11: 4. DOI:10.1186/s13071-017-2581-y |
| [19] |
Pombi M, Guelbeogo WM, Calzetta M, et al. Evaluation of a protocol for remote identification of mosquito vector species reveals BG-Sentinel trap as an efficient tool for Anopheles gambiae outdoor collection in Burkina Faso[J]. Malar J, 2015, 14: 161. DOI:10.1186/s12936-015-0674-7 |
| [20] |
陆宝麟, 许锦江, 俞渊, 等. 中国动物志.昆虫纲.第9卷.双翅目:蚊科[M]. 北京: 科学出版社, 1997, 88-106.
|
| [21] |
杨明东, 姜进勇, 郭晓芳, 等. 2009-2014年云南省登革热流行病学调查与分析[J]. 中国病原生物学杂志, 2015, 10(8): 738-742. |
| [22] |
WHO. Pesticides and their application:for the control of vectors and pests of public health importance[M]. 6th ed. Geneva: World Health Organization, 2006.
|
| [23] |
WHO. Dengue hemorrhagic fever: diagnosis, treatment, prevention, and control[R]. Geneva: World Health Organization, 1997.
|
| [24] |
段金花, 蔡松武, 吴军, 等. 2014年广东省登革热疫情应急控制后期白纹伊蚊抗药性水平调查[J]. 中国媒介生物学及控制杂志, 2017, 28(2): 141-143. DOI:10.11853/j.issn.1003.8280.2017.02.011 |
| [25] |
李成玲, 胡志刚, 江毅民, 等. 广州地区白纹伊蚊对常用杀虫剂抗药性的初步研究[J]. 热带医学杂志, 2010, 10(4): 429-430, 447. |
| [26] |
蔡松武, 段金花, 卢文成, 等. 广州市城区白纹伊蚊抗药性现状与预防对策探讨[J]. 华南预防医学, 2004, 30(4): 40-41. |
| [27] |
Brengues C, Hawkes NJ, Chandre F, et al. Pyrethroid and DDT cross-resistance in Aedes aegypti is correlated with novel mutations in the voltage-gated sodium channel gene[J]. Med Vet Entomol, 2003, 17(1): 87-94. DOI:10.1046/j.1365-2915.2003.00412.x |
| [28] |
Harris AF, Rajatileka S, Ranson H. Pyrethroid resistance in Aedes aegypti from Grand Cayman[J]. Am J Trop Med Hyg, 2010, 83(2): 277-284. DOI:10.4269/ajtmh.2010.09-0623 |
| [29] |
Yanola J, Somboon P, Walton C, et al. High-throughput assays for detection of the F1534C mutation in the voltage-gated sodium channel gene in permethrin-resistant Aedes aegypti and the distribution of this mutation throughout Thailand[J]. Trop Med Int Health, 2011, 16(4): 501-509. DOI:10.1111/tmi.2011.16.issue-4 |
| [30] |
Kawada H, Higa Y, Komagata O, et al. Widespread distribution of a newly found point mutation in voltage-gated sodium channel in pyrethroid-resistant Aedes aegypti populations in Vietnam[J]. PLoS Negl Trop Dis, 2009, 3(10): e527. DOI:10.1371/journal.pntd.0000527 |
| [31] |
Kawada H, Oo SZM, Thaung S, et al. Co-occurrence of point mutations in the voltage-gated sodium channel of pyrethroid-resistant Aedes aegypti populations in Myanmar[J]. PLoS Negl Trop Dis, 2014, 8(7): e3032. DOI:10.1371/journal.pntd.0003032 |
| [32] |
Marcombe S, Mathieu RB, Pocquet N, et al. Insecticide resistance in the dengue vector Aedes aegypti from Martinique:distribution, mechanisms and relations with environmental factors[J]. PLoS One, 2012, 7(2): e30989. DOI:10.1371/journal.pone.0030989 |
| [33] |
Ishak IH, Jaal Z, Ranson H, et al. Contrasting patterns of insecticide resistance and knockdown resistance(kdr) in the dengue vectors Aedes aegypti and Aedes albopictus from Malaysia[J]. Parasit Vectors, 2015, 8: 181. DOI:10.1186/s13071-015-0797-2 |
| [34] |
Kushwah RBS, Dykes CL, Kapoor N, et al. Pyrethroid-resistance and presence of two knockdown resistance (kdr) mutations, F1534C and a novel mutation T1520I, in Indian Aedes aegypti[J]. PLoS Neg Trop Dis, 2015, 9(1): e3332. DOI:10.1371/journal.pntd.0003332 |
| [35] |
Kushwah RBS, Mallick PK, Ravikumar H, et al. Status of DDT and pyrethroid resistance in Indian Aedes albopictus and absence of knockdown resistance(kdr)mutation[J]. J Vector Borne Dis, 2015, 52(1): 95-98. |
| [36] |
刘洪霞, 朱江, 刘曜, 等. 上海地区2015-2016年白纹伊蚊幼虫监测及抗药性调查[J]. 中国媒介生物学及控制杂志, 2017, 28(4): 305-307. DOI:10.11853/j.issn.1003.8280.2017.04.001 |
| [37] |
龚震宇, 侯娟, 任樟尧, 等. 浙江省淡色库蚊和白纹伊蚊对常用化学杀虫剂的抗性调查[J]. 中国媒介生物学及控制杂志, 2012, 23(5): 458-460. |
| [38] |
师灿南. 景洪市登革热媒介伊蚊对常用杀虫剂的抗药性及机制初步研究[D]. 北京: 中国疾病预防控制中心, 2017.
|
| [39] |
Plernsub S, Saingamsook J, Yanola J, et al. Additive effect of knockdown resistance mutations, S989P, V1016G and F1534C, in a heterozygous genotype conferring pyrethroid resistance in Aedes aegypti in Thailand[J]. Parasit Vectors, 2016, 9(1): 417. DOI:10.1186/s13071-016-1713-0 |
| [40] |
Main BJ, Lee Y, Collier TC, et al. Complex genome evolution in Anopheles coluzzii associated with increased insecticide usage in Mali[J]. Mol Ecol, 2015, 24(20): 5145-5157. DOI:10.1111/mec.13382 |
 2018, Vol. 29
2018, Vol. 29