扩展功能
文章信息
- 何建, 杨晓艳, 李胜, 靳娟, 张琪, 辛有全, 金泳, 熊浩明, 杨汉青, 魏柏青, 代瑞霞, 祁芝珍
- HE Jian, YANG Xiao-yan, LI Sheng, JIN Juan, ZHANG Qi, XIN You-quan, JIN Yong, XIONG Hao-ming, YANG Han-qing, WEI Bai-qing, DAI Rui-xia, QI Zhi-zhen
- 西藏自治区鼠疫自然疫源地鼠疫耶尔森菌耐药及耐消毒剂基因的研究
- Study on the drug and disinfectant resistant genes of Yersina pestis in natural plague foci in Tibet
- 中国媒介生物学及控制杂志, 2018, 29(1): 61-63, 67
- Chin J Vector Biol & Control, 2018, 29(1): 61-63, 67
- 10.11853/j.issn.1003.8280.2018.01.015
-
文章历史
- 收稿日期: 2017-08-27
- 网络出版时间: 2017-12-12 11:34
历史上3次世界性鼠疫大流行夺去数万人生命, 19世纪抗生素的出现使鼠疫死亡率大幅度降低, 鼠疫耶尔森菌(Yersina pestis, 鼠疫菌)一旦产生抗生素耐药性, 将再次面临鼠疫危机。具有耐药性的鼠疫菌较少, 马达加斯加分离的2株耐药鼠疫菌的发现使全球对鼠疫菌进行系统的抗生素耐药性监测势在必行[1]。革兰阴性多耐药菌株持续增加[2]。因此, 选择我国鼠疫治疗和预防中常用的抗生素药物, 设计相关耐药基因的检测引物, 对鼠疫流行较为严重的西藏自治区(西藏)鼠疫自然疫源地分离的鼠疫菌进行耐药基因及耐消毒剂基因分析, 以全面了解该鼠疫自然疫源地分离的野生鼠疫菌的耐药情况, 为鼠疫治疗提供指导性建议。
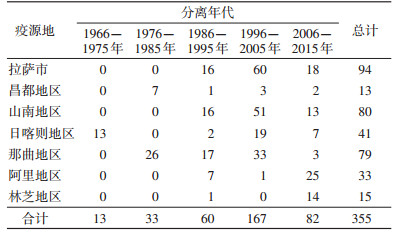
1 材料与方法 1.1 材料 1.1.1 供试菌株耐药基因StrA、StrB、TEM、CTX-M、Sul1、Sul2和QacEdeltal-sul1的阳性模板DNA(A1234)由中国CDC传染病预防控制所鼠疫室馈赠。被试菌株为1966-2015年分离自西藏鼠疫自然疫源地的355株鼠疫菌(表 1), 由青海省地方病预防控制所鼠疫预防控制科保存。
|
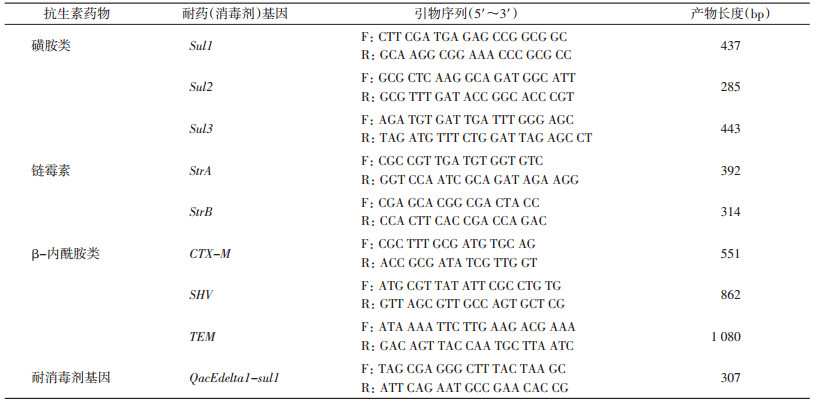
参照美国国立生物技术信息中心公布的耐氨基糖苷类链霉素StrA、StrB基因, 耐β-内酰胺类抗生素药物TEM、SHV和CTX-M基因, 耐磺胺类药物Sul1、Sul2和Sul3基因序列, 耐消毒剂QacEdeltal-sul1基因序列, 分别设计引物, 见表 2。引物由生工生物工程(上海)股份有限公司合成。
PCR扩增仪(型号: MastercyclerproS, 德国Eppendorf公司); 凝胶成像仪(型号:GBOX-F3l, 英国SYNGENE公司); 超微量核酸蛋白测定仪(型号:NaNovuel, 英国通用电气); 多用电泳仪(型号:DYY-12, 北京六一仪器厂)。Taq DNA聚合酶、dNTPs、DL2000和琼脂糖均购自北京欣经科生物技术有限公司。
1.2 方法 1.2.1 鼠疫菌DNA的提取细菌染色体DNA的提取按照常规十二烷基硫酸钠(SDS)裂解及酚-氯仿抽提方法进行[3]。利用超微量核酸蛋白测定仪测定DNA含量, DNA终浓度稀释至0.002 μg/μl。
1.2.2 PCR扩增以鼠疫菌DNA为模板, 应用9对引物逐一进行扩增, 设阳性对照和阴性对照。PCR反应体系:10×Buffer 5.0 μl, 10 mmol/L dNTP 0.2 μl, 5 U/μl Taq DNA聚合酶0.5 μl, 2 μmol/L引物对1.0 μl, 模板DNA(0.002 μg/μl)5.0 μl, 用去离子水补足至25.0 μl。PCR扩增条件:95 ℃预变性4 min; 95 ℃变性40 s, 56 ℃退火40 s, 72 ℃延伸40 s, 30个循环; 72 ℃终延伸4 min。因SHV、TEM基因2对引物的产物较长, 延伸时间延长为70 s, 其他条件不变。取PCR产物7.5 μl进行2%琼脂糖凝胶电泳, 电压为80~100 V, 电泳15~30 min, 结束后将胶置于凝胶成像系统拍照并记录。
2 结果PCR扩增结果显示, 阴性对照和阳性对照均成立, 所测菌株DNA在目的基因处均未出现条带, 尚未发现具有链霉素、磺胺类药物及β-内酰胺类抗生素药物的耐药基因及耐消毒剂菌株, 见图 1。拉萨市、昌都地区、山南地区、日喀则地区、那曲地区、阿里地区和林芝地区检测菌株数分别为94、13、80、41、79、33和15株, 均未检出耐药基因及耐消毒剂鼠疫菌。

|
| 注:M.Marker DNA分子质量标准; 1~22.部分菌株扩增结果; -.阴性对照; +.阳性对照 图 1 西藏鼠疫自然疫源地部分鼠疫菌PCR扩增结果 Figure 1 Part of Y.pestis PCR amplification results in natural plague foci in Tibet |
| |
西藏位于我国西南部, 总人口300余万, 是以藏族为主的多民族聚居区, 平均海拔4 000 m, 为青藏高原的主体, 是青藏高原喜马拉雅旱獭(Marmota himalayana)鼠疫自然疫源地的重要组成部分。1901年曾有类似鼠疫疫情流行, 1966-2015年西藏地区共报告人间鼠疫疫情22起, 发病120例, 死亡75例[4]。该地区鼠疫菌具有青藏高原鼠疫病原体特性, 人类感染鼠疫菌后具有发病急、病情重、传染性强及病死率高等特点[5]。目前, 西藏鼠疫自然疫源地总面积达257 800 km2, 占全区总面积的21%[6], 是我国乃至世界鼠疫流行最为活跃的地区之一[7]。本研究所测355株鼠疫菌经检测均为阴性, 说明西藏鼠疫自然疫源地1966-2015年分离的野生鼠疫菌株未携带耐链霉素、磺胺类药物及β-内酰胺类抗生素药物耐药基因, 链霉素等抗生素药物仍可用于鼠疫的临床治疗。王国钧等[8]通过大量动物实验筛选出新型抗生素(环丙沙星和头孢曲松钠)应用于鼠疫临床, 以应对鼠疫耐药菌株。在今后鼠疫防治工作中可适当储备这些抗生素药物以防不时之需。此外, 本实验未检测到耐消毒剂基因, 但近年来已将季胺盐类(苯扎溴胺)、双胍类(氯已定)消毒剂纳入鼠疫防护用品并在实验中得以应用[9]。因此, 鼠疫菌耐消毒剂基因的检测亦应引起重视。
3.2 鼠疫耐药性菌株流行情况细菌耐药性是世界性难题, 1995年Galimand等[10]首次报道第1株多重耐药鼠疫菌(17/95), 该菌株含有自转移质粒(pIP1202), 大小约150 kb, 属Inc6-C群, pIP1202所携带的耐药基因有SHV1、StrA、StrB、aadA、aphA、tetRA、cat、QacEdeltal、Sul1、Sul2, 其耐药表型为氨苄西林、氯霉素、链霉素、磺胺类药物、四环素、壮观霉素和卡那霉素。2001年Guiyoule等[11]在马达加斯加报道了1株质粒介导的对链霉素具有高抗性的鼠疫菌株(16/95), 该菌株所携带的自转移质粒(pIP1203)大小约40 kb, pIP1203属IncP群, 该质粒仅携带StrA、StrB耐药基因, 可高频结合到其他鼠疫菌, 这2株耐药菌株提示, 自然条件下携带耐药基因的质粒可整合到鼠疫菌。
3.3 鼠疫耐药性菌株产生机制2株耐药鼠疫菌株分离自马达加斯加的2个不同区域、相距80 km的不同患者; 其中17/95鼠疫菌株属B基因型, 16/95鼠疫菌株则属于马达加斯加特有的Q基因型; 17/95鼠疫菌株携带质粒pIP1202大小约150 kb, 属Inc6-C群, 带有多种耐药基因, 而16/95鼠疫菌株所携带的质粒pIP120316/95大小约40 kb, 属IncP群, 该质粒仅携带StrA、StrB耐药基因; 鼠疫菌株17/95链霉素的耐药性产生为腺苷酰化作用, 而16/95为磷酸化作用。故2株鼠疫菌耐药性的产生独立无关联[10]。2株鼠疫耐药菌株产生耐药的质粒来源不明确, 推测最初质粒结合发生于鼠或人体内[11-14]。基因交换比较罕见, 在同时感染鼠疫菌和另一个入侵的携带耐药质粒的供体细菌, 且供体菌和受体菌间密切接触的条件下, 基因交换才能产生, 但在跳蚤体内将携带耐药质粒的大肠埃希菌(Escherichia coli)和鼠疫菌先后感染后, 3 d后鼠疫菌携带转移结合子耐药质粒[15]。该实验模型表明, 随着其他越来越多的耐药菌株的产生, 西藏鼠疫自然疫源地尚无耐药鼠疫菌株的报道, 但质粒易整合到鼠疫菌染色体组[16], 故鼠疫菌出现耐药性有其必然性。
| [1] |
Galimand M, Carniel E, Courvalin P. Resistance of Yersinia pestis to antimicrobial agents[J]. Antimicrob Agents Chemother, 2006, 50(10): 3233-3236. DOI:10.1128/AAC.00306-06 |
| [2] |
Carraro N, Matteau D, Luo P, et al. The master activator of incA/C conjugative plasmids stimulates genomic islands and multidrug resistance dissemination[J]. PLoS Genet, 2014, 10(10): e1004714. DOI:10.1371/journal.pgen.1004714 |
| [3] |
Li YJ, Dai EH, Cui YJ, et al. Different region analysis for genotyping Yersinia pestis isolates from China[J]. PLoS One, 2008, 3(5): e2166. DOI:10.1371/journal.pone.0002166 |
| [4] |
赵宏群, 占堆, 阮水良, 等. 西藏自治区2009-2011年鼠疫耶尔森菌分离株的生化特征[J]. 中国媒介生物学及控制杂志, 2017, 28(2): 175-176, 187. DOI:10.11853/j.issn.1003.8280.2017.02.021 |
| [5] |
杨晓艳, 辛有全, 魏柏青, 等. 西藏藏南地区新增疫源县鼠疫菌病原学分析及流行病学意义[J]. 中华地方病学杂志, 2015, 34(4): 247-249. DOI:10.3760/cma.j.issn.2095-4255.2015.04.005 |
| [6] |
麻占军, 蒋志勇. 西藏自治区1966-2012年人间鼠疫流行病学分析[J]. 中国地方病防治杂志, 2013, 28(2): 119-122. |
| [7] |
西绕若登, 李景中, 洛桑群增, 等. 西藏鼠疫流行现状与青藏铁路沿线鼠疫预防控制对策[J]. 中国地方病防治杂志, 2008, 23(3): 198-200. |
| [8] |
王国钧, 李敏, 郑谊, 等. 环丙沙星治疗家兔实验感染鼠疫疗效观察[J]. 中国地方病学杂志, 2005, 24(5): 564-565. |
| [9] |
卫生部应急办公室. 鼠疫防控应急手册[M]. 北京: 北京大学医学出版社, 2009, 142.
|
| [10] |
Galimand M, Guiyoule A, Gerbaud G, et al. Multidrug resistance in Yersinia pestis mediated by a transferable plasmid[J]. N Engl J Med, 1997, 337(10): 677-681. DOI:10.1056/NEJM199709043371004 |
| [11] |
Guiyoule A, Gerbaud G, Buchrieser C, et al. Transferable plasmid-mediated resistance to streptomycin in a clinical isolate of Yersinia pestis[J]. Emerg Infect Dis, 2001, 7(1): 43-48. DOI:10.3201/eid0701.010106 |
| [12] |
Chanteau S, Ratsitorahina M, Rahalison L, et al. Current epidemiology of human plague in Madagascar[J]. Microbes Infect, 2000, 2(1): 25-31. DOI:10.1016/S1286-4579(00)00289-6 |
| [13] |
Dennis DT, Hughes JM. Multidrug resistance in plague[J]. N Engl J Med, 1997, 337(10): 702-704. DOI:10.1056/NEJM199709043371010 |
| [14] |
Welch TJ, Fricke WF, McDermott PF, et al. Multiple antimicrobial resistance in plague:an emerging public health risk[J]. PLoS One, 2007, 2(3): e309. DOI:10.1371/journal.pone.0000309 |
| [15] |
Hinnebusch BJ, Rosso ML, Schwan TG, et al. High-frequency conjugative transfer of antibiotic resistance genes to Yersinia pestis in the flea midgut[J]. Mol Microbiol, 2002, 46(2): 349-354. DOI:10.1046/j.1365-2958.2002.03159.x |
| [16] |
Wagner DM, Runberg J, Vogler AJ, et al. No Resistance plasmid in Yersinia pestis, North America[J]. Emerg Infect Dis, 2010, 16(5): 885-887. DOI:10.3201/eid1605.090892 |
 2018, Vol. 29
2018, Vol. 29