扩展功能
文章信息
- 刘丽娟, 胡颖新, 李亚平, 程鹏, 郭秀霞, 公茂庆
- LIU Li-juan, HU Ying-xin, LI Ya-ping, CHENG Peng, GUO Xiu-xia, GONG Mao-qing
- 中华按蚊雌成蚊体内海藻糖及海藻糖酶含量变化的研究
- Dynamic changes of trehalose and trehalase in female Anopheles sinensis Wiedemann (Diptera: Culicidae)
- 中国媒介生物学及控制杂志, 2018, 29(1): 50-52
- Chin J Vector Biol & Control, 2018, 29(1): 50-52
- 10.11853/j.issn.1003.8280.2018.01.013
-
文章历史
- 收稿日期: 2017-09-22
- 网络出版时间: 2017-12-12 11:34
2 山东省金乡县农业局, 山东 金乡 272200
2 Jinxiang County Bureau of Agriculture
中华按蚊(Anopheles sinensis)是我国平原地区疟疾的主要传播媒介,分布范围广,除青海省和新疆维吾尔自治区外均有分布[1-2]。蚊幼虫的主要孳生场所为稻田、苇塘、灌溉沟和有水草的缓流等[3]。中华按蚊为半家栖性蚊种,成蚊在羽化3 d左右吸血,偏嗜畜血兼吸人血[4],吸血活动属黄昏型,不同地区中华按蚊的活动习性和季节消长差异很大,受温度、降雨量和耕作方式等影响。
海藻糖是由2个葡萄糖分子以α,α-1,1糖苷键连接的一种非还原性双糖,广泛存在于除哺乳动物外的高等或低等生物体内[5]。昆虫是动物界中最早发现有海藻糖的物种,海藻糖占昆虫血淋巴糖类的80%~90%[6],是其重要的能量储备物质,同时参与多种生理功能,在生物能量代谢和抗逆等方面具有重要作用,尤其在低温环境中,海藻糖可以在细胞表面形成保护膜,避免蛋白质分子变性失活,从而维持昆虫的生命过程和生物特征[7-9]。海藻糖酶是昆虫体内水解海藻糖的唯一酶,也是滞育激素调控代谢的关键酶,在昆虫的滞育越冬中发挥重要作用。研究中华按蚊成蚊体内海藻糖和海藻糖酶的含量变化,有助于了解其生理发育状态及其对不良环境的适应机制,为其抗寒性研究提供数据支持。
1 材料与方法 1.1 试虫中华按蚊敏感品系引自江苏省血吸虫病防治研究所,由山东省寄生虫病防治研究所蚊虫饲养室传至11代。饲养温度为蚊幼虫(28±1)℃,成蚊(26±1)℃;相对湿度约75%,光照周期(L:D)=14 h:10 h。在水体表面撒播酵母粉饲养1、2龄蚊幼虫,以酵母粉和猪肝粉的底饲料饲喂3、4龄蚊幼虫。成蚊羽化3 d后放入固定的小白鼠供其吸血。实验用中华按蚊为羽化1~3 d的雌成蚊及吸血产卵后的雌蚊。
1.2 仪器与试剂酶标分析仪Rayto RT-6100;昆虫海藻糖和海藻糖酶ELISA检测试剂盒(上海酶联生物科技有限公司)。试剂盒主要包括:标准品1.8 ml,酶标试剂10 ml,样品稀释液、显色剂A液、显色剂B液、终止液各6 ml,20倍浓缩洗涤液25 ml。
1.3 方法 1.3.1 海藻糖含量测定随机挑选不同羽化时间的中华按蚊各5只,称取重量,加入一定量的PBS溶液(pH 7.4),用匀浆器将标本匀浆充分。离心半径13.5 cm、3 000 r/min离心20 min,取上清液,分装后冷冻备用。每个处理重复5次。操作步骤如下:(1)标准品加样:设置标准品孔和样本孔,标准品孔各加不同浓度的标准品50 μl。(2)加样:分别设空白孔、待测样品孔。在酶标包被板上待测样品孔中先加样品稀释液40 μl,再加待测样品10 μl。将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀。(3)加酶:每孔加入酶标试剂100 μl,空白孔除外。(4)温育:用封板膜封板后置37 ℃温育60 min。(5)配液:将20倍浓缩洗涤液用蒸馏水20倍稀释后备用。(6)洗涤:小心撕掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30 s后弃去,重复5次,拍干。(7)显色:每孔先加入显色剂A 50 μl,再加入显色剂B 50 μl,轻轻振荡混匀,37 ℃避光显色15 min。(8)终止:每孔加终止液50 μl,终止反应。(9)测定:以空白孔调零,450 nm波长依序测量各孔A值。
1.3.2 海藻糖酶含量测定海藻糖酶测定方法同海藻糖。
1.4 统计学处理利用SPSS 11.5软件对数据进行处理。海藻糖及海藻糖酶含量经单因素方差分析后,用Tukey多重比较方法进行显著性分析。P<0.05为差异有统计学意义。
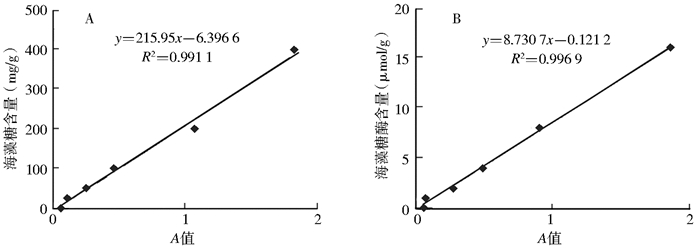
2 结果中华按蚊雌成蚊体内海藻糖(y=215.95x-6.396 6,R2=0.991 1)和海藻糖酶(y=8.730 7x-0.121 2,R2=0.996 9)含量标准曲线拟合较好(图 1)。海藻糖含量在中华按蚊雌蚊羽化后第2天最高,达(2.658 5±0.116 5)mg/g,产卵前雌蚊体内海藻糖含量高于产卵后,不同羽化时间、产卵前后雌成蚊体内海藻糖含量差异有统计学意义(F=21.383,df=100,P<0.05)。中华按蚊吸血前后体内海藻糖酶含量随羽化时间延长逐渐增加,吸血产卵后降低,不同羽化时间、产卵前后雌成蚊体内海藻糖酶含量差异有统计学意义(F=25.592,df=100,P<0.05),见表 1。
|
| 图 1 中华按蚊雌成蚊海藻糖(A)和海藻糖酶(B)的标准曲线 Figure 1 The standard curve diagram of the trehalose(A) and trehalase(B) contents of female An. sinensis |
| |
 |
昆虫体内海藻糖含量变化受自身发育及温度、湿度、寄生虫感染等因素的影响。海藻糖是能量储备物质,在抵抗环境压力方面具有重要作用,通过对越冬滞育昆虫体内的海藻糖含量变化进行研究,发现海藻糖的累积与昆虫的抗寒性密切相关[10-12]。另有报道海藻糖含量影响冈比亚按蚊(An. gambiae)传播疟疾能力[13]。本研究发现中华按蚊体内海藻糖和海藻糖酶含量在羽化后均有明显变化,随着羽化时间的延长其含量先增加后减少,吸血产卵后,成蚊体内海藻糖和海藻糖酶含量均低于吸血前,该现象在其他生物中也存在[14],可能与能量的积累与消耗有关。今后应对中华按蚊体内海藻糖含量与抵抗极端环境能力的关系进行深入研究。
| [1] |
陆宝麟. 中国动物志.昆虫纲.第9卷.双翅目:蚊科(下卷)[M]. 北京: 科学出版社, 1997, 31-34.
|
| [2] |
王海防, 王怀位, 程鹏, 等. 中华按蚊偏嗜血行为的实验观察[J]. 中国寄生虫学与寄生虫病杂志, 2014, 32(6): 459-461. |
| [3] |
董学书, 周红宁, 龚正达. 云南蚊类志[M]. 昆明: 云南科技出版社, 2010, 144-146.
|
| [4] |
张崇星, 程鹏, 王海防, 等. 中华按蚊吸血趋性和吸血前后活动情况的观察[J]. 中国病原生物学杂志, 2014, 9(3): 216-219. |
| [5] |
Becker A, Schl-der P, Steele JE, et al. The regulation of trehalose metabolism in insects[J]. Experientia, 1996, 52(5): 433-439. DOI:10.1007/BF01919312 |
| [6] |
Thompson SN. Trehalose-the insect 'blood' sugar[J]. Adv Insect Physiol, 2003, 31: 205-285. DOI:10.1016/S0065-2806(03)31004-5 |
| [7] |
Crowe JH, Carpenter JF, Crowe LM, et al. Are freezing and dehydration similar stress vectors-A comparison of modes of interaction of stabilizing solutes with biomolecules[J]. Cryobiology, 1990, 27(3): 219-231. DOI:10.1016/0011-2240(90)90023-W |
| [8] |
Jain NK, Roy I. Effect of trehalose on protein structure[J]. Protein Sci, 2009, 18(1): 24-36. |
| [9] |
Williams WP. Cold-induced lipid phase transitions[J]. Philos Trans R Soc Lond B Biol Sci, 1990, 326(1237): 555-567. DOI:10.1098/rstb.1990.0031 |
| [10] |
李兴鹏, 宋丽文, 张宏浩, 等. 蠋蝽抗寒性对快速冷驯化的响应及其生理机制[J]. 应用生态学报, 2012, 23(3): 791-797. |
| [11] |
任小云, 张礼生, 齐晓阳, 等. 滞育七星瓢虫的代谢适应与抗寒性评价[J]. 环境昆虫学报, 2015, 37(6): 1195-1202. |
| [12] |
朱昱翰, 李庆, 杨刚, 等. 低温和光周期对西藏飞蝗体内物质的影响[J]. 应用生态学报, 2016, 27(2): 629-633. |
| [13] |
Liu K, Dong YM, Huang YZ, et al. Impact of trehalose transporter knockdown on Anopheles gambiae stress adaptation and susceptibility to Plasmodium falciparum infection[J]. Proc Natl Acad Sci USA, 2013, 110(43): 17504-17509. DOI:10.1073/pnas.1316709110 |
| [14] |
郑微, 胡清秀, 张瑞颖, 等. 刺芹侧耳发育过程中海藻糖含量及影响因子[J]. 食用菌学报, 2014, 21(3): 18-22. |
 2018, Vol. 29
2018, Vol. 29

