扩展功能
文章信息
- 李基旭, 宋振海, 朴光明
- LI Ji-xu, SONG Zhen-hai, PIAO Guang-ming
- 吉林省延边地区图们江流域按蚊形态学及基因特征分析
- Species identification of Anopheles mosquitoes from the Tumen river basin in Yanbian area of Jilin province based on morphological and molecular characteristics
- 中国媒介生物学及控制杂志, 2018, 29(1): 42-46
- Chin J Vector Biol & Control, 2018, 29(1): 42-46
- 10.11853/j.issn.1003.8280.2018.01.011
-
文章历史
- 收稿日期: 2017-08-21
- 网络出版时间: 2017-12-12 11:26
2 图们市疾病预防控制中心, 吉林 图们 133100;
3 龙井市疾病预防控制中心, 吉林 龙井 133400
2 Tumen Center for Disease Control and Prevention;
3 Longjing Center for Disease Control and Prevention
按蚊(Anopheles)隶属于双翅目(Diptera)蚊科(Culicidae)按蚊亚科(Anophelinae),全世界记录7个亚属共537种[1];中国分布2个亚属,即按蚊亚属(Anopheles)和塞蚊亚属(Cellia)。《中国动物志》记载了59种(亚种)按蚊[2]。2008年文献[3]共记录61种(亚种)。按蚊可传播疟疾等传染病,其在蚊媒传染病流行病学及制定防制对策方面有重要医学地位,尤其是按蚊属赫坎按蚊种团(An. hyrcanus group)中的中华按蚊(An. sinensis)、雷氏按蚊(An. lesteri)、暗灰按蚊(An. pullus)和克莱按蚊(An. kleini),已被确定为传疟蚊种。据我国学者现场调查,雷氏按蚊传播疟疾的媒介能量较中华按蚊高6.2~34.4倍[4-5]。按蚊属赫坎蚊种团广泛分布于古北界和东洋界,东起日本,西至地中海和里海,北起俄罗斯、南至印度、印度尼西亚和菲律宾[6]。吉林省延边朝鲜族自治州(延边州)地处中国、朝鲜、俄罗斯三国交界,位于41°59′47″~44°30′42″N和127°27′43″~131°18′33″E之间,东与俄罗斯滨海区接壤,南隔图们江与朝鲜咸镜北道、两江道相望,边境线总长755.2 km,中国-朝鲜边境线522.5 km,中国-俄罗斯边境线232.7 km,其自然环境和气候条件较适合蚊虫孳生繁殖。因此,在延边州边境地区开展传染病媒介生物调查研究,对边境传染病的预警防治有重要意义。
目前,通常采用形态学分类方法对按蚊进行分类,但对于形态上相似的近缘按蚊种类可能存在分类鉴定错误等问题。研究表明,按蚊核糖体DNA(Ribosomal DNA,rDNA)第2内转录间隔区(second internal transcribed spacer,ITS2)序列和28S第3编码区(Third domain,D3)部分片段的序列在种内保守、种间具有良好的解析度,是按蚊客观、可靠的鉴别特征[7-8]。因此,可利用按蚊分子生物学鉴定方法作为其形态学鉴定的有效补充。为更好地解决传统按蚊鉴定工作中存在的问题,借鉴韩国国立保健院(KNIH)提供的按蚊核酸分子分类生物学鉴定方法,结合分子生物学技术,以按蚊形态学特征为基础,对不同按蚊ITS2序列进行扩增分析,研究快速、有效的按蚊种类鉴定方法。同时以按蚊分子鉴定结果为依据,采用从分子生物学到形态学的反向分类学方法[9],经过反复对比,掌握了单纯形态学分类方法无法准确鉴定的近缘按蚊和本地新纪录按蚊的形态特征,填补了形态学鉴定的空白,为媒介生物监测提供了理论依据。
1 材料与方法 1.1 采集地点吉林省延边州图们市月晴镇、曲水镇和龙井市开山屯镇3个边境村大型养殖场。
1.2 监测方法于2012-2013年5-10月,每个监测点放置诱蚊灯2个。自日落后20 min开始,天亮前收灯。每月监测2次,两次监测相隔15 d。
1.3 样品保存和分类现场采集到的蚊虫送回实验室冷冻处死后自然干燥保存和冷冻保存。参照《中国动物志》[10]和文献[11]对雌性按蚊进行分类。
1.4 DNA检测方法 1.4.1 样品前处理挑选按蚊雌成虫放入1.5 ml离心管中,每管1~15只,加600 μl PBS溶液。研磨时每只离心管放入2颗ϕ2 mm经高压灭菌的玻璃珠进行研磨(GIAGEN TissueLyserⅡ),程序设定为20次/s,共20 s,间隔20 s再研磨1次,12 470×g离心1 min,取上清液200 μl提取DNA。
1.4.2 DNA提取采用磁珠法。使用核酸提取盒(苏州天隆生物科技有限公司),每孔加入20 μl蛋白酶K,200 μl样品。加样完成后于自动核酸提取仪(西安天隆科技有限公司)按设定的提取程序运行。程序结束后取70 μl核酸作为待测模板。
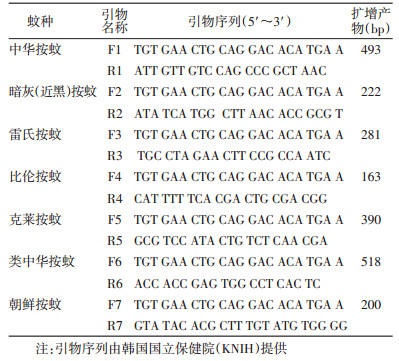
1.4.3 DNA模板扩增对每种按蚊设计特异性引物序列,由生工生物工程(上海)股份有限公司合成引物,用PCR方法进行目标片段扩增(PTC-200),见表 1。
试剂使用BIONEER AccuPower PCR Pre-Mix(BIONEER Corp. Republic of Korea)。第1次反应体系配制为PCR Pre-Mix,加Primer F1 0.5 μl,Primer R1~R5各0.5 μl,样品DNA 3 μl,DW 14 μl,最终反应体系为20 μl,第2次反应体系配制为PCR Pre-Mix,加Primer F1 0.5 μl,Primer R6~R7各0.5 μl,样品DNA 3 μl,DW 15.5 μl,最终反应体系为20 μl。反应条件为94 ℃反转录10 min,1个循环;94 ℃变性30 s,60 ℃退火60 s,72 ℃延伸60 s,30个循环;72 ℃延伸5 min,1个循环。扩增产物用2.0%琼脂糖凝胶电泳,分子质量标准采用DNA 100 bp Marker(TaKaRa)。
1.4.4 基因组序列测定和同源性分析将PCR阳性扩增产物送至生工生物工程(上海)股份有限公司进行双向测序(ABI 3730型DNA测序仪),并使用DNAStar软件进行拼接和校正。将得到的序列与GenBank中按蚊核酸碱基序列进行同源性分析。
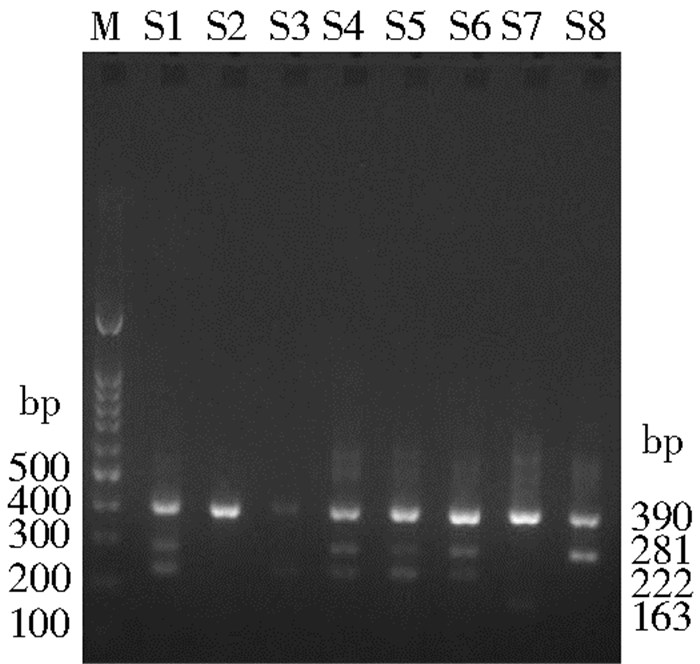
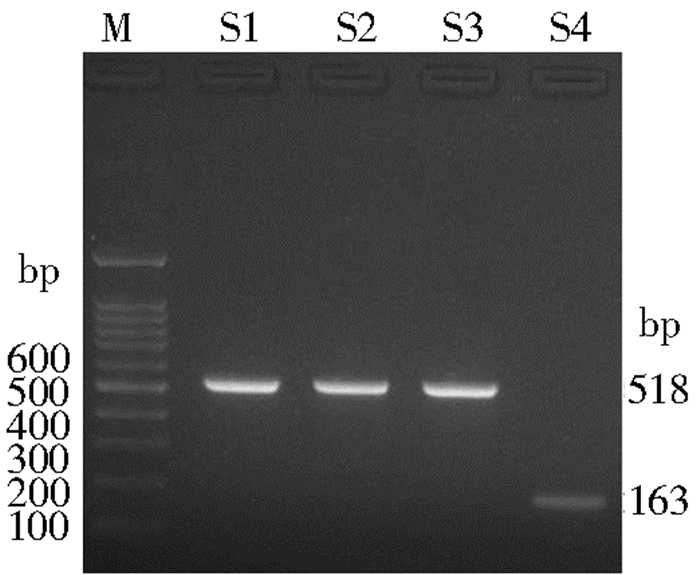
2 结果 2.1 分子生物学鉴定结果2012-2013年采集4 276只按蚊制成干性标本,分为300个组进行核酸检测(图 1、2)。结果发现,延边地区图们江流域主要按蚊种为类中华按蚊(An. sineroides)、克莱按蚊、比伦按蚊、暗灰按蚊(近黑按蚊)、雷氏按蚊,未检测到中华按蚊和朝鲜按蚊,见表 2。
|
| 注:M. Marker 100 bp;S1~S8.实验样品;163 bp.比伦按蚊;222 bp.暗灰(近黑)按蚊;281 bp.雷氏按蚊;390 bp.克莱按蚊 图 1 延边地区图们江流域部分按蚊rDNA ITS2基因扩增结果 Figure 1 The results of partial Anopheles rDNA ITS2 gene amplification from the Tumen river basin in Yanbian area |
| |
|
| 注:M. Marker 100 bp;S1~S4.实验样品;163 bp.比伦按蚊;518 bp.类中华按蚊 图 2 延边地区图们江流域部分按蚊rDNAITS2基因扩增结果 Figure 2 The results of partial Anopheles rDNA ITS2 gene amplification from the Tumen river basin in Yanbian area |
| |
 |
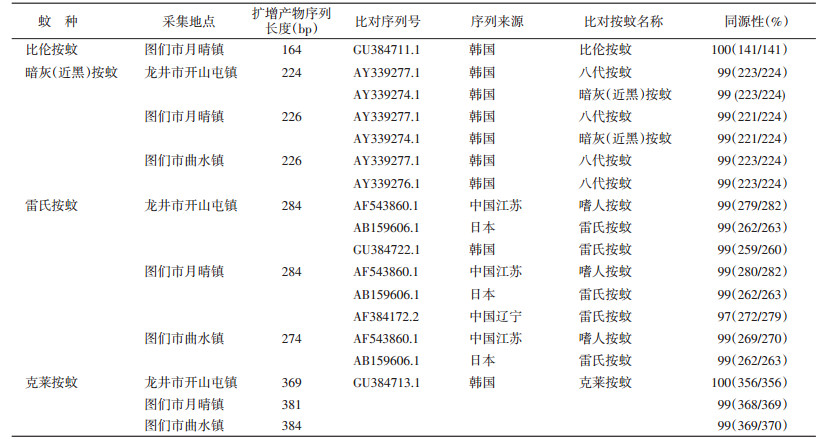
对获得的按蚊ITS2序列通过BLAST(http://blast.ncbi.nlm.nih.gov/Blast.cgi)与GenBank数据库中不同来源的默认按蚊序列进行对比分析。比伦按蚊与韩国发现的比伦按蚊(GU384711.1)同源性达100%。暗灰按蚊与韩国发现的暗灰按蚊同源性达99%,同时与韩国登记的八代按蚊同源性达99%。雷氏按蚊与日本、韩国发现的雷氏按蚊同源性达99%,与中国江苏省发现的雷氏按蚊同源性达99%。克莱按蚊与韩国发现的克莱按蚊同源性达99%~100%,见表 3。
 |
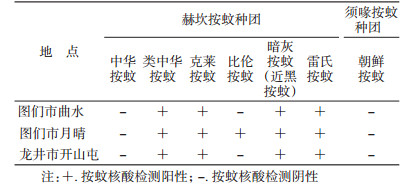
挑选具有明显形态特征的部分按蚊冷冻标本分16个组再进行分子生物学鉴定。根据鉴定结果,反复研究其形态特征,总结其形态学分类要点,见图 3。

|
| 注:A.克莱按蚊翅白斑;1.前缘脉有亚缘脉白斑;2.亚尖端白斑比亚缘脉白斑短或等长,亚尖端白斑有时呈点状或缺失;3.有明显的尖端白斑;4.翅5.2纵脉有末端繸斑且较长。B.暗灰(近黑)按蚊翅白斑形态;1.前缘脉有亚缘脉白斑,亚缘脉白斑明显比亚尖端白斑短;2.有明显的亚尖端白斑;3.尖端白斑缺失或不明显;4.翅5.2纵脉末端有繸斑但不明显。C.雷氏按蚊翅白斑;1.前缘脉有亚缘脉白斑;2.亚尖端白斑和亚缘脉白斑几乎等长;3.有明显的尖端白斑;4.翅5.2纵脉末端繸斑缺失 图 3 克莱按蚊(A)、暗灰(近黑)按蚊(B)和雷氏按蚊(C)翅白斑形态特征 Figure 3 The morphological features of the white spots of the An. kleini, An. pullus, and An. lesteri wings |
| |
目前,传统按蚊形态学分类方法具有操作简单等特点而常用于蚊虫鉴定,但较多按蚊存在隐形种或种内形态变异,故单纯的形态学方法已无法满足对按蚊的分类需求。鉴于此,按蚊分子生物学特征作为按蚊鉴别的重要依据已在多个复合体或种团中应用,为确认其分类地位起关键作用[12]。本研究综合应用形态学鉴定和分子生物学鉴定两种方法对按蚊种类进行鉴定,明确了吉林省延边州图们江流域部分按蚊蚊种,确定了新纪录种和近缘种形态特征,为今后有针对性地进行边境地区蚊虫防制及相关疾病预警预测奠定了基础。
本研究对符合形态学特点的中华按蚊、暗灰按蚊和雷氏按蚊进行ITS2区段PCR扩增和碱基序列同源性分析发现,暗灰按蚊和雷氏按蚊分子生物学鉴定结果与形态学鉴定结果基本一致。但形态学鉴定结果为中华按蚊的经ITS2区段PCR扩增和所测序列同源性分析结果均为克莱按蚊,无中华按蚊的证据显示。比伦按蚊与克莱按蚊为2005年在韩国记录的中华按蚊近缘新种[13],随后在我国多地也有发现[9, 14-15]。文献中关于比伦按蚊和克莱按蚊形态学方面描述较少,而类中华按蚊和朝鲜按蚊有明确的形态学鉴定描述。本研究的类中华按蚊、比伦按蚊和克莱按蚊在缺少形态学鉴定结果的情况下仅通过ITS2区段PCR扩增发现。此次形态学和分子生物学鉴定均未发现朝鲜按蚊。鉴于克莱按蚊缺少形态学相关资料,根据其PCR扩增产物测序结果及同源性分析确定其种类后,逐项总结其形态特征,从而掌握其形态特征分类要点。比伦按蚊因样本量太少未能总结其形态特征,需进一步研究。关于类中华按蚊的形态学和分子生物学鉴定结果的相关性有待深入研究。本研究发现本地雷氏按蚊与中国江苏省发现的嗜人按蚊同源性达99%。国内学者已将嗜人按蚊从分类名表中删除,确认为雷氏按蚊的同物异名,重新订正并恢复使用雷氏按蚊[3, 13, 16-17]。因此,应将本地区原记录种嗜人按蚊订正为雷氏按蚊。据文献资料,比伦按蚊已被订正为新种[13],并作为我国新纪录种[18]。克莱按蚊为2006-2007年在延边州CDC和KNIH在本地区进行蚊种本底调查时首次被发现[19],之前我国未曾报道过,本次调查在本地区首次检测到比伦按蚊。因此,将比伦按蚊和克莱按蚊定为本区域新纪录种。对形态学分类和分子生物学鉴定结果综合分析表明,本地区按蚊优势种为克莱按蚊。在韩国疟疾高发地区克莱按蚊有较多分布[19]。因此,需对克莱按蚊引起高度重视。韩国学者根据八代按蚊形态、染色体和分子特征质疑其分类地位,认为是暗灰按蚊的同物异名[18]。我国部分学者认为,四川和辽宁省的八代按蚊均应订正为暗灰(近黑)按蚊,并为我国新纪录种[13]。在本研究中,利用韩国CDC提供的暗灰按蚊引物扩增出与其形态学特征相符的按蚊特异性条带,所得序列与GenBank中的暗灰按蚊和八代按蚊同源性均达99%。因此,认为八代按蚊是暗灰按蚊的同物异名,应将原八代按蚊订正为暗灰按蚊。
志谢: 本研究得到KNIH媒介昆虫科E-Hyun SHIN博士的技术支持,在此志谢| [1] |
马雅军, 徐建农. 中国按蚊的分类研究进展[J]. 中国媒介生物学及控制杂志, 2015, 26(5): 433-438. DOI:10.11853/j.issn.1003.4692.2015.05.001 |
| [2] |
陆宝麟, 许锦江, 俞渊, 等. 中国动物志.昆虫纲.第9卷.双翅目:蚊科(下卷)[J]. 北京:科学出版社, 1997, 2-113. |
| [3] |
瞿逢伊, 朱淮民. 我国按蚊分类进展和若干蚊种学名的订正[J]. 中国寄生虫学与寄生虫病杂志, 2008, 26(3): 210-216. |
| [4] |
王钊. 疟疾学(下)[M]. 青岛: 青岛海洋大学出版社, 1996, 34-44.
|
| [5] |
郭传坤. 我国嗜人按蚊研究进展[J]. 中国热带医学, 2005, 5(2): 396-398, 384. |
| [6] |
方圆, 施文琦, 张仪. 赫坎按蚊种团(双翅目:蚊科)分类研究进展[J]. 中国寄生虫学与寄生虫病杂志, 2016, 34(6): 565-570. |
| [7] |
Collins FH, Paskewitz SM. A review of the use of ribosomal DNA (rDNA) to differentiate among cryptic Anopheles species[J]. Insect Mol Biol, 1996, 5(1): 1-9. DOI:10.1111/imb.1996.5.issue-1 |
| [8] |
吴静, 马雅军, 马颖. 基于mtDNA和rDNA基因序列的中国按蚊属塞蚊亚属种类的系统发育研究(双翅目:蚊科)[J]. 昆虫学报, 2010, 53(9): 1030-1038. |
| [9] |
林琳, 杨曼尼, 南春燕, 等. 中国部分地区赫坎按蚊种团的分子鉴别研究[J]. 中国媒介生物学及控制杂志, 2013, 24(2): 92-97. |
| [10] |
陆宝麟. 中国动物志.昆虫纲.第8卷.双翅目:蚊科(上、下卷)[M]. 北京: 科学出版社, 1997, 60-113.
|
| [11] |
Lee KW. A revision of the illustrated taxonomic keys to genera and species of female mosquitoes of Korea (Diptera: Culicidae)[C]//5th Medical Detachment, 168 Medical Battalion, 18th Medical Command, U. S. Army, 1998: 40. http://wrbu.si.edu.
|
| [12] |
李石柱, 马雅军. 分子鉴别技术在蚊虫分类中的应用[J]. 国外医学寄生虫病分册, 2004, 31(5): 198-201. |
| [13] |
Rueda LM. Two new species of Anopheles (Anopheles) Hyrcanus Group (Diptera:Culicidae) from the Republic of South Korea[J]. Zootaxa, 2005, 941(1): 1-26. DOI:10.11646/zootaxa.941.1 |
| [14] |
马颖, 马雅军, 孟祥梅, 等. 我国辽宁省赫坎按蚊种团的分子鉴别研究[J]. 寄生虫与医学昆虫学报, 2009, 16(4): 224-227. |
| [15] |
Wang Y, Yu WQ, Shi H, et al. Historical survey of the kdr mutations in the populations of Anopheles sinensis in China in 1996-2014[J]. Malar J, 2015, 14: 120. DOI:10.1186/s12936-015-0644-0 |
| [16] |
Wilkerson RC, Cong L, Rueda LM, et al. Molecular confirmation of Anopheles (Anopheles) lesteri from the Republic of South Korea and its genetic identity with An. (Ano.) anthropophagus from China (Diptera:Culicidae)[J]. Zootaxa, 2003, 378(1): 1-14. DOI:10.11646/zootaxa.378.1 |
| [17] |
Ma YJ, Xu JN. The Hyrcanus Group of Anopheles (Anopheles) in China (Diptera:Culicidae):species discrimination and phylogenetic relationships inferred by ribosomal DNA internal transcribed spacer 2 sequences[J]. J Med Entomol, 2005, 42(4): 610-619. |
| [18] |
Shin EH, Hong HK. A new synonym of Anopheles (Anopheles) pullus Yamada, 1937-A.(A.) yatsushiroensis Miyazaki, 1951[J]. Kor J Entomol, 2001, 31(1): 1-5. |
| [19] |
Shin EH, Lee WG, Chang KS, et al. Black light trap collections in Wangging county and Yanji city, Jilin province, China, August 2006-2007[J]. Entomol Res, 2011, 41(1): 36-38. DOI:10.1111/enr.2011.41.issue-1 |
 2018, Vol. 29
2018, Vol. 29