扩展功能
文章信息
- 孙继民, 鲁亮, 刘可可, 吴海霞, 刘起勇
- SUN Ji-min, LU Liang, LIU Ke-ke, WU Hai-xia, LIU Qi-yong
- 中国发热伴血小板减少综合征病例发病至确诊时间间隔分析研究
- Analytic study on the intervals between illness onset and confirmation of severe fever with thrombocytopenia syndrome cases in China
- 中国媒介生物学及控制杂志, 2018, 29(1): 11-14
- Chin J Vector Biol & Control, 2018, 29(1): 11-14
- 10.11853/j.issn.1003.8280.2018.01.003
-
文章历史
- 收稿日期: 2017-10-10
- 网络出版时间: 2017-12-12 11:34
2 浙江省疾病预防控制中心, 杭州 310051
2 Zhejiang Center for Disease Control and Prevention
发热伴血小板减少综合征(severe fever with thrombocytopenia syndrome,SFTS)是我国学者于2009年首次发现的具有重要公共卫生意义的新发虫媒传染病,由发热伴血小板减少综合征布尼亚病毒(Severe fever with thrombocytopenia syndrome virus,SFTSV)引起,主要通过蜱叮咬传播,人群普遍易感[1-2]。自SFTSV被发现以来,全国已有多数省份报告SFTS病例,且发现病例的地区逐渐扩大,报告病例数也逐年增加,2011-2016年全国共报告5 360例SFTS实验室确诊病例[3]。
SFTS病例的发病至确诊时间间隔对于患者能否获得及时、精准的治疗至关重要。有文献报道,发病至确诊时间间隔越长患者死亡的概率越大[4]。通过收集我国2011-2016年全国SFTS病例资料,分析病例发病至确诊时间间隔及其影响因素。
1 材料与方法 1.1 病例诊断根据国家卫生和计划生育委员会(卫计委)发布的《发热伴血小板减少综合征防治指南(2010版)》中的《发热伴血小板减少综合征诊疗指南》进行病例诊断。
1.2 数据收集从中国疾病预防控制信息系统收集2011-2016年全国所有SFTS确诊病例信息,主要包括性别、年龄、职业、所在省份、发病及确诊时间等。
1.3 统计学处理采用SPSS 20.0软件对不同年份、性别、年龄、职业、季节和省份SFTS病例发病至确诊时间间隔进行描述性分析,并采用Kruskal-Wallis H检验比较不同组病例的发病至确诊时间间隔差异,使用R3.4.0软件绘制不同年份和不同省份的SFTS病例时间间隔频数分布图。P<0.05为差异有统计学意义。
2 结果 2.1 一般情况2011-2016年全国共报告5 360例SFTS确诊病例,来自19个省,所有病例发病至确诊时间间隔的中位数为9 d,四分位数间距为22 d。
2.2 不同年份SFTS病例发病至确诊时间间隔2011-2016年SFTS病例发病至确诊时间间隔的中位数分别为7、6、6、27、10和12 d。2014年时间间隔四分位数间距明显大于其他年份,各年份病例发病至确诊时间间隔差异有统计学意义(H=896.088,P=0.000)。其中2014年病例时间间隔主要分布在60 d内,而其他年份时间间隔主要分布在20 d内,见图 1。
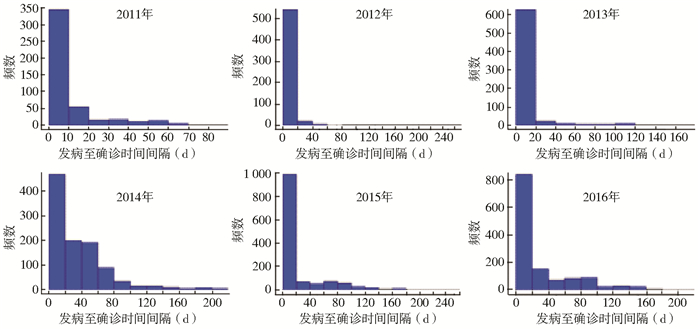
|
| 图 1 2011-2016年SFTS病例发病至确诊时间间隔频数分布 Figure 1 Frequency charts of intervals from illness onset to confirmation of SFTS cases from 2011 to 2016 in China |
| |
男、女性病例发病至确诊时间间隔的中位数均为9 d,差异无统计学意义(H=0.599,P=0.439);农民和其他职业病例时间间隔中位数也均为9 d,但农民病例的四分位数间距大于其他职业病例,两组病例发病至确诊时间间隔比较差异有统计学意义(H=6.426,P=0.011);不同年龄组发病至确诊时间间隔的中位数和四分位数间距类似,差异无统计学意义(H=9.159,P=0.057),见表 1。
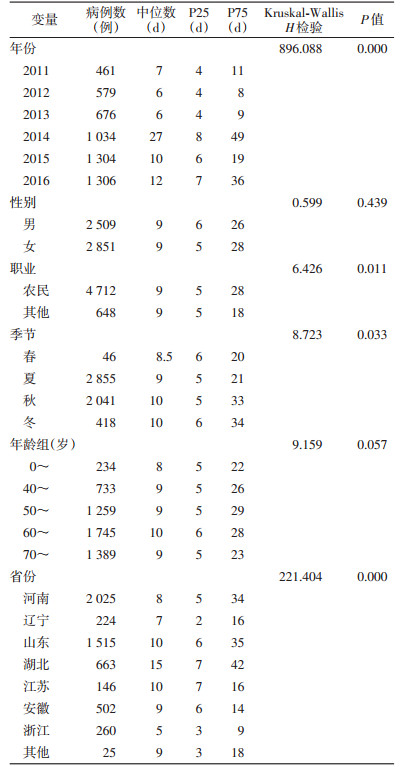 |
不同省份SFTS病例发病至确诊时间间隔比较差异有统计学意义(H=221.404,P=0.000),其中湖北省病例发病至确诊时间间隔中位数最大,浙江省最小(表 1)。河南和浙江省病例发病至确诊时间间隔大多数在10 d之内,辽宁、山东、江苏和安徽省大多数在20 d之内,湖北省大多数则在40 d之内,见图 2。
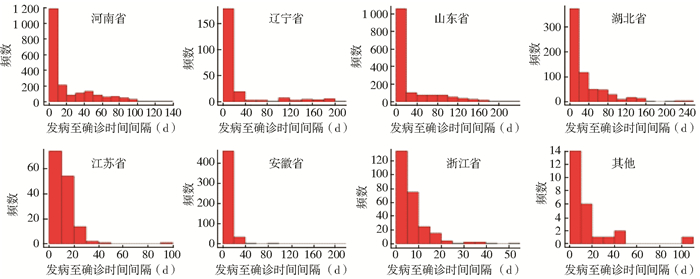
|
| 图 2 不同省份SFTS病例发病至确诊时间间隔频数分布 Figure 2 Frequency charts of intervals from illness onset to confirmation of SFTS cases from different provinces in China |
| |
春季末和夏季为SFTS的主要流行季节,不同季节病例发病至确诊时间间隔差异有统计学意义(H=8.723,P=0.033),其中位数差别较小,但秋、冬季四分位数间距明显大于春、夏季(表 1)。
3 讨论SFTS主要分布在丘陵低海拔山区等植被丰富、气候湿润的农村地区,具有显著的地域性和聚集性,截至2016年全国已有19个省份报告SFTS确诊病例,且发现病例的地区逐渐扩大,除中国外,日本和韩国等国家也发现了SFTS确诊病例[5]。病例发病时间主要在3-11月,高峰期在5-7月。SFTS病死率很高,在发现之初达到30%[1]。2011-2016年确诊病例的平均病死率为6.40%[3],对居民健康和生命安全造成巨大损害。SFTS可通过蜱叮咬、接触患者血液、体液和其他分泌物传播[6-9],甚至在特定条件下可以通过气溶胶传播[10]。
早发现、早诊断、早治疗对于降低传染病的病死率至关重要。有报道发现,SFTS病例发病至确诊时间间隔每延长3 d,其死亡危险度可增加到原来的1.996倍[4]。而时间间隔由发病至就诊和就诊至确诊两部分组成,发病至就诊的时间间隔主要由患者病情及其对SFTS的认知及经济水平决定,就诊至确诊的时间间隔主要取决于医生对SFTS的诊疗能力、医院的实验室检测能力。本研究所有数据来源于中国疾病预防控制信息系统,无法获取每例SFTS患者的就诊时间和就诊路径,故无法分析发病至就诊、就诊至确诊的具体时间间隔和就诊次数。但本研究发现,所有SFTS病例发病至确诊时间间隔的中位数为9 d,说明该时间间隔较长,很可能耽误SFTS治疗的黄金时期,可能是其病死率较高的重要原因。
SFTS病例发病至确诊时间间隔较长,一方面可能因患者对SFTS的认识不足,未充分认识其危害性而未及时就诊;另一方面可能因较多医疗机构的医生对SFTS的诊疗能力较弱,患者就诊时未及时进行临床诊断,且大多数医疗机构不具备SFTSV的检测能力,甚至大多数县(市)级CDC也不具备检测能力,标本最后只能送往省级CDC检测,从而延长了患者发病至确诊的时间间隔。因此,在该病流行季节前应对重点地区加强针对SFTS防治知识的宣传,增强居民对SFTS的防治意识和能力;同时加强对医务人员SFTS诊疗知识的培训,切实提高基层医疗机构对SFTSV的检测能力。
随着SFTS病例数的增多和发病地区的扩散,各地对SFTS的重视程度逐渐提高但还需加强。其中2011-2014年全国SFTS病例发病至确诊时间间隔的中位数呈上升趋势,尤其是2014年达27 d,可能因SFTS病例数较少,部分地区采集SFTS疑似病例血液标本后,集中送至省级CDC,待标本达到一定数量后再集中进行检测,充分说明各地对SFTS的检测能力和重视程度还不够。
不同人群的经济基础、知识水平、各地医疗条件和检测能力及对SFTS的重视程度均影响SFTS发病至确诊的时间间隔。本研究发现,患者中农民SFTS发病至确诊的时间间隔与其他职业患者比较差异有统计学意义,可能与农民经济基础较差、对SFTS的认知有限及医疗条件较差有关,且农民患者数较多。因此,在健康宣传教育时应重点针对农民,同时提高SFTS治疗的医疗保险报销比例,有效做到SFTS的精准防控。2014年由浙江省卫计委正式发文,要求所有市级CDC和报告病例≥3例的县级CDC必须具备SFTSV实验室检测能力,基于基层实验室能力的提高,浙江省SFTS病例发病至确诊的时间间隔显著小于其他省份。
在SFTS流行季节,各地可能会加强SFTS的防控并召开SFTS防控会议,各医疗机构对其敏感性较高,故病例发病至确诊时间间隔会缩短,而在非流行季SFTS病例数较少,医务人员可能认为发生SFTS的可能性较小,故其时间间隔较长。本研究结果也证实了这种可能,春、夏季病例发病至确诊时间间隔的四分位数明显小于秋、冬季,且不同季节SFTS病例发病至确诊时间间隔差异有统计学意义。
综上所述,通过对我国2011-2016年SFTS病例发病至确诊时间间隔及其影响因素进行分析发现,我国SFTS病例发病至确诊时间间隔较长,且不同年份、不同省份、不同人群及不同季节患者间差异有统计学意义,需因地、因时、因人制定不同的防控措施,从而实现对SFTS的精准防控。
| [1] |
Yu XJ, Liang MF, Zhang SY, et al. Fever with thrombocytopenia associated with a novel bunyavirus in China[J]. N Engl J Med, 2011, 364(16): 1523-1532. DOI:10.1056/NEJMoa1010095 |
| [2] |
Ding F, Zhang WY, Wang LY, et al. Epidemiologic features of severe fever with thrombocytopenia syndrome in China, 2011-2012[J]. Clin Infect Dis, 2013, 56(11): 1682-1683. DOI:10.1093/cid/cit100 |
| [3] |
Sun JM, Lu L, Wu HX, et al. The changing epidemiological characteristics of severe fever with thrombocytopenia syndrome in China, 2011-2016[J]. Sci Rep, 2017, 7: 9236. DOI:10.1038/s41598-017-08042-6 |
| [4] |
Sun JM, Gong ZY, Ling F, et al. Factors associated with severe fever with thrombocytopenia syndrome infection and fatal outcome[J]. Sci Rep, 2016, 6: 33175. DOI:10.1038/srep33175 |
| [5] |
马婷, 孙继民, 施旭光, 等. 发热伴血小板减少综合征流行病学研究进展[J]. 中国媒介生物学及控制杂志, 2015, 26(3): 327-329. DOI:10.11853/j.issn.1003.4692.2015.03.031 |
| [6] |
Bao CJ, Guo XL, Qi X, et al. A family cluster of infections by a newly recognized bunyavirus in eastern China, 2007:further evidence of person-to-person transmission[J]. Clin Infect Dis, 2011, 53(12): 1208-1214. DOI:10.1093/cid/cir732 |
| [7] |
Liu Y, Li Q, Hu WF, et al. Person-to-person transmission of severe fever with thrombocytopenia syndrome virus[J]. Vector Borne Zoonotic Dis, 2012, 12(2): 156-160. DOI:10.1089/vbz.2011.0758 |
| [8] |
Gai ZT, Liang MF, Zhang Y, et al. Person-to-person transmission of severe fever with thrombocytopenia syndrome bunyavirus through blood contact[J]. Clin Infect Dis, 2012, 54(2): 249-252. DOI:10.1093/cid/cir776 |
| [9] |
Tang XY, Wu WL, Wang HF, et al. Human-to-human transmission of severe fever with thrombocytopenia syndrome bunyavirus through contact with infectious blood[J]. J Infect Dis, 2013, 207(5): 736-739. DOI:10.1093/infdis/jis748 |
| [10] |
Gong Z, Gu S, Zhang Y, et al. Probable aerosol transmission of severe fever with thrombocytopenia syndrome virus in southeastern China[J]. Clin Microbiol Infect, 2015, 21(12): 1115-1120. DOI:10.1016/j.cmi.2015.07.024 |
 2018, Vol. 29
2018, Vol. 29


