扩展功能
文章信息
- 庄桂芬, 黄振东, 薛志静, 李妍, 张瑞玲, 张忠
- ZHUANG Gui-fen, HUANG Zhen-dong, XUE Zhi-jing, LI Yan, ZHANG Rui-ling, ZHANG Zhong
- 球孢白僵菌CF08株在家蝇成虫间的水平传播实验
- Horizontal transmission of Beauveria bassiana CF08 strain (Hypocreales: Cordycipitaceae) in Musca domestica (Diptera: Muscidae) adults
- 中国媒介生物学及控制杂志, 2017, 28(2): 131-134
- Chin J Vector Biol & Control, 2017, 28(2): 131-134
- 10.11853/j.issn.1003.8280.2017.02.008
-
文章历史
- 收稿日期: 2016-11-07
- 网络出版时间: 2017-02-17 08:52
2 泰山医学院生命科学学院, 山东 泰安 271016
2 Department of Life Science of Taishan Medical University
家蝇(Musca domestica)是重要的媒介生物,可携带多种病原体。有研究表明,蝇类可机械性传播30多种病原体,包括细菌、原虫、病毒、寄生虫卵囊和卵等[1-6]。在养殖场、垃圾场、农贸市场等蝇类孳生严重的区域,其传播病原体的风险更高,因此,需要加强蝇类的防控。随着社会发展和人们环境保护意识的增强,应用生物防治法对蝇类进行控制受到越来越多的重视。在蝇类的生物防治中,可利用的资源有寄生蜂[7]、虫生真菌[8]、细菌[9]及植物精油[10]等。由于白僵菌(Beauveria spp.)致病力强、杀虫谱广,可寄生于15个目149科的700多种昆虫及蜱螨类,为目前世界上研究和应用最多的一种虫生真菌。有关于蝇类的生物防治研究多限于实验室的生物测定或直接使用喷洒白僵菌防治蝇类等[11-12],关于白僵菌在蝇类种群中水平传播能力的研究较少[8],而其水平传播效率直接影响蝇类的生物防治效果。
1 材料与方法 1.1 试虫家蝇系泰山医学院媒介生物学研究室饲养品系,自2005年饲养至今。
1.2 菌株来源球孢白僵菌(Beauveria bassiana)分离于自然感染的家蝇,经形态学初步鉴定为白僵菌,命名为CF08株。
1.3 菌株的分子鉴定白僵菌分子鉴定的特异性引物为ITS4:5′-TCC TCC GCT TAT TGA TAT GC-3′,ITS5:5′-GGA AGT AAA AGT CGT AAC AAG G-3′ [5]。参照文献[13]利用白僵菌分子鉴定特异性引物ITS4对该菌进行鉴定。按照常规真菌DNA提取方法进行菌株总DNA的提取。因球孢白僵菌的孢子难以研磨充分,取样时尽量取菌丝体。白僵菌样品DNA-ITS区域PCR扩增反应体系:DNA模板1.0 μl,ITS4和ITS5各1.0 μl,10×Buffer 3 μl,Taq DNA聚合酶0.5 μl,以超纯灭菌水补充至25 μl。反应条件为95 ℃ 3 min,94 ℃ 1 min,54 ℃ 1 min,72 ℃ 2 min,35个循环,最后72 ℃ 10 min。将PCR扩增产物进行琼脂糖凝胶电泳,检测目的条带,送华大基因公司测序,将测序结果与NCBI基因数据库的基因序列进行比对,确定其种类。
1.4 菌株对雌雄家蝇的致病力取羽化后3 d的雌雄家蝇各30只,分别置于35 cm×35 cm×35 cm的养虫笼中,对每笼家蝇的体表均喷洒浓度为108个/ml的球孢白僵菌孢子悬浊液,然后正常提供食物和水,将养虫笼置于温度为25 ℃、湿度为70%的光照培养箱内,L:D=12 h:12 h条件下进行培养,每天统计每笼家蝇的死亡数,将死亡家蝇置于培养皿内进行保湿培养,长出白僵菌菌丝的记为感染死亡,计算累计感染死亡率。家蝇雌蝇和雄蝇各3笼作为重复。
1.5 感染不同时间家蝇的传染能力家蝇成虫体表喷洒浓度为108个/ml球孢白僵菌孢子后,待其体表自然风干后做好标记,分别于喷洒孢子后0~6 d按40%的比例接入正常蝇笼中,每天分别计数正常成蝇的死亡数,将死亡家蝇置于培养皿内进行保湿培养,长出白僵菌菌丝的记为感染死亡,计算累计感染死亡率。每笼内家蝇总数为30只,每个处理设3笼重复。
1.6 菌株在家蝇种群中的传播能力 1.6.1 菌株在实验室家蝇种群中的传播能力对羽化后3 d的家蝇成虫体表喷洒浓度为108个/ml球孢白僵菌孢子,待其体表干燥后做好标记,分别按10%、20%、40%、60%和80%的比例接入有正常家蝇的养虫笼中,每笼内家蝇均为30只,每天分别计数正常成蝇和喷洒孢子后成蝇的死亡数,将死亡家蝇置培养皿内进行保湿培养,长出白僵菌菌丝的记为感染死亡,计算累计感染死亡率,以接入体表喷洒无菌水的正常家蝇作为对照。
1.6.2 菌株在野外环境家蝇种群中的传播能力为验证球孢白僵菌对蝇类的现场控制作用,在泰安市的垃圾箱和垃圾站分别进行以下处理:①在垃圾箱或垃圾站喷洒浓度为108个/ml的球孢白僵菌孢子;②在垃圾箱或垃圾站周围释放50只喷过浓度为108个/ml的球孢白僵菌孢子的家蝇成虫。
于处理后每天分别在现场周围以捕虫网网捕3网,将捕获蝇类带回实验室单独饲养,死亡家蝇置于培养皿内进行保湿培养,长出白僵菌菌丝的记为感染死亡,每个处理设3个垃圾箱或垃圾站,以另3个距离较远的同类垃圾箱或垃圾站捕获的家蝇作为对照。
1.7 统计学处理使用DPS软件对实验数据进行处理;数据以均数±标准差(x±s)表示,组间两两比较采用t检验,多组间比较采用多重比较。P<0.05为差异有统计学意义。
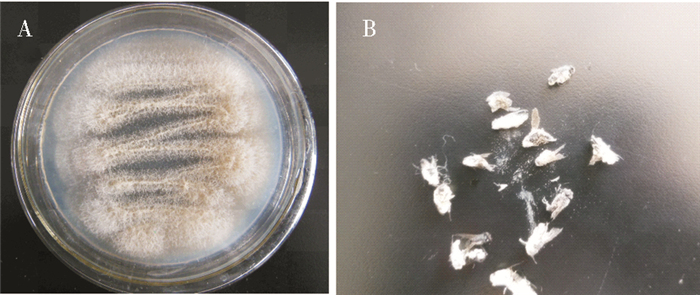
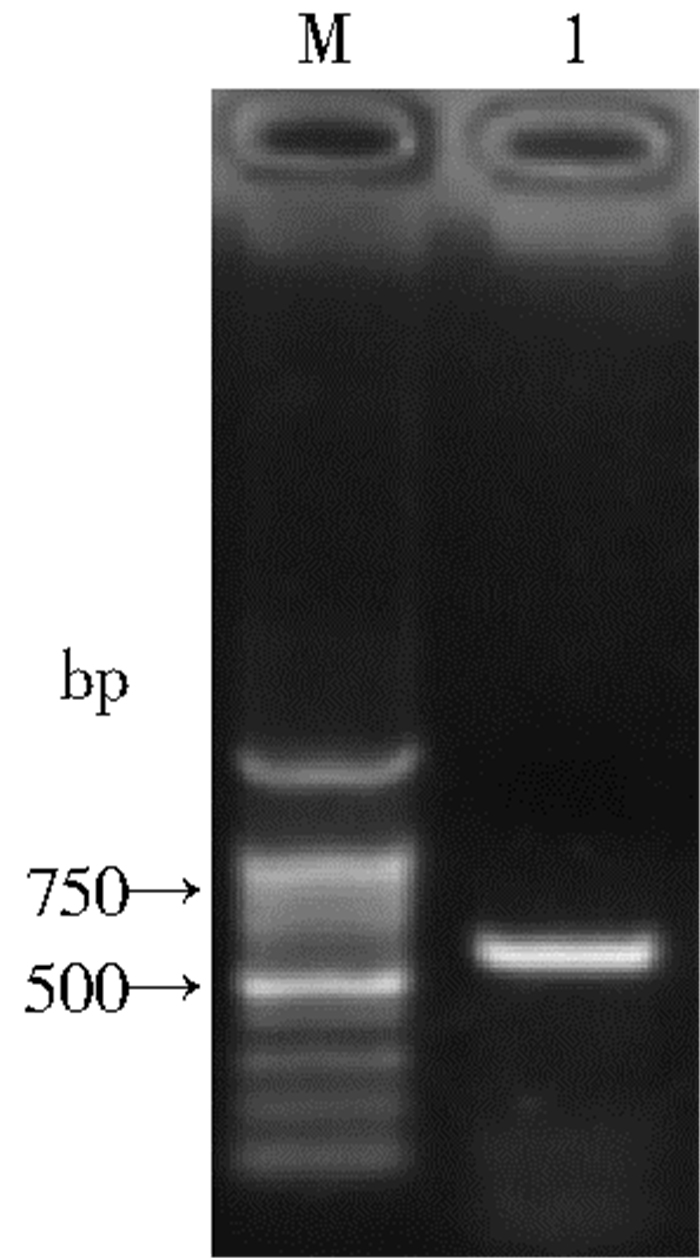
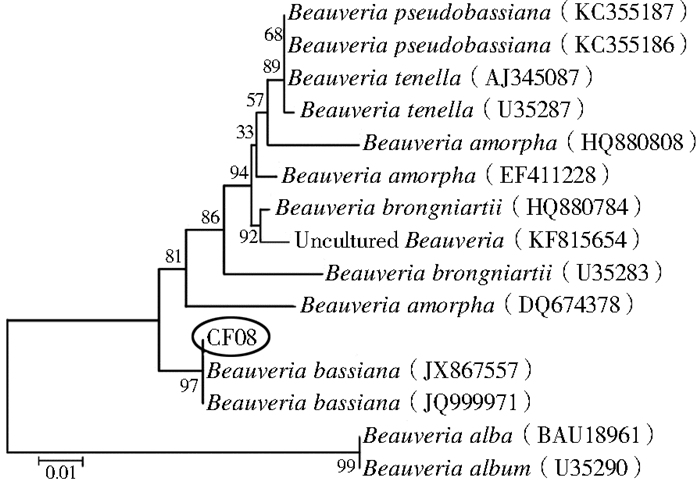
2 结果 2.1 菌株的鉴定自然感染死亡的家蝇经初步形态学鉴定为白僵菌感染,经体外培养后其与白僵菌形态相符,见图 1。提取白僵菌的DNA后利用特异性引物进行扩增,目的片段大小约为600 bp(图 2),经测序比对和构建系统发育树,该菌与球孢白僵菌(JX867557、JQ999971)聚为一支,同源性达97%,故确定为球孢白僵菌,命名为球孢白僵菌CF08株(图 3)。
|
| 图 1 球孢白僵菌CF08株的菌落特征(A)和感染的家蝇(B) Figure 1 Colony characteristics of B. bassiana CF08 strain (A) and the infected M. domestica adults (B) |
| |
|
| 注:M. Marker DL2000;1.菌株ITS序列。 图 2 白僵菌CF08株ITS序列PCR扩增电泳结果 Figure 2 Electrophoretogram results of B. bassiana CF08 strain ITS fragment of B. bassiana CF08 strain ITS sequence |
| |
|
| 图 3 基于球孢白僵菌ITS序列构建的系统发育树 Figure 3 The phylogenetic tree based on B. bassiana CF08 strain ITS sequence |
| |
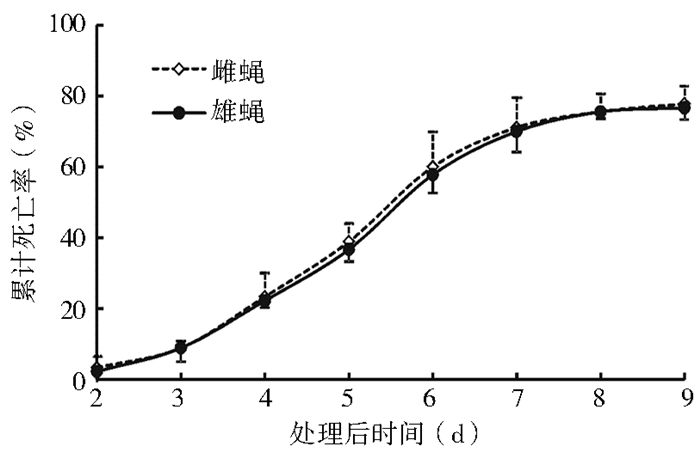
CF08株对家蝇雌雄成虫的致病力在实验室内,球孢白僵菌CF08株对家蝇雌雄成虫的致病力差异无统计学意义(t=1.220,P=0.240),见图 4,后续研究可不再区分雌雄成蝇。
|
| 图 4 球孢白僵菌CF08株对家蝇雌雄成虫的致病力 Figure 4 Pathogenicity of B. bassiana CF08 strain to female and male M. domestica adults |
| |
在实验室条件下,随着感染球孢白僵菌孢子家蝇成虫接入比例的增加,正常家蝇的感染比例及累计死亡率逐渐增加。当携带球孢白僵菌孢子家蝇的接入比例达40%、60%时,正常家蝇的累计死亡率分别为40%和50%;接入比例达到80%时,正常家蝇的累计死亡率接近80%,见图 5。
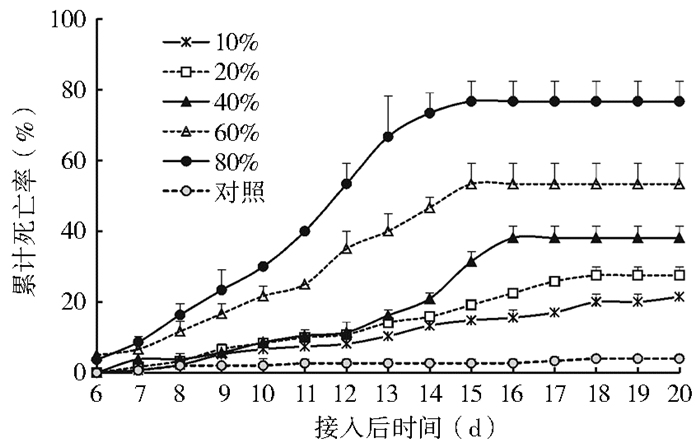
|
| 图 5 健康家蝇感染携带球孢白僵菌孢子家蝇的死亡率 Figure 5 The mortality of healthy M. domestica adults after being infected with B. bassiana |
| |
感染球孢白僵菌孢子后不同时间的家蝇对正常家蝇的感染率差异有统计学意义(F= 90.670,P=0.000)。其中,以感染初期(喷洒1 d内)和感染后期(喷洒后6 d)的家蝇对正常家蝇的感染率最高,正常家蝇的死亡率分别为40%和30%左右;喷洒球孢白僵菌孢子后5 d的家蝇引起正常家蝇的死亡率可达20%;而喷洒球孢白僵菌孢子后1~4 d的家蝇对正常家蝇的感染率均较低,正常家蝇的死亡率约为10%,见图 6。
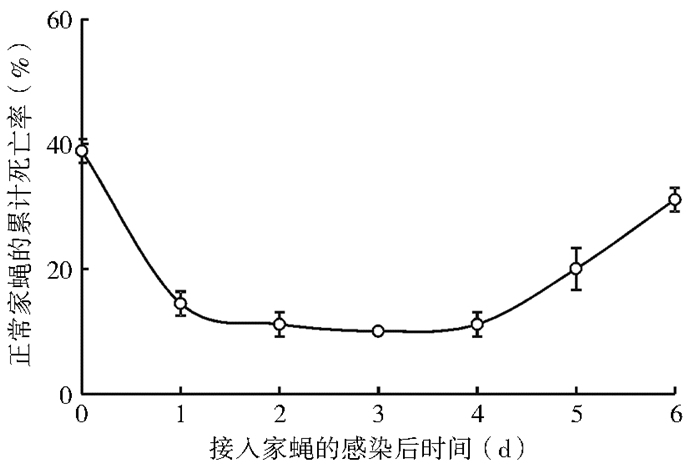
|
| 图 6 正常家蝇成虫感染喷洒球孢白僵菌孢子后家蝇不同时间的死亡率 Figure 6 Time mortality of housefly after being infected by B. bassiana |
| |
在垃圾箱和垃圾站附近喷洒球孢白僵菌孢子对野外孳生的蝇类感染率最高达12%和10%左右,而释放喷洒过球孢白僵菌孢子的家蝇感染率仅达8%和6%,防治效果较差(图 7)。说明球孢白僵菌在实验室内对蝇类有良好的防治作用,但对野外孳生的蝇类防治效果并不理想。
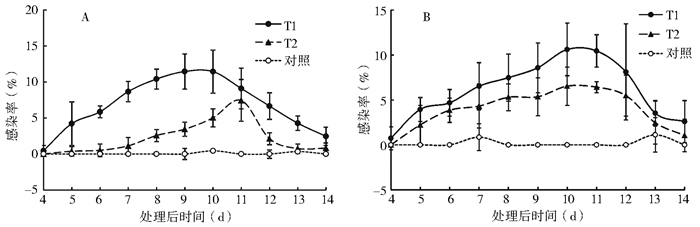
|
| 注:T1.喷洒球孢白僵菌孢子悬液;T2.释放喷洒过球孢白僵菌孢子的家蝇。 图 7 在垃圾箱(A)和垃圾站(B)喷洒球孢白僵菌孢子悬液或释放感染家蝇后不同时间正常家蝇的感染率 Figure 7 The infection of wild M. domestica adults after spraying spore suspension of B. bassiana CF08 strain and releasing of infected M. domestica adults |
| |
白僵菌宿主广泛,可寄生于鳞翅目、同翅目、鞘翅目和双翅目等昆虫,已成功应用于农业和林业等害虫的生物防治,由于其对环境友好,已作为生物农药进行登记使用。但在白僵菌对卫生害虫进行防治的研究中仍缺少典型的成功案例。
利用球孢白僵菌防治家蝇的研究多集中于菌株的分离、毒力测定及培养条件优化[14-20],关于白僵菌等真菌在家蝇种群内水平传播能力的研究多以实验室为主[8, 21],迄今仍未有用于蝇类生物防治的白僵菌杀虫剂[8]。本研究利用自主分离鉴定的球孢白僵菌,研究其在实验室和野外家蝇种群内的水平传播能力,结果表明球孢白僵菌CF08株在实验室内可在家蝇种群内进行有效地传播,但野外条件下,球孢白僵菌CF08株对自然孳生家蝇的感染非常有限,控制效果较差。可能原因:(1)野外现场试验中,喷洒球孢白僵菌孢子时,孢子受风力等因素影响,防治区域的孢子飘散,导致达到家蝇体表的有效孢子数量较少。(2)孢子受紫外线照射和气候条件的影响,在野外的存活率不高,寄生能力下降。(3)野外条件下,家蝇的活动空间较大,蝇体间接触减少,难以形成有效的传播。因此,在开放环境中,单独使用球孢白僵菌防治蝇类难以达到理想效果,需要与其他化学农药、生物农药或寄生蜂等混合使用[11, 22-23],以取得较为理想的防治效果。
| [1] | Tan SW, Yap KL, Lee HL. Mechanical transport of rotavirus by the legs and wings of Musca domestica(Diptera:Muscidae)[J]. J Med Entomol, 1997, 34(5) : 527–531 .DOI:10.1093/jmedent/34.5.527. |
| [2] | Fotedar R, Banerjee U, Singh S, et al. The housefly (Musca domestica) as a carrier of pathogenic microorganisms in a hospital environment[J]. J Hosp Infect, 1992, 20(3) : 209–215 .DOI:10.1016/0195-6701(92)90089-5. |
| [3] | Iwasa M, Makino S, Asakura H, et al. Detection of Escherichia coli O157:H7 from Musca domestica(Diptera:Muscidae) at a cattle farm in Japan[J]. J Med Entomol, 1999, 36(1) : 108–112 .DOI:10.1093/jmedent/36.1.108. |
| [4] | Kobayashi M, Sasaki T, Saito N, et al. Houseflies:not simple mechanical vectors of enterohemorrhagic Escherichia coli O157: H7[J]. Am J Trop Med Hyg, 1999, 61(4) : 625–629 . |
| [5] | Wales AD, Carrique-Mas JJ, Rankin M, et al. Review of the carriage of zoonotic bacteria by arthropods, with special reference to Salmonella in mites, flies and litter beetles[J]. Zoonoses Public Health, 2010, 57(5) : 299–314 . |
| [6] | 陈佳木, 李亚伦, 高思维, 等. 马尾口岸蝇类生物多样性和携带病原微生物情况的研究[J]. 检验检疫学刊, 2009, 19(6): 21–27. |
| [7] | 张忠, 史卫峰, 叶恭银, 等. 丽蝇蛹集金小蜂的寄生习性研究[J]. 中国媒介生物学及控制杂志, 2008, 19(6): 507–509. |
| [8] | Cárcamo MC, Felchicher F, Duarte JP, et al. Horizontal transmission of Beauveria bassiana (Hypocreales: Cordycipitaceae) and Metarhizium anisopliae (Hypocreales: Clavicipitaceae) in Musca domestica(Diptera:Muscidae)[J]. J Econ Entomol, 2015, 108(4) : 1579–1586 .DOI:10.1093/jee/tov163. |
| [9] | 魏继波, 李桂玲, 孟庆东, 等. 苏云金杆菌对媒介蚊虫的防治研究[J]. 中国媒介生物学及控制杂志, 2014, 25(6): 502–505. |
| [10] | 张俊天, 熊国红, 何建国, 等. 3种植物精油对家蝇成虫的熏蒸活性[J]. 昆虫学报, 2016, 59(6): 641–646. |
| [11] | 杜迎刚, 赖钟雄, 张忠. 双效毒蝇绳对家蝇的控制效果[J]. 环境昆虫学报, 2015, 37(4): 915–920. |
| [12] | 王松田, 张辉, 高熹, 等. 罹病棕尾别麻蝇体上白僵菌的分离、离体培养与毒力[J]. 环境昆虫学报, 2009, 31(1): 52–57. |
| [13] | 刘宝生, 谷希树, 田涛, 等. 10株白僵菌菌株形态学与分子鉴定[J]. 山东农业科学, 2012, 44(6): 93–96. |
| [14] | Steinkraus DC, Geden CJ, Rutz DA, et al. First report of the natural occurrence of Beauveria bassiana (Moniliales: Moniliaceae) in Musca domestica (Diptera:Muscidae)[J]. J Med Entomol, 1990, 27(3) : 309–312 .DOI:10.1093/jmedent/27.3.309. |
| [15] | Lecuona RE, Turica M, Tarocco F, et al. Microbial control of Musca domestica(Diptera:Muscidae) with selected strains of Beauveria bassiana[J]. J Med Entomol, 2005, 42(3) : 332–336 .DOI:10.1093/jmedent/42.3.332. |
| [16] | Mishra S, Kumar P, Malik A. Effect of temperature and humidity on pathogenicity of native Beauveria bassiana isolate against Musca domestica L.[J]. J Parasit Dis, 2015, 39(4) : 697–704 .DOI:10.1007/s12639-013-0408-0. |
| [17] | Mishra S, Kumar P, Malik A. Preparation, characterization, and insecticidal activity evaluation of three different formulations of Beauveria bassiana against Musca domestica[J]. Parasitol Res, 2013, 112(10) : 3485–3495 .DOI:10.1007/s00436-013-3529-6. |
| [18] | Mishra S, Malik A. Comparative evaluation of five Beauveria isolates for housefly (Musca domestica L.) control and growth optimization of selected strain[J]. Parasitol Res, 2012, 111(5) : 1937–1945 .DOI:10.1007/s00436-012-3039-y. |
| [19] | Mishra S, Malik A. Nutritional optimization of a native Beauveria bassiana isolate (HQ917687) pathogenic to housefly, Musca domestica L.[J]. J Parasit Dis, 2013, 37(2) : 199–207 .DOI:10.1007/s12639-012-0165-5. |
| [20] | Anderson RD, Bell AS, Blanford S, et al. Comparative growth kinetics and virulence of four different isolates of entomopathogenic fungi in the house fly (Musca domestica L.)[J]. J Invertebr Pathol, 2011, 107(3) : 179–184 .DOI:10.1016/j.jip.2011.04.004. |
| [21] | Mishra S, Kumar P, Malik A, et al. Adulticidal and l arvicidal activity of Beauveria bassiana and Metarhizium anisopliae against housefly, Musca domestica (Diptera:Muscidae), in laboratory and simulated field bioassays[J]. Parasitol Res, 2011, 108(6) : 1483–1492 .DOI:10.1007/s00436-010-2203-5. |
| [22] | Mwamburi LA, Laing MD, Miller R. Interaction between Beauveria bassiana and Bacillus thuringiensis var. israelensis for the control of house fly larvae and adults in poultry houses[J]. Poult Sci, 2009, 88(11) : 2307–2314 .DOI:10.3382/ps.2009-00212. |
| [23] | Lecuona R, Crespo D, La Rossa F. Populational parameters of Spalangia endius Walker (Hymenoptera: Pteromalidae) on Pupae of Musca domestica L.(Diptera:Muscidae) treated with two strains of Beauveria bassiana (Bals.) Vuil. (Deuteromycetes)[J]. Neotrop Entomol, 2007, 36(4) : 537–541 .DOI:10.1590/S1519-566X2007000400010. |
 2017, Vol. 28
2017, Vol. 28


