扩展功能
文章信息
- 尹小平, 王安东, 田延河, 巴特, 张江国, 梁臻
- YIN Xiao-ping, WANG An-dong, TIAN Yan-he, BA Te, ZHANG Jiang-guo, LIANG Zhen
- 中国-哈萨克斯坦边境阿拉山口口岸地区凶小库蚊中首次检测到沃尔巴克氏体
- First detection of Wolbachia in Culex modestus at Alataw port, China-Kazakhstan border
- 中国媒介生物学及控制杂志, 2017, 28(2): 117-119
- Chin J Vector Biol & Control, 2017, 28(2): 117-119
- 10.11853/j.issn.1003.8280.2017.02.005
-
文章历史
- 收稿日期: 2016-11-21
- 网络出版时间: 2017-02-17 08:56
2 新疆石河子大学动物科技学院, 新疆 石河子 832000
2 College of Animal Science and Technology, Shihezi University
沃尔巴克氏体(Wolbachia)属于变形菌门(Proteobacteria)、变形菌纲α亚门(Alphaproteobacteria)、立克次体目(Rickettsiales)、立克次体科(Rickettsiaceae)、沃尔巴克氏体属,为革兰阴性菌,是世界上分布最为广泛的共生菌,常见于节肢动物门和部分线虫体内[1-2]。调查显示,至少65%的昆虫种类天然携带沃尔巴克氏体,其中28.1%的蚊种(包括29.6%的伊蚊、42.1%的库蚊和50.0%的曼蚊)携带沃尔巴克氏体[3]。中国-哈萨克斯坦(中哈)边境阿拉山口口岸地区地处83°36′ E,45°12′ N,北接哈萨克斯坦国塔勒迪库尔干州阿拉湖,南接中国的艾比湖,湖面资源丰富,植被丰茂,为蚊虫孳生提供了条件。随着经济全球化发展,为蚊虫随交通工具、货物和人员往来入侵提供了便利,并增加了蚊媒疾病传入我国的风险。有文献报道,该地区蚊种以凶小库蚊(Culex modestus)为优势种,占46.0%[4],但该蚊种是否携带沃尔巴克氏体不详。1924年Hertig和Wolbach[5]在尖音库蚊(Cx. pipiens)体内首次发现沃尔巴克氏体。我国广东、浙江省中东部仅在白纹伊蚊(Aedes albopictus)、骚扰阿蚊(Armigeressubalbatus)、致倦库蚊(Cx. pipiens quinquefasciatus)中发现感染基因型为wAlbA和wAlbB型的沃尔巴克氏体[1-2]。本研究对中哈边境阿拉山口地区的优势蚊种凶小库蚊进行检测,根据检测结果对蚊媒疾病传播防控进行探讨。
1 材料与方法 1.1 蚊虫采集2015年4-10月,在中哈边境一区、二区、阿拉山口艾比湖湿地自然保护区,用诱蚊灯、挥网法采集蚊虫,经显微镜观察及分类鉴定后选取凶小库蚊1 200只,按20只/组共分60组,待检。
1.2 DNA提取按照DNA提取试剂盒(DNeasy® Blood & Tissue Kit,QIAGEN公司)说明书对60组凶小库蚊进行DNA提取,置-20 ℃保存,备用。
1.3 细胞色素C氧化酶亚基Ⅰ(COⅠ)基因扩增、测序用双翅目国际通用引物LCO1490和HCO2198扩增蚊虫线粒体COⅠ基因并测序,进行Blast分析,利用Mega 6.0软件构建系统进化树。
1.4 沃尔巴克氏体检测与系统进化树分析参照林立丰等[2]报道的扩增沃尔巴克氏体wsp基因,选取阳性样本送北京鼎国昌盛生物技术有限责任公司测序。将测序结果进行Blast分析,利用Mega 6.0软件构建分子进化树,分析凶小库蚊感染沃尔巴克氏体的wsp基因特征。
2 结果 2.1 基因鉴定测序结果经分类鉴定,选取的凶小库蚊60组中有2组出现特异性条带,测序后得到2条沃尔巴克氏体序列,阳性率为3.33%(2/60)。
2.2 COⅠ基因序列分析线粒体COⅠ基因经Blast比对显示,样本编号为ALSK-W011的凶小库蚊与GenBank中Cx. modestus(JN592735,英国)同源性为99%(647/649);编号ALSK-W024的凶小库蚊与GenBank中Cx. modestus(KJ401305,丹麦)同源性为99%(653/657)。分子遗传进化树显示,中国阿拉山口口岸地区凶小库蚊与英国(JN592735)、丹麦(KJ401305)、土耳其(KJ012102)、俄罗斯(FM177758)及德国(HF562837)的凶小库蚊聚为一支,但ALSK-W011与ALSK-W024形成不同的分支,见图 1。由此可见,该地区的凶小库蚊线粒体COⅠ基因具有多样性。

|
| 图 1 凶小库蚊线粒体COⅠ基因系统进化树 Figure 1 Phylogenetic analysis of Cx. modestus mitochondrial cytochrome C oxidase subunitⅠ (COⅠ) genes |
| |
在60组蚊虫样本中有2组获得599~626 bp片段大小的条带,阳性率为3.33%。经阳性Blast分析显示,2条序列与沃尔巴克氏体的同源性均为99%,其中ALSK-W033与Pristophera geniculate的沃尔巴克氏体内共生体(EF658739)同源性最高;ALSK-W035与致倦库蚊的沃尔巴克氏体内共生体(KJ140126)的同源性为99%(566/572)。分子遗传进化树显示,2条沃尔巴克氏体序列被分成2个超级组别的2个进化分支,其中ALSK-W033及ALSK-W035分别为wAlbA和wAlbB型沃尔巴克氏体,分别属于Supergroup A和Supergroup B,见图 2。
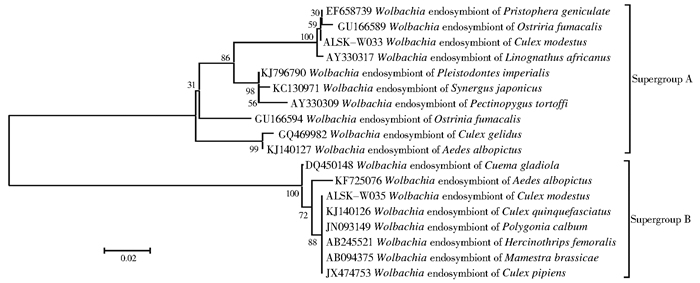
|
| 图 2 沃尔巴克氏体基因系统进化树 Figure 2 Phylogenetic analysis of Wolbachia wsp genes |
| |
本研究显示,中哈边境阿拉山口口岸地区的优势蚊种凶小库蚊与英国、丹麦、土耳其、俄罗斯和德国的凶小库蚊同源性较高,聚为一支,该5国均为“一带一路”沿线国家。因此,推测该蚊种可能是随货物、交通工具等远距离活动于该地带的蚊种,以致有较高的同源性,但不能排除其他传播及活动因素,如鸟类的迁徙等[6-8],有待调查。
3.2 蚊媒疾病传播的防控据国内报道,已知从43种蚊虫中分离到西尼罗脑炎、流行性乙型脑炎(乙脑)等病毒,其中大部分种类与其吸鸟血习性相关,凶小库蚊、尖音库蚊又是携带该病原体的主要媒介[4, 9]。2014年刘然等[10]从凶小库蚊中分离出1株新型布尼亚病毒,命名为艾比湖布尼亚病毒(Abbey Lake bunyavirus,Ab-BUNV)。2016年寨卡病毒病、登革热、黄热病及疟疾等蚊媒疾病扩散流行。随着我国“一带一路”战略的推进、中哈边境口岸的对外开放、沿线国家和地区经贸合作不断发展,蚊虫种群及蚊媒疾病通过交通工具、货物、行李等方式入侵、传播,严重威胁人类健康[11-12]。近年来大多研究及初期实验显示,沃尔巴克氏体可抑制蚊虫体内的寨卡病毒[13-14]。沃尔巴克氏体可阻止登革热病毒在蚊虫体内复制增殖,携带不同型别沃尔巴克氏体的雌雄蚊虫交配后产生的卵不发育,沃尔巴克氏体可通过诱导宿主间杂交的胞质不相融合,诱导单性生殖、雌性化和杀雄性等机制改变和影响其宿主的繁殖,利用携带沃尔巴克氏体的雌蚊生殖优势,使其扩散到蚊虫种群;同时沃尔巴克氏体在蚊虫体内对多种人类病原体(如登革热病毒、黄病毒和疟原虫等)产生抗性,利用此特性建立对生物、虫媒疾病的控制策略[15]。将野生传病蚊媒改造成对人类病原体具有抗性的蚊种,使携带该菌的蚊种成为某地的优势种,登革热等疫情即可得到抑制[16-17]。目前,美国、澳大利亚、巴西等国家相继开始投放“益蚊”。澳大利亚从2011年起,最早通过该措施抑制登革热疫情,释放实验持续了4年,目前未发现任何负面作用[18-19]。根据中哈边境阿拉山口口岸地区的凶小库蚊种群携带wAlbA和wAlbB型沃尔巴克氏体的研究结果,可利用沃尔巴克氏体诱导胞质不相融现象,将感染不同类型沃尔巴克氏体的凶小库蚊的雌雄虫进行交配,使其子代发生双向胞质不相融而无法存活,从而降低凶小库蚊种群的密度,控制西尼罗脑炎、乙脑等多种蚊媒疾病。
| [1] | 郭颂, 凌锋, 王金娜, 等. 浙江省中东部白纹伊蚊共生菌沃尔巴克氏体的调查研究[J]. 中国媒介生物学及控制杂志, 2015, 26(6): 545–549. |
| [2] | 林立丰, 吴德, 张欢, 等. 广东省蚊虫感染沃尔巴克氏体初步调查研究[J]. 中国媒介生物学及控制杂志, 2014, 25(2): 113–115. |
| [3] | 潘晓玲, 刘起勇, 奚志勇, 等. 基于昆虫共生菌沃尔巴克氏体的蚊媒和蚊媒病控制研究进展[J]. 中国媒介生物学及控制杂志, 2014, 25(1): 1–7. |
| [4] | 尹小平, 郑重, 田延河, 等. 新疆中哈边境阿拉山口口岸蚊虫调查研究[J]. 寄生虫与医学昆虫学报, 2014, 21(3): 180–183. |
| [5] | Hertig M, Wolbach SB. Studies on rickettsia-like micro-organisms in insects[J]. J Med Res, 1924, 44(3) : 329–374 . |
| [6] | Castelli F, Cabona MG, Brunori A, et al. Short report: imported mosquito: an uninvited guest[J]. Am J Trop Med Hyg, 1994, 50(5) : 548–549 . |
| [7] | Berry RL, Peterson ED, Restifo RA. Records of imported tirebreeding mosquitoes in Ohio[J]. J Am Mosq Control Assoc, 1988, 4(2) : 187–189 . |
| [8] | Ramsdale CD. Anopheles mosquitoes and imported malaria in Libya[J]. Mosq Syst, 1990, 22(1) : 34–40 . |
| [9] | 徐卫民, 项海青. 西尼罗热研究进展[J]. 浙江预防医学, 2005, 17(1): 54–55. |
| [10] | 刘然, 张桂林, 孙响, 等. 新疆艾比湖布尼亚病毒的分离与分子生物学鉴定[J]. 中华流行病学杂志, 2014, 35(8): 939–942. |
| [11] | 赵睿. 上海3个海港口岸入境船舶蚊媒传播防制现状及对策研究[D]. 上海: 复旦大学, 2012. |
| [12] | 史书路, 于长友, 王雪嵋, 等. 蚊媒传染病传入我国风险及防控策略[J]. 口岸卫生控制, 2015, 20(1): 5–6. |
| [13] | Aliota MT, Peinado SA, Velez ID, et al. The wMel strain of Wolbachia reduces transmission of Zika virus by Aedes aegypti[J]. Sci Rep, 2016: 28792.DOI:10.1038/srep28792. |
| [14] | Dutra HLC, Rocha MN, Dias FBS, et al. Wolbachia blocks currently circulating Zika virus isolates in Brazilian Aedes aegypti mosquitoes[J]. Cell Host Microbe, 2016, 19(6) : 771–774 .DOI:10.1016/j.chom.2016.04.021. |
| [15] | 徐晓晗, 奚志勇, 郑小英. 沃尔巴克氏体诱导细胞质不相容的模型和分子机制研究进展[J]. 国际医学寄生虫病杂志, 2015, 42(4): 244–248. |
| [16] | Walker T, Johnson PH, Moreira LA, et al. The wMel Wolbachia strain blocks dengue and invades caged Aedes aegypti populations[J]. Nature, 2011, 476(7361) : 450–453 .DOI:10.1038/nature10355. |
| [17] | Hughes H, Britton NF. Modelling the use of Wolbachia to control dengue fever transmission[J]. Bull Math Biol, 2013, 75(5) : 796–818 .DOI:10.1007/s11538-013-9835-4. |
| [18] | Turley AP, Moreira LA, O'Neill SL, et al. Wolbachia infection reduces blood feeding success in the dengue fever mosquito, Aedes aegypti[J]. PLoS Negl Trop Dis, 2003, 3(9) : e516. |
| [19] | 申卉, 徐静. 明年试投"益蚊"控制登革热[EB/OL]. (2014-11-07)[2016-11-07]. http://news2.sysu.edu.cn/news03/140938.htm. |
 2017, Vol. 28
2017, Vol. 28

