扩展功能
文章信息
- 胡双双, 吴炳耀, 何江, 陆永昌, 杨庆贵, 陈峰, 孙立新
- HU Shuang-shuang, WU Bing-yao, HE Jiang, LU Yong-chang, YANG Qing-gui, CHEN Feng, SUN Li-xin
- 江苏口岸褐家鼠线粒体DNA细胞色素C氧化酶亚基Ⅰ基因的遗传多态性研究
- Research of the cytochrome C oxidase subunitⅠ gene polymorphisms for Rattus norvegicus in Jiangsu port
- 中国媒介生物学及控制杂志, 2017, 28(1): 31-34
- Chin J Vector Biol & Control, 2017, 28(1): 31-34
- 10.11853/j.issn.1003.8280.2017.01.009
-
文章历史
- 收稿日期: 2016-09-27
- 网络出版时间: 2016-09-28 14:38
2 江苏国际旅行卫生保健中心, 南京 210019;
3 江苏出入境检验检疫局, 南京 210001;
4 南通出入境检验检疫局, 江苏 南通 226000
2 Jiangsu International Travel Healthcare Center;
3 Jiangsu Entry-Exit Inspection and Quarantine Bureau;
4 Nantong Entry-Exit Inspection and Quarantine Bureau
褐家鼠(Rattus norvegicus)是我国分布最广的鼠种之一,遍布除西藏自治区外的全国各地[1],尤其是江淮及华南地区、西南地区、华北北部山区以及东北农牧接壤的地带。随着分子生物学的发展,基因检测技术在物种鉴定和溯源研究方面应用越来越广泛。1981年 Anderson等[2]完成了第一个鼠类全基因组测序,随后Aplin等[3]通过线粒体基因组对鼠类鉴定、溯源和地理扩散规律进行了研究。线粒体基因组是独立于核基因组之外的遗传基因,其进化速度快,更适合低分类阶元的研究,对其碱基改变的分析能够得出种群的进化史。线粒体DNA细胞色素C氧化酶亚基Ⅰ(cytochrome C oxidase subunitⅠ,COⅠ)以母系遗传为主,基因重组率低,进化速率快,很少存在插入和缺失,大多数动物的COⅠ基因可以被通用引物所扩增。COⅠ作为蛋白编码基因,其密码子第3位碱基不受自然选择压力影响,可以自由变异[4]。根据每100万年2%的进化速率,一个有100万年生殖隔离的物种类群,长度为650 bp的DNA序列约有12个特征位点用于识别[5]。即使是亲缘关系很近的两个类群,大多数动物的进化历史均超过100万年,所以长度约为650 bp的COⅠ基因足够分析大多数动物物种。加拿大动物学家 Hebert等首次提出“生物条形码”概念,即用单一的小片段基因(COⅠ基因)作为动物物种快速鉴定的标准分子标记[6]。Hebert等[7-8]曾对11个门13 320个物种的COⅠ基因序列比较分析,除了肛肠动物Cnidaria外,98%的物种同属间COⅠ序列的平均差异程度为11.3%,而同种间COⅠ亦存在差异,平均差异程度在0~2%。
建立有效识别输入性与本底鼠形动物的分子鉴别技术对口岸鼠形动物监测至关重要,mtDNA-COⅠ基因具有独特种间遗传差异性和丰富的基因多态性,研究国内外褐家鼠mtDNA-COⅠ基因的遗传多样性等分子学特征,可为该技术提供有力支撑。
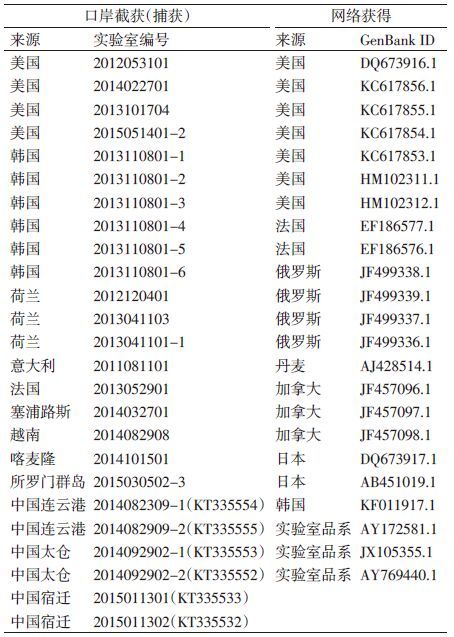
1 材料与方法 1.1 材料 1.1.1 样品来自江苏口岸本底监测捕获的褐家鼠6只和江苏口岸截获的输入性褐家鼠19只,分别取其肝组织,置于95%乙醇溶液中保存备用。同时收集GenBank上有明确来源地的23个国外褐家鼠COⅠ序列,见表 1。
DNeasy Blood and Tissue Kit(QIAGEN)DNA提取试剂,OMEGA Cycle-Pure Kit(200) 纯化试剂盒,OMEGA Mag-Bind SE DTR Kit试剂盒,Applied Biosystems Hi-Di Formamide,DL1000 Marker、10×PCR Buffer(无Mg2+)、MgCl2(25 mmol/L)、dNTP Mixture(各2.5 mmol/L)、Taq DNA聚合酶5 U/μl(TaKaRa),琼脂糖粉(Biowest)。
1.2 方法 1.2.1 DNA提取按操作说明书要求,用DNA提取试剂从褐家鼠肝中提取总DNA,置于-20 ℃备用。
1.2.2 PCR在35 μl的体系中,10×Buffer 3.5 μl,上下游引物各1.5 μl,dNTP 3 μl,DNA模板3 μl,Taq DNA聚合酶0.4 μl(5 U/μl),灭菌去离子H2O补足至35 μl。扩增条件:94 ℃预变性5 min;94 ℃ 变性1 min,60 ℃退火1 min,72 ℃延伸1 min,共35个循环;72 ℃终延伸10 min。上游引物 BatL5310: ACT TCT GGG TGT CCA AAG AAT CA;下游引物 R6036R:CCT ACT CRG CCA TTT TAC CTA TG。
1.2.3 产物纯化PCR产物用1.5%的琼脂糖凝胶电泳分析,用OMEGA Cycle-Pure Kit(200) 纯化试剂盒,选择目的条带清晰的扩增产物进行纯化。
1.3 序列测序在10 μl的体系中,Big Die 0.50 μl,5×Buffer 1.75 μl,单向引物0.50 μl,灭菌去离子水6.25 μl,再加DNA模板1.00 μl。反应条件:96 ℃ 预变性1 min;96 ℃变性10 s,50 ℃退火5 s,60 ℃延伸4 min,共25个循环;4 ℃终延伸7 min。测序反应后,根据OMEGA Mag-Bind SE DTR Kit试剂盒进行测序反应后纯化。将纯化后产物溶于Applied Biosystems Hi-Di Formamide试剂,测序。
1.4 序列分析首先在Chromos软件中观察测序峰图,评价测序质量。通过Lasergene 7.0软件的Seqman模块进行双向序列自动拼接及适当的手工调整。然后将测定的序列在NCBI上通过Blast程序进行序列同源性比较,以确保所获得的序列是目标序列。将所有序列在Mega 6.0软件的ClustalW模块中对齐,基于赤池信息标准(akaike information criterion,AIC),通过ModelTest v2.1.7软件筛选最佳进化模型,在Mega 6.0软件中采用最大似然法(maximum likelihood,ML)构建褐家鼠mtDNA-COⅠ基因序列的ML系统树,各分支的置信度由1 000次自举法(Bootstrap)重复检测。
2 结果 2.1 扩增结果以江苏口岸监测捕获的6只本底褐家鼠和江苏口岸截获的19只输入性褐家鼠的DNA为模板,加入COⅠ测序引物进行扩增,均扩增出相应条带,以长度为1 000 bp的Marker作标记,可见本实验所扩增的褐家鼠COⅠ基因的长度在800 bp左右。阴性对照未见扩增反应,见图 1。

|
| 注: M. DNA分子质量标准; 1~25. 2014082309-1、2014082909-2、2014092902-1、2015011302、2015011301、2014092902-2、2012053101、2014022701、2013101704、2015051401-2、2013110801-1、2013110801-2、2013110801-3、2013110801-5、2013110801-4、2013110801-6、2012120401、2013041103、2013041101-1、2011081101、2013052901、2015030502-3、2014082908、2014101501、2014032701; -. 表示阴性对照。 图 1 褐家鼠COⅠ基因扩增产物电泳结果 Figure 1 The electrophoretogram results of COⅠ genes for R. norvegicus |
| |
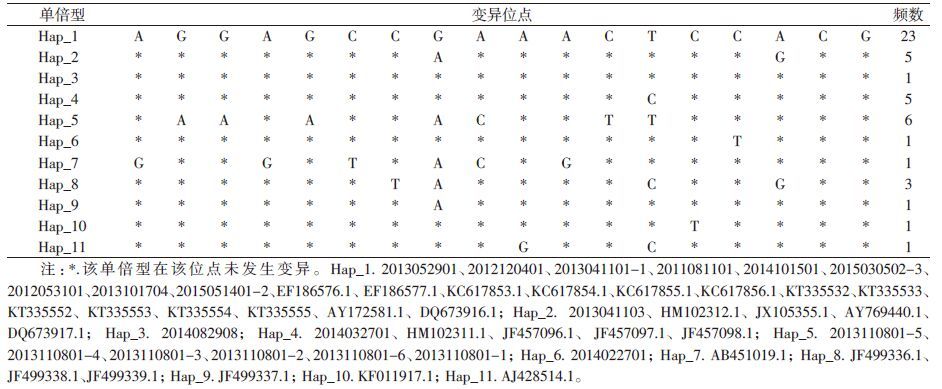
将扩增出相应条带的样本纯化后,加入COⅠ基因单向引物进行测序反应,共获得江苏本底和境外输入的褐家鼠COⅠ序列48个。各测得COⅠ序列位点605个,其中保守位点587个,变异位点18个,分别为第2、23、48、59、62、68、164、170、182、242、257、268、320、326、338、353、422、473位。本研究的48条褐家鼠COⅠ基因共有11个单倍型,江苏本底的6只小家鼠共享1个单倍型,非江苏的42只小家鼠共享11个单倍型,见表 2。
在18个可变异位点中,单碱基位点有10个,分别是2、59、62、68、242、257、326、338、422、473。兼并碱基位点有8个,分别是23、48、164、170、182、261、320、353。本研究COⅠ序列中共有11个单倍型,单倍型多样性差异为0.742 000,单倍型多样性的平均方差为0.003 420,单倍型多样性的标准差为0.058。所测序列的核苷酸平均差异性为2.510 000,核苷酸多样性差异的平均方差为0.000 000 4,核苷酸多样性差异的标准差为0.000 640。将48个褐家鼠序列按照样本来源分为两个群组,见表 3。

|
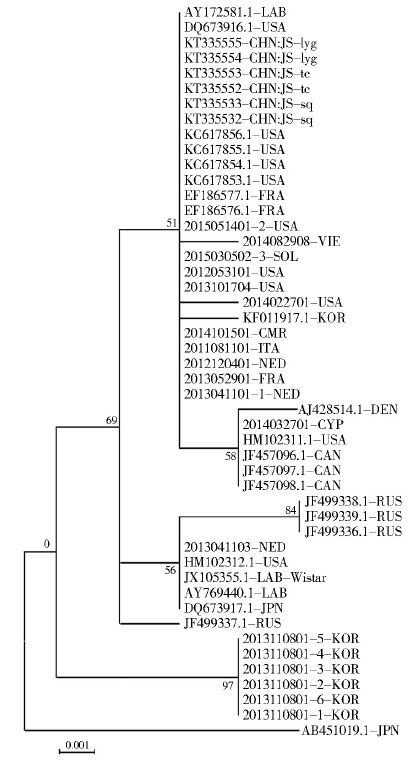
用ML构建获得的48个褐家鼠COⅠ序列的ML系统树,见图 2。除1个来自日本的褐家鼠COⅠ序列外,其余序列分成了2个分支。其中来自韩国的6条褐家鼠COⅠ序列独立形成一支,与其他的序列分离开。另一个分支又可分为3个小分支,其中来自俄罗斯的1条褐家鼠COⅠ序列单独形成一支,另外2个分支构成复杂,分别混杂着来自世界各地的褐家鼠COⅠ序列。
|
| 注: JS-lyg. 江苏连云港; JS-tc. 江苏太仓; JS-sq. 江苏宿迁; JPN. 日本; LAB. 实验室品系; USA. 美国; FRA. 法国; VIE. 越南; SOL. 所罗门群岛; KOR. 韩国; CMR. 喀麦隆; ITA. 意大利; NED. 荷兰; DEN. 丹麦; CYP. 塞浦路斯; CAN. 加拿大; RUS. 俄罗斯。 图 2 褐家鼠COⅠ基因序列的ML系统发育树 Figure 2 The ML phylogenetic tree of COⅠ gene sequences for R. norvegicus |
| |
将实验所用的48只褐家鼠分为江苏口岸和非江苏口岸两个群组时,发现两个群组间的褐家鼠COⅠ序列具有一定的种内差异。2014年刘铸等[9]用COⅠ基因序列对中尼边境鼠类研究时也发现,鼠种内的遗传距离平均值为0.035,说明该研究的褐家鼠种内也存在差异。提示物种内的COⅠ基因还具有丰富的种内多态性信息,有待进一步挖掘利用。通过褐家鼠COⅠ基因多态性分析可知,江苏省本底褐家鼠COⅠ基因完全为同一单倍型,而来自全球各地的非江苏本底褐家鼠含有10个单倍型。2011年Aplin等[3]在对黑鼠(Rattus rattus)的地理起源和传播历史研究中也发现该鼠的种内差异与其地理分布有着密切的联系。由此可见,物种内的核苷酸差异程度及基因多态性与该物种地理分布有关。
从系统发育树可以看出来自江苏省本底的6个COⅠ序列遗传关系很接近,不仅如此,它们与来自欧洲和亚洲其他国家以及美国的褐家鼠COⅠ序列也有较为相近的遗传关系,表明本实验中来自江苏省本底的6只褐家鼠与江苏口岸输入的19只褐家鼠以及GenBank上来自全球各地的23只褐家鼠可能由同一个祖先进化而来。但随着时间的发展,不同地区的褐家鼠因长时间在不同地理环境中独自进化而形成以地理位置为划分标准的差异。有人将这种现象称为地理障碍,即原本广泛分布的物种,后来因地理障碍出现,将原有的连续分布区隔离开,生物在隔离区内各自独立演化,进而形成一定的种内差异[10]。然而在本实验建立的系统发育树中可以看出,48条褐家鼠COⅠ序列并非严格按照地理位置进行分支,来自世界各地的褐家鼠COⅠ序列混杂地分布在进化树分支中,可能是由于褐家鼠的活动能力强,且随着人类的活动不断来回迁移。尤其是随着人类交通工具的发展,褐家鼠越来越频繁地在不同地区进行迁移活动。也可能由于本实验所研究样本数量过少,样本来源也仅局限于江苏口岸,因此实验结果有所偏差。在后续的实验中,将继续增加样本数量,扩大来源,进一步完善本实验中出现的漏洞和不足。
对外来医学媒介生物的监测和控制是口岸卫生检疫的重要组成部分,而有效分辨输入性与本底鼠类是口岸防控外来媒介生物的重要前提。本研究利用mtDNA-COⅠ基因独特的核苷酸差异性及丰富的基因多态性来研究褐家鼠mtDNA-COⅠ基因的遗传多态性和系统进化规律,可对口岸媒介生物鉴别提供可靠的技术支撑。
| [1] | 郑智民, 姜志宽, 陈安国. 啮齿动物学[M]. 2版. 上海: 上海交通大学出版社, 2012: 156-159. |
| [2] | Anderson S, Bankier AT, Barrell BG, et al. Sequence and organization of the human mitochondrial genome[J]. Nature, 1981, 290(5806) : 457–465 .DOI:10.1038/290457a0. |
| [3] | Aplin KP, Suzuki H, Chinen AA, et al. Multiple geographic origins of commensalism and complex dispersal history of black rats[J]. PLoS One, 2011, 6(11) : e26357.DOI:10.1371/journal.pone.0026357. |
| [4] | Strauss JH, Strauss EG. The alphaviruses:gene expression, replication and evolution[J]. Microbiol Mol Biol Rev, 1994, 58(3) : 491–562 . |
| [5] | Saxena SK. Re-emergence of the knotty chikungunya virus:facts,fearor fiction[J]. Future Virol, 2007, 2(2) : 121–126 .DOI:10.2217/17460794.2.2.121. |
| [6] | 马英, 鲁亮. DNA条形码技术[J]. 中国媒介生物学及控制杂志, 2012, 23(3): 185–190. |
| [7] | Hebert PDN, Penton EH, Burns JM, et al. Ten species in one:DNA barcoding reveals cryptic srecies in the neotropical skipper butterfly Astraptes fulgerator[J]. Proc Natl Acad Sci USA, 2004, 101(41) : 14812–14817 .DOI:10.1073/pnas.0406166101. |
| [8] | Hebert PDN, Stoeckle MY, Zemlak TS, et al. Identification of birds through DNA barcodes[J]. PLoS Biol, 2004, 2(10) : e312.DOI:10.1371/journal.pbio.0020312. |
| [9] | 刘铸, 徐艳春, 戎可, 等. 啮齿动物分子系统地理学研究进展[J]. 生态学报, 2014, 34(2): 308–315. |
| [10] | 陈春生, 张晓龙, 张雪莲, 等. 基于COⅠ基因序列的DNA条形码在中尼边境鼠类物种鉴定中的应用[J]. 西南国防医药, 2012, 22(1): 22–24. |
 2017, Vol. 28
2017, Vol. 28