扩展功能
文章信息
- 丁岩, 杨婵, 李梅, 冯向阳, 邱星辉
- DING Yan, YANG Chan, LI Mei, FENG Xiang-yang, QIU Xing-hui
- 广西北海市家蝇杀虫剂抗性基因频率的检测与分析
- Frequency of alleles associated with insecticide resistance in a field housefly population from Beihai city, Guangxi Zhuang Autonomous Region
- 中国媒介生物学及控制杂志, 2017, 28(1): 12-15
- Chin J Vector Biol & Control, 2017, 28(1): 12-15
- 10.11853/j.issn.1003.8280.2017.01.004
-
文章历史
- 收稿日期: 2016-09-07
- 网络出版时间: 2016-12-06 17:10
2 广西壮族自治区疾病预防控制中心, 南宁 530028
2 Guangxi Center for Disease Control and Prevention
家蝇(Musca domestica)是一种重要的媒介昆虫,常孳生于生活垃圾等场所,其携带大量致病菌,可通过污染食物或饮用水而在人、畜中传播,对人类健康和畜牧业生产造成威胁[1]。家蝇的防治手段主要是滞留喷洒化学杀虫剂,但长期大规模使用杀虫剂可导致家蝇产生严重的抗药性。目前,抗药性已成为家蝇防控的难题[2]。
在我国,家蝇抗药性普遍存在[3],但广西地区家蝇的抗药性水平和抗性基因频率的现状还无相关报道。本研究以广西壮族自治区(广西)北海市采集的家蝇为材料,采用分子检测方法,调查家蝇杀虫剂抗性等位基因的种类和频率,了解北海市家蝇的抗药性现状,为化学药物防治家蝇提供科学依据。
1 材料与方法 1.1 家蝇2015年11月采自广西北海市新世纪大道和南珠广场养猪场周边外环境,家蝇成虫置于100%乙醇溶液中,带回实验室于4 ℃保存。
1.2 家蝇基因组DNA的提取参考Rinkevich等[4]方法提取单只家蝇头部和胸部的基因组DNA。
1.3 家蝇细胞色素P450 CYP6D1基因的基因型测定采用引物Qxh6d1F和Qxh6d1R(表 1),以家蝇基因组DNA为模板,扩增家蝇抗性相关细胞色素P450 CYP6D1基因片段,并采用Hpy188Ⅲ对PCR扩增产物进行酶切,区分个体的基因型,其原理参考Rinkevich等[4]方法。
分别用引物对qkdrFA-mdkdrgtR和kdrDIGLongF-kdrDIGLongR(表 1),对每个家蝇样本的钠离子通道Vssc基因片段进行PCR扩增;利用MluCⅠ酶对以kdrDIGLongF-kdrDIGLongR为引物扩增产物进行酶切,判定样本是否包含1014F基因突变[4]。利用限制性内切酶NlaⅢ酶对以qkdrFA-mdkdrgtR为引物的扩增产物进行酶切,判定样本是否包含1014H基因突变[5]。根据上述2个酶切结果判断家蝇个体的基因型。
1.5 家蝇乙酰胆碱酯酶(AChE)基因型测定采用引物Md-Ace-F和Md-Ace-R(表 1)对每个家蝇样本的乙酰胆碱酯酶基因(ace)片段进行PCR扩增,再利用Bsp1286Ⅰ酶和EaeⅠ酶对PCR扩增产物分别进行酶切反应,综合2种限制性内切酶的酶切结果,鉴定AChE342位点的基因型,其原理和步骤参照文献[5]。
2 结果 2.1 家蝇样本CYP6D1抗性等位基因频率CYP6D1抗性基因型包含的一段长15 bp的片段插入,打断了Hpy188Ⅲ酶切位点[6],利用本研究所用引物扩增的PCR产物无法被Hpy188Ⅲ酶切,但该酶可将携带敏感等位基因家蝇个体的PCR产物酶切为长度为132、329 bp的2个片段。在北海市的63只家蝇样本中,杂合型个体(RS)2只(3.17%),敏感型(SS)61只(96.83%),未检测到抗性等位基因纯合个体(RR),酶切结果见图 1。CYP6D1抗性等位基因频率为1.59% ,见表 2。
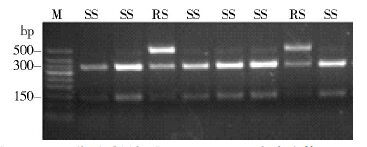
|
| 注: M. DNA分子质量标准; RS. CYP6D1杂合个体; SS. CYP6D1敏感个体。 图 1 CYP6D1扩增产物经Hpy188Ⅲ酶切结果 Figure 1 Restriction digest of amplified CYP6D1 fragments by Hpy188Ⅲ enzyme |
| |
|
利用引物qkdrFA和mdkdrgtR扩增获得220 bp片段。限制性内切酶NlaⅢ可将含1014H突变的抗性等位基因产物酶切为长度为170、50 bp的2个片段[5]。在所检测的63只家蝇个体中,未检测到含有1014H等位基因的个体。
采用引物kdrDIGLongF和kdrDIGLongR进行PCR扩增,得到长度为325 bp的片段,限制性内切酶MluCⅠ可将带含有1014F突变位点的等位基因产物酶切为长度为170、95和60 bp的3个片段,将不含1014F突变位点的等位基因酶切为长度为230、95 bp的2个片段[4],见图 2。
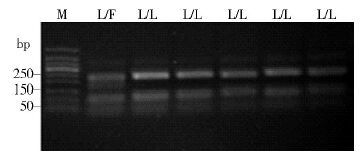
|
| 注: M. 分子质量标准; L/F. 1014位点杂合型; L/L. 1014位点敏感纯合型。 图 2 MluCⅠ酶切分型结果 Figure 2 Restriction digest of amplified Vssc fragments by enzyme MluCⅠ |
| |
综合上述2个PCR酶切结果,检测样本中共发现4个个体基因型为抗性杂合子(1014L/F),占检测个体数的6.35%,其他59个个体均为敏感纯合子,占93.65%(59/63),抗性等位基因(1014F)频率为 3.18%,见表 2。
2.3 家蝇样本ace抗性等位基因频率引物Md-Ace-F和Md-Ace-R经PCR扩增获得长度为609 bp的片段,采用Bsp1286Ⅰ和EaeⅠ酶的酶切产物图谱可对PCR产物进行基因分型[5]。在检测的38只家蝇样品中,共发现2种基因型,即342G/A和342A/V,其中342G/A为敏感与抗性杂合子,频率为5.26%; 342A/V为双突变型杂合子,频率为94.74%,酶切结果见图 3。抗性等位基因频率总和(342A+342V)为97.37%,见表 2。
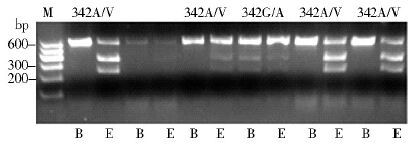
|
| 注: M. 分子质量标准; B. Bsp1286Ⅰ酶切; E. EaeⅠ酶切。 图 3 北海市家蝇Bsp1286Ⅰ和EaeⅠ酶切结果 Figure 3 Restriction digest of amplified ace fragments by Bsp1286Ⅰ and EaeⅠ |
| |
家蝇抗药性分子机制的研究进展为抗药性检测提供了分子手段。细胞色素P450 CYP6D1的过量表达已被证实可导致家蝇对拟除虫菊酯类杀虫剂产生抗性[4]。CYP6D1基因的5′端在抗性家蝇中有一段长15 bp的片段插入,该插入会增加CYP6D1基因的转录,从而增加CYP6D1酶的量而加速对含有苯氧苄基的拟除虫菊酯类杀虫剂的解毒作用[7],该插入因打断了1个Hpy188Ⅲ内切酶的酶切位点,因此,被用于抗性等位基因检测的分子标记。在本研究检测北海市的家蝇样本中,未发现CYP6D1抗性纯合个体,杂合个体频率为3.17%,而敏感纯合个体所占比例高达96.83%。CYP6D1抗性等位基因频率仅为1.59%,与济南地区接近,远低于广东和北京种群[2]。细胞色素P450介导的杀虫剂代谢作用增强是昆虫产生抗药性的普遍机制,CYP6D1抗性等位基因在检测样品中频率低,预示样品采集地区的家蝇保持了对拟除虫菊酯类杀虫剂的敏感性。另一种可能性是家蝇存在其他细胞色素P450介导的抗性机制[1, 8]。
昆虫的钠离子通道是拟除虫菊酯类和DDT(滴滴涕)农药的作用靶标。以往研究表明,钠离子通道1014位点的氨基酸点突变会导致昆虫对拟除虫菊酯类和DDT产生抗性。在家蝇中已发现两种不同的1014位点的抗性突变[2, 4],即苯丙氨酸(1014F)和组氨酸(1014H)[2],其中1014F突变导致的抗性高于1014H[4]。在北海市的63只家蝇个体中,检测到抗性杂合1014L/F个体的频率为6.35%,敏感纯合1014L/L个体频率高达93.65%,未发现1014H突变。家蝇种群抗性等位基因类型单一(1014F),且频率很低(3.18%),表明钠离子通道1014位点点突变抗性机制对该地区家蝇的抗药性贡献不大。
昆虫的AChE是有机磷和氨基甲酸酯类杀虫剂的作用靶标。至今已在杀虫剂抗性品系中鉴定了多个与抗性相关的遗传变异[2, 9-10]。生理生化证据已证明家蝇AChE的342位点氨基酸突变可以降低昆虫对有机磷和氨基甲酸酯类杀虫剂的敏感性[9]。在家蝇AChE的342位点发现了两种抗性相关的点突变,即G342A 和G342V[2, 9-10]。理论上342位点可以有6种不同的基因型,但在检测的38只家蝇个体中,只检测到两种基因型,即342G/A和342A/V,其频率分别为5.26%和94.74%,而未检测到在我国其他地区存在的342A/A 基因型[2]。342A和342V均为抗性基因型,在本样本中的频率高达97.37% (342A+342V),该结果与我国广东等5省的检测结果类似[2]。现有的研究结果显示,AChE抗性突变以高频率广泛存在于我国家蝇野生种群中,可能与这些地区大规模、长期使用有机磷和氨基甲酸酯类杀虫剂有关。
从北海市家蝇样本来看,CYP6D1和Vssc抗性等位基因的频率均较低,推断该地区的家蝇对拟除虫菊酯类和DDT杀虫剂的抗性程度极低,现场可继续用拟除虫菊酯类杀虫剂进行防控。相反,由于样本中检出AChE抗性等位基因频率极高,因此,在该地区应减少使用有机磷类和氨基甲酸酯类杀虫剂。
| [1] | 邱星辉. 细胞色素P450在家蝇抗药性中的作用[J]. 中国媒介生物学及控制杂志, 2014, 25(6): 591–593. |
| [2] | Wang QM, Li M, Pan J, et al. Diversity and frequencies of genetic mutations involved in insecticide resistance in field populations of the house fly(Musca domestica L.)from China[J]. Pestic Biochem Physiol, 2012, 102(2) : 153–159 .DOI:10.1016/j.pestbp.2011.12.007. |
| [3] | Scott JG, Leichter CA, Rinkevihc FD, et al. Insecticide resistance in house flies from the United States:resistance levels and frequency of pyrethroid resistance alleles[J]. Pestic Biochem Physiol, 2013, 107(3) : 377–384 .DOI:10.1016/j.pestbp.2013.10.006. |
| [4] | Rinkevich FD, Zhang L, Hamm RL, et al. Frequencies of the pyrethroid resistance alleles of Vssc1 and CYP6D1 in house flies from the eastern United States[J]. Insect Mol Biol, 2006, 15(2) : 157–167 .DOI:10.1111/imb.2006.15.issue-2. |
| [5] | Qiu XH, Pan J, Li M, et al. PCR-RFLP methods for detection of insecticide resistance-associated mutations in the house fly (Musca domestica)[J]. Pestic Biochem Physiol, 2012, 104(3) : 201–205 .DOI:10.1016/j.pestbp.2012.08.002. |
| [6] | Seifert J, Scott JG. The CYP6D1v1 allele is associated with pyrethroid resistance in the house fly, Musca domestica[J]. Pestic Biochem Physiol, 2002, 72(1) : 40–44 .DOI:10.1006/pest.2001.2577. |
| [7] | Tomita T, Scott JG. cDNA and deduced protein sequence of CYP6D1:the putative gene for a cytochrome P450 responsible for pyrethroid resistance in house fly[J]. Insect Biochem Molec Biol, 1995, 25(2) : 275–283 .DOI:10.1016/0965-1748(94)00066-Q. |
| [8] | Gao Q, Li M, Sheng CF, et al. Multiple cytochrome P450s overexpressed in pyrethroid resistant house flies (Musca domestica)[J]. Pestic Biochem Physiol, 2012, 104(3) : 252–260 .DOI:10.1016/j.pestbp.2012.09.006. |
| [9] | Walsh SB, Dolden TA, Moores GD, et al. Identification and characterization of mutations in housefly (Musca domestica) acetylcholinesterase involved in insecticide resistance[J]. Biochem J, 2001, 359(1) : 175–181 .DOI:10.1042/bj3590175. |
| [10] | 邱星辉. 家蝇抗药性的分子机制:乙酰胆碱酯酶介导的抗药性[J]. 寄生虫与医学昆虫学报, 2014, 21(2): 134–137. |
 2017, Vol. 28
2017, Vol. 28



