扩展功能
文章信息
- 张瑞玲, 姚广琴, 潘晓倩, 赵爱华, 马德珍, 张忠
- ZHANG Rui-ling, YAO Guang-qin, PAN Xiao-qian, ZHAO Ai-hua, MA De-zhen, ZHANG Zhong
- 不同地理种群白纹伊蚊感染Wolbachia的检测和系统发育分析
- Detection and phylogenetic analysis of Wolbachia in Aedes albopictus from different geographical populations
- 中国媒介生物学及控制杂志, 2017, 28(1): 9-11
- Chin J Vector Biol & Control, 2017, 28(1): 9-11
- 10.11853/j.issn.1003.8280.2017.01.003
-
文章历史
- 收稿日期: 2016-09-27
- 网络出版时间: 2016-12-06 17:10
2 泰山医学院基础医学院, 山东 泰安 271016;
3 泰安市疾病预防控制中心, 山东 泰安 271000
2 Department of Pathogenic Biology of Taishan Medical University;
3 Taian Center for Disease Control and Prevention
白纹伊蚊(Aedes albopictus)是登革热、黄热病、基孔肯雅热和西尼罗热等多种疾病的重要传播媒介。近些年来,蚊媒病在全球流行呈现明显增加趋势,其中许多是传播力强、流行面广、发病率高、危害性大的疾病,已经成为世界性的公共卫生问题[1]。当前,由于登革热及登革出血热尚无特效药物和疫苗,对传播媒介白纹伊蚊的防制是预防和控制登革热疫情的主要手段。
沃尔巴克氏体(Wolbachia)隶属于变形菌门(Proteobacteria)、α亚纲(Alphaproteobacteria)、立克次体目(Rickettsiales)、立克次体科(Rickettsiaceae)的沃尔巴克氏体属(Wolbachia),是一类母性遗传的革兰阴性细菌,在节肢动物体内广泛存在。由于Wolbachia可以通过诱导宿主间杂交的胞质不相融合(cytoplasmic incompatibility,CI)、诱导单性生殖(parthenogenesis-inducing,PI)、雌性化(feminizing)和杀雄作用(male-killing)等机制改变和影响其宿主的繁殖,因而被用于生物防治[2-3]。该方法具有可持续、高效能、绿色环保以及无生物安全隐患等特点,尤其在蚊虫及蚊媒病控制方面引起国内外研究者的广泛关注[4]。蚊虫感染不同类型的Wolbachia对其繁殖力和病毒的抵抗力有不同的影响,区分不同基因型的Wolbachia是将其应用于蚊媒防制的前提和关键[5]。基于wsp基因序列,Zhou等[6]将节肢动物体内寄生的Wolbachia分为A~H等8个群(group),其中A和B群只在昆虫、螨类和甲壳动物中出现。A群又可分为8个亚群,B群分为4个亚群。本研究基于对我国多个白纹伊蚊地理种群广泛采样的基础上,分析Wolbachia感染情况和类型,为更好地利用Wolbachia开展蚊虫和蚊媒病的防控提供基础资料。
1 材料与方法 1.1 样品获取和基因组DNA提取白纹伊蚊样本分别采自山东、陕西、福建、四川、云南、广西、广东、湖南、江西、浙江、江苏、台湾、贵州省(自治区)13个地理种群。所有标本浸泡于95%无水乙醇中,于-20 ℃保存备用。基于形态学特征对采集样本进行物种鉴定。
取单只个体,使用组织/细胞 DNA 快速提取试剂盒(北京全式金生物技术有限公司),按说明书步骤提取DNA,于-20 ℃保存备用。
1.2 wsp基因的扩增和测序参考Zhou等[6]扩增wsp基因的通用引物,上游引物为81F:5′-TGG TCC AAT AAG TGA TGA AGA AAC-3′,下游引物为691R:5′-AAA AAT TAA ACG CTA CTC CA-3′。采用25 μl反应体系:包括2 μl模板DNA,17 μl H2O,2.5 μl 10×Buffer,1 μl dNTPs (10 mmol/L),上游和下游引物(10 μmol /L)各1 μl,以及0.5 μl Taq DNA聚合酶。反应条件为94 ℃预变性3 min,94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1 min,共35个循环;72 ℃后延伸7 min。扩增反应结束后,取3 μl PCR产物于琼脂糖凝胶(1%)上,置于电泳槽中进行电泳(120 V,30 min)检测,电泳缓冲液为1×TAE。同时,电泳过程中选用DNA Marker 进行目的基因长度的确认,PCR产物经电泳检测后,送北京六合华大基因科技有限公司进行纯化和测序。
1.3 wsp基因序列的测定与系统发育分析所得双向测序结果利用DNAStar 7.1(DNAStar,Inc. 1996)软件包中的Seqman程序进行序列拼接和编辑,确定序列的方向,然后将这些序列在NCBI中进行Blast同源性比对,以确保所得到的是目标序列。
将所有wsp基因序列在Mega 5.0软件中进行比对[7],分析基因的基本特征,在Megalign中分析序列核酸和氨基酸同源性。采用邻接法(Neighbor-Joining,NJ)构建系统发育树,各个分支的Bootstrap置信度用1 000次重复检验。
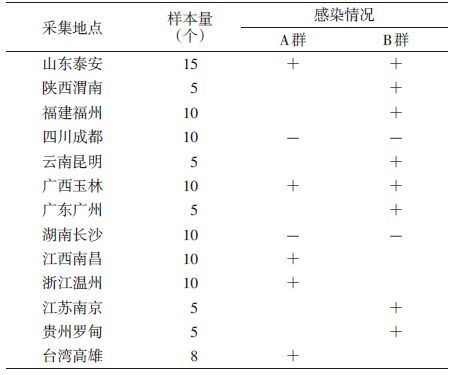
2 结果 2.1 白纹伊蚊的感染情况在13个采样点中,除成都和长沙外,其他11个地理种群的白纹伊蚊样品中均检测到Wolbachia阳性,见表 1。其中南昌、温州和高雄的白纹伊蚊种群感染有A群的Wolbachia,渭南、福州、昆明、广州、南京和罗甸6个种群中检测到B群,而在泰安和玉林种群中发现A群和B群的共同感染。
获取的18条wsp基因序列拼接、比对后序列长度在570~605 bp之间。参照Zhou等[6]基于wsp基因对Wolbachia亚群的分型依据,经核苷酸同源性比较和一致性分析后发现,本研究中白纹伊蚊感染A群的均为wAlbA亚群,感染B群的包括wPip和wAlbB两个亚群,序列相似度在97%~99%之间。属于A群的wsp基因序列长度为590 bp,其中保守位点572个、可变位点18个、简约信息位点8个,碱基A、T、G、C的平均含量分别为31.7%、31.3%、16.2%和20.8%。B群的wsp基因序列长度为570 bp,保守位点549个、可变位点21个、简约信息位点13个,碱基A、T、G、C的平均含量分别为30.5%、31.1%、15.8%和22.6%。
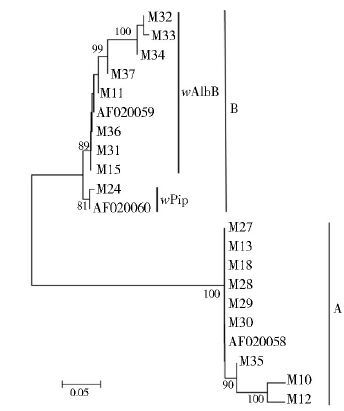
将获取的18条wsp基因序列与GenBank下载的wAlbA亚群(GenBank登录号:AF020059)、wPip(GenBank登录号:AF020060)和wAlbB(GenBank登录号:AF020059)参考序列共同进行系统发育分析,选择以Tajima-Nei model为模型构建NJ树(图 1)。系统发育分析显示,所有的wsp序列聚成两大支,其中9条wsp序列与AF020058聚成A群;另外9条wsp序列与AF020060和AF020059聚成B群,支持率均为100%。B群的分支中,M24与AF020060聚成一支,支持率为81%,其余8条序列与AF020059聚成一支,支持率为89%。
|
| 图 1 基于wsp基因序列的Wolbachia系统发育分析 Figure 1 Phylogenetic analysis of Wolbachia based on wsp gene |
| |
白纹伊蚊具有扩散能力强、环境可塑性高等特点,且与人类关系密切,分布区易受人为因素影响,携带有蚊卵和幼虫的废旧轮胎及金属容器等是其向潜在适生区扩散的常见方式。随着全球气候变暖,地理环境和生物群落均随之发生改变,白纹伊蚊的密度及其地理分布也在发生变化,蚊媒病的发生、流行及扩散趋势也将会出现变化[8]。目前蚊虫的防控主要依靠化学杀虫剂,然而化学药物的长期使用也带来了一些副作用,如环境污染、生态环境的破坏和蚊虫抗药性增强等。Wolbachia经母系遗传,通过在宿主体内产生细胞质不亲和、孤雌生殖、雌性化及杀雄作用等多种生殖调控作用,其中调控节肢动物生殖的最普遍方式是诱导宿主的胞质不亲和[3]。胞质不亲和作用包括单向不亲和与双向不亲和两种形式,单向胞质不亲和是指感染了Wolbachia的雄蚊与未感染Wolbachia的雌蚊交配产生的后代不能正常发育;而感染不同类型Wolbachia的白纹伊蚊雌雄个体间交配,产生的子代将出现双向胞质不相容而不能存活,从而起到降低白纹伊蚊种群密度的作用。基于胞质不亲和原理,研究人员已经成功利用共生菌Wolbachia作为一种生物制剂以减少蚊虫种群数量和阻断登革热病毒传播,并取得重大进展[9-10]。
本研究通过扩增Wolbachia外膜蛋白基因wsp对我国多个地理种群白纹伊蚊自然感染情况进行了初步探讨,序列分析证实我国多个地理种群的白纹伊蚊均感染Wolbachia。基于序列同源性比较和系统发育分析的结果证实,我国白纹伊蚊种群感染的Wolbachia主要是A群的wAlbA亚群、B群的wAlbB亚群和wPip亚群。这一结果将有助于更好地指导在不同地理区域有针对性地释放和增加感染有特定类型的白纹伊蚊,提高基于胞质不亲和作用防控技术的效率,进一步做好蚊媒病的防控。应该指出的是,由于本研究所涉及的地理群体和研究样品较少,上述研究结果并不排除在其他未取样地区存在不同或与现有结果不一致的现象。增大样本量和种群覆盖面,研究结果将会更加客观。
| [1] | Beebe NW, Ambrose L, Hill LA, et al. Tracing the tiger:population genetics provides valuable insights into the Aedes(Stegomyia) albopictus invasion of the Australasian region[J]. PLoS Negl Trop Dis, 2013, 7(8) : e2361.DOI:10.1371/journal.pntd.0002361. |
| [2] | Blagrove MSC, Arias-Goeta C, Failloux AB. Wolbachia strain wMel induces cytoplasmic incompatibility and blocks dengue transmission in Aedes albopictus[J]. Proc Natl Acad Sci USA, 2012, 109(1) : 255–260 .DOI:10.1073/pnas.1112021108. |
| [3] | Stouthamer R, Breeuwer JAJ, Hurst GDD. Wolbachia pipientis:microbial manipulator of arthropod reproduction[J]. Annu Rev Microbiol, 1999, 53(1/2) : 71–102 . |
| [4] | Bourtzis K, Dobson SL, Xi ZY, et al. Harnessing mosquito-Wolbachia symbiosis for vector and disease control[J]. Acta Trop, 2014, 132(Suppl) : S150–163 . |
| [5] | 郭颂, 凌锋, 王金娜, 等. 浙江省中东部白纹伊蚊共生菌沃尔巴克氏体的调查研究[J]. 中国媒介生物学及控制杂志, 2015, 26(6): 545–549. |
| [6] | Zhou WG, Rousset F, O' Neill S. Phylogeny and PCR-based classification of Wolbachia strains using wsp gene sequences[J]. Proc Biol Sci, 1998, 265(1395) : 509–515 .DOI:10.1098/rspb.1998.0324. |
| [7] | Tamura K, Dudley J, Nei M, et al. MEGA4:molecular evolutionary genetics analysis(Mega)software version 4.0[J]. Mol Biol Evol, 2007, 24(8) : 1596–1599 .DOI:10.1093/molbev/msm092. |
| [8] | 刘起勇. 气候变化对媒介生物性传染病的影响[J]. 中华卫生杀虫药械, 2013, 19(1): 1–7. |
| [9] | Alphey L, Benedict M, Bellini R, et al. Sterile-insect methods for control of mosquito-borne diseases:an analysis[J]. Vector Borne Zoonotic Dis, 2010, 10(3) : 295–311 .DOI:10.1089/vbz.2009.0014. |
| [10] | Hurwitz I, Fieck A, Read A, et al. Paratransgenic control of vector borne diseases[J]. Int J Biol Sci, 2011, 7(9) : 1334–1344 . |
 2017, Vol. 28
2017, Vol. 28