扩展功能
文章信息
- 李凯利, 高景鹏, 曹洁, 马雅军
- LI Kai-li, GAO Jing-peng, CAO Jie, MA Ya-jun
- 3种植物浸液对白纹伊蚊产卵的影响研究
- Oviposition responses of Aedes albopictus to three plant infusions
- 中国媒介生物学及控制杂志, 2017, 28(1): 4-8
- Chin J Vector Biol & Control, 2017, 28(1): 4-8
- 10.11853/j.issn.1003.8280.2017.01.002
-
文章历史
- 收稿日期: 2016-08-30
- 网络出版时间: 2016-12-06 17:10
2 第二军医大学热带医学与公共卫生学系热带传染病学教研室, 上海 200433
2 Department of Tropical Infectious Diseases, Faculty of Tropical Medicine and Public Health, Second Military Medical University
白纹伊蚊(Aedes albopictus)是登革热和基孔肯雅热等虫媒疾病的重要传播媒介[1],也可传播寨卡病毒。该蚊也是全球最具入侵能力的生物之一[2],目前已广泛分布于热带、亚热带和温带地区[3-4]。白纹伊蚊的广泛分布为其在全球范围传播疾病提供了条件,WHO估计全球约25亿人口受登革热威胁,每年超过1亿人感染登革热病毒。近年来,我国的登革热疫情形势严峻,尤其是2014年广东省大规模暴发流行登革热疫情,报告病例超过45 000例[5]。登革热和寨卡病毒病尚无有效疫苗,控制传播媒介是目前甚至较长时间内唯一有效的方法。通过研究影响蚊虫产卵的因素,从而采取有效措施从源头上减少蚊虫数量,达到控制蚊虫的目的。影响蚊虫产卵的因素非常复杂,内因主要是蚊虫自身虫卵发育和产出能力,外因主要是孳生地对产卵的引诱或驱避作用[6]。蚊虫在长期的演化过程中形成产卵行为和对孳生地的趋向性,实验室的白纹伊蚊白天产卵比例高于夜晚,选择的产卵水体与其中化合物种类及浓度、容器颜色和布放位置等存在相互关系,部分现场实验得以证实[7-18]。白纹伊蚊喜在有植物的水体中产卵,实验室初步观察某些植物浸液对其有一定的诱集产卵活性[14]。本研究在实验室筛选具有诱集白纹伊蚊产卵的植物浸液,通过现场验证后,应用气相色谱-质谱联用仪(GC-MS)检测其中的挥发性化合物,为监测白纹伊蚊密度、消除孳生地及诱集灭杀等提供理论基础。
1 材料与方法 1.1 试虫采用实验室品系和现场白纹伊蚊进行测试。实验室品系2005年采自浙江省杭州市野外,长期在养蚊室饲养和传代,饲养条件为温度(26±1)℃,湿度(60±5)%,光周期L∶D=12 h∶12 h。于2015年8月在海南省海口市市区进行现场实验。
1.2 植物浸液的制备2014年7-8月,采集上海市浦东区草地的狗牙根(Cynodon dactylon)、四川省和重庆市的稻草(Oryza sativa)及浙江省莫干山的竹叶(Bambusaceae),室温自然晾干至恒重后,剪碎,称取6 g,加入1 L灭菌水,混匀,静置于养蚊室浸泡,每10 d收集1次浸泡液,至第80天结束,收集的浸液用于诱集产卵实验。
1.3 实验室诱集产卵方法在40 cm×30 cm×30 cm的蚊笼内放入500只蛹,待其羽化后,常规饲血,3~4 d后在蚊笼内对角线位置,放入2个产卵杯,分别为稀释50%的植物浸液的实验组和对照组灭菌水各30 ml,产卵杯在蚊笼内放置24 h进行诱集产卵,定期更换两者位置;每组实验设3次重复。取出产卵杯后,记录产卵数,计算诱卵率和产卵活跃指数(oviposition activity index,OAI)[19],计算公式:
诱卵率=实验组卵数/(实验组卵数+对照组卵数)
OAI=(实验组卵数-对照组卵数)/(实验组卵数+对照组卵数)
诱卵率>50%,OAI为正数时,则实验组对产卵具有引诱作用;反之,为驱避作用。若OAI>0.3,则实验组具有明显的诱集产卵效果,数值越大诱集效果越好[20]。
1.4 现场诱集产卵方法 1.4.1 蚊密度测定在海南省海口市某单位的菜地,利用人诱法测定现场的白纹伊蚊密度,即在10:00或16:00左右,1名志愿者裸露胳膊或小腿5 min,另1名人员手持吸蚊器吸取停落在裸露皮肤上的蚊虫,记录捕捉蚊虫数量,依据外部形态特征进行种类鉴定[1]。
1.4.2 现场诱集产卵和数据统计在现场放置诱蚊诱卵器诱集蚊虫产卵,实验组诱蚊诱卵器中为浸泡不同时间稀释50%的稻草或竹叶浸液(依据实验室的诱集产卵效果选择),对照组为灭菌水,各30 ml,诱蚊诱卵器间相距约2 m,每2 d更换1次位置,使每个诱蚊诱卵器在每个位置放置时间相同,完成一轮实验共换3次位置,6 d后回收诱蚊诱卵器,取出其中的产卵纸,对卵进行计数,计算诱卵率和OAI。每轮实验设2次重复。
1.5 GC-MS测定植物浸液中的化合物采用乙醚萃取法萃取植物浸液中的挥发性化合物,送至复旦大学测试中心应用GC-MS(Voyage 2000 GC/MS,Finnigan,USA)进行检测,加入0.3 ml乙酸乙酯溶解萃取物,取1.5 μl样液加入DB-WAX柱形毛细管,恒线速度1 ml/min,分流比为200∶1的氦气作为载体流。参数设置为起始温度50 ℃,2 min,之后每1 min增加10 ℃,直至300 ℃,持续10 min,进样温度为250 ℃,电离源温度为200 ℃,电子轰击电离源(EI 70eV)。
2 结果 2.1 实验室植物浸液对白纹伊蚊的诱卵活性平均诱卵率和OAI结果显示,稻草和竹叶浸液具有诱集白纹伊蚊产卵的活性,而狗牙根浸液未见诱集活性,狗牙根浸液的OAI均<0.30。稻草和竹叶浸泡时间越长,诱集产卵的活性越好。稻草除浸泡20 d外,其他浸泡时间平均OAI均>0.30,在60和70 d时引诱效果明显,平均OAI>0.55。
竹叶在浸泡前40 d的4个时间段,OAI均<0.30,在浸泡50、60和70 d时,浸液对白纹伊蚊诱集产卵活性越来越强,60和70 d时平均OAI>0.65,见表 1。

|
人诱法测试白纹伊蚊密度平均>8只/(人·5 min)时,即符合诱卵实验条件。现场实验选择浸泡50、70和80 d的稻草和竹叶浸液为实验组,3个浸泡时间的稻草和竹叶浸液均具有明显的白纹伊蚊诱卵活性,以浸泡50 d 的稻草和竹叶诱卵效果最好,平均诱卵率为96.17%和89.51%,平均OAI为0.93和0.79,见表 2。

|
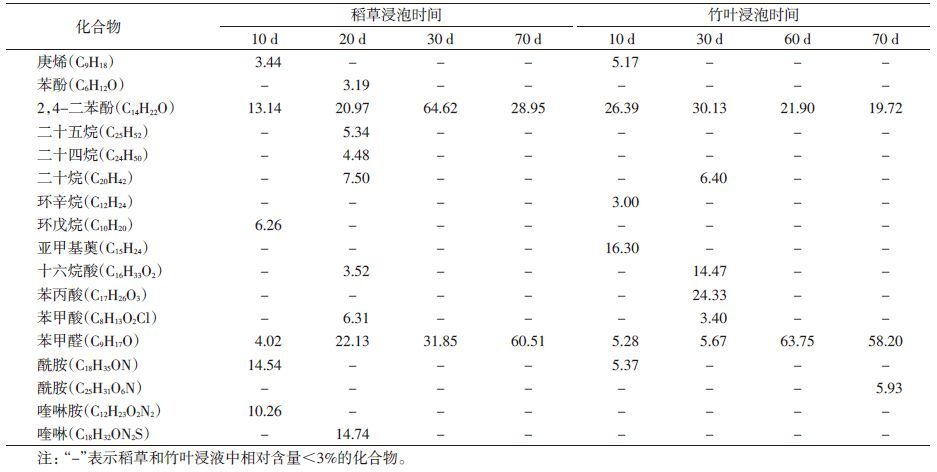
根据实验室和现场植物浸液对白纹伊蚊的诱集产卵效果,选择稻草及竹叶浸泡10和70 d,以及OAI值变化明显时间段的浸液,共8个样本进行GC-MS分析。检测和鉴定化合物种类,稻草浸液108种、竹叶浸液97种,见图 1。统计和分析其中相对含量≥3%的化合物,共17种,见表 3。根据化学成分归类为烷类、烃类、酚类和酯类等,其中2,4-二苯酚(C14H22O)和苯甲醛(C9H17O)在8个样本中均存在。苯酚(C6H12O)、二十五烷(C25H52)、二十四烷(C24H50)、环戊烷(C10H20)、喹啉胺(C12H23O2N2)和喹啉(C18H32ON2S)仅在稻草浸液样本中存在;环辛烷(C12H24)、亚甲基薁(C15H24)、苯丙酸(C17H26O3)和酰胺(C25H31O6N)仅在竹叶浸液样本中存在。稻草浸液中含量较高的成分为2,4-二苯酚、苯甲醛、酰胺(C18H35ON)和喹啉(C18H32ON2S);竹叶浸液中含量较高的成分为2,4-二苯酚、苯甲醛、苯丙酸、亚甲基薁和十六烷酸(C16H33O2)。
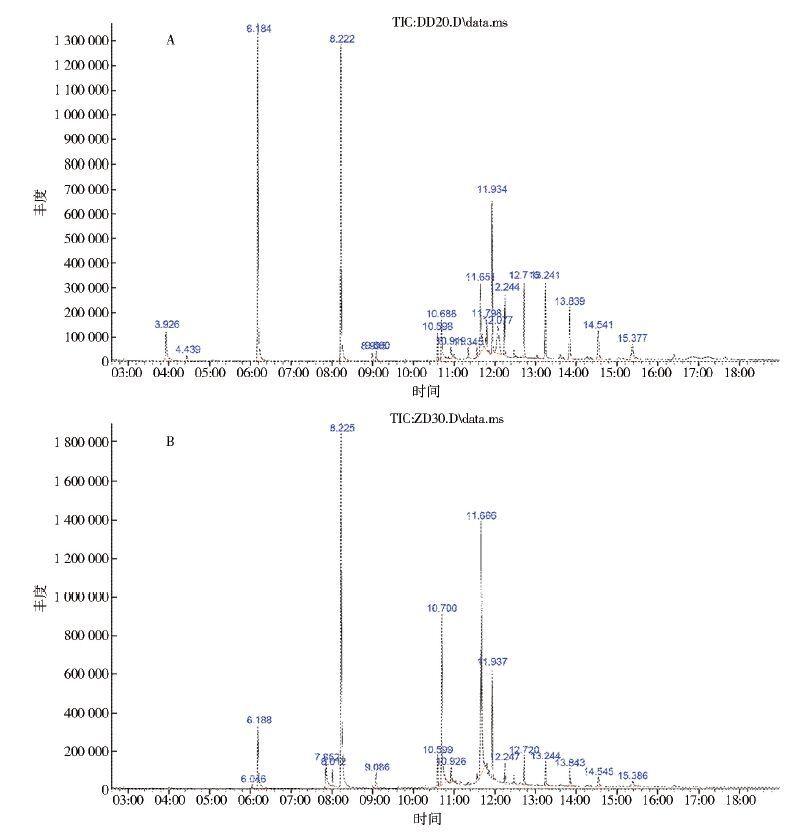
|
| 注: A. 浸泡稻草20 d; B. 浸泡竹叶30 d。 图 1 GC-MS检测稻草和竹叶浸液结果 Figure 1 GC-MS chromatogram results of O. sativa and Bambusaceae infusions |
| |
|
不同植物浸液对埃及伊蚊(Ae.aegypti)和白纹伊蚊的产卵均有一定的引诱作用[8-9, 14],现场采集人员相关经验也证实,且有厂家已将植物浸液制成引诱剂作为商品出售(www.suterra.com)。但不同地区植物种类和品种不同,且白纹伊蚊产卵有随机性行为[16],因此,不同地区相同植物浸液对白纹伊蚊的诱卵效果有所差异。本次实验室筛选和现场评价诱集产卵实验均易受白纹伊蚊本身产卵习性和外界环境影响,如60 d的植物浸液在现场实验中结果一直不稳定。为避免实验误差,研究者应在饲养蚊虫时尽量标准化,应用每只雌蚊的产卵数量(60~80枚)评价该批次白纹伊蚊是否正常产卵,并定时变换蚊笼内实验组和对照组的诱卵杯位置;在现场,除保证实验时白纹伊蚊密度外,还需选择相对单一环境,布放诱蚊诱卵罐时应远离可产生刺激性气味的垃圾、水沟和植物等;实验所用的植物浸液也应为相同条件下浸泡的不同批次。本次调查显示,采用诱卵率和OAI两个指标,前者是实验组产卵数多于对照组,平均诱卵率>50%,即认为有诱集作用;而后者的OAI>0.30时,判断其具有诱集产卵的效果[9],相比而言,OAI指标避免随机性产生的误差,更加合理。
本研究对多种植物进行了浸泡条件的摸索及不同浸泡时间植物浸液在实验室对白纹伊蚊诱集产卵的预实验,发现竹叶和稻草浸液具有明显诱集活性,且浸泡时间越长,诱集产卵效果越好,现场及实验室结果基本一致,在自然界中也观察到白纹伊蚊倾向于在竹筒积水内产卵[7]。植物浸液具有绿色环保、廉价等特点,已被广泛用于蚊虫产卵的影响研究。实验室和野外现场研究均表明,白纹伊蚊在水栎(Quercus nigra)叶、长叶松(Pinus palustris)叶和圣奥古斯汀草(Stenotaphrum secundatum)、竹叶、玉兰(Magnolia grandiflora)叶、狗尾草(Green bristlegrass)和绊根草(Cynodondactylon)浸液中的产卵数明显多于对照组[14, 20]。而本研究的狗牙根浸液诱集产卵效果并不理想,提示不同植物浸液成分存在差异,相同成分含量不同诱集产卵活性也有差异,如巨型水绵(Spirogyra majusula)提取物浓度为1%、10%和100%时,对伪点按蚊(Anopheles pseudopunctipennis)的产卵为抑制作用,而当浓度为0.1%、0.01%和0.001%时,对产卵具有诱导和促进作用[21]。
蚊虫依赖嗅觉系统寻找宿主、产卵地或避免驱避剂,蚊虫的触须和下颚须中的嗅觉神经元可识别气味,产卵地的挥发性化合物可被蚊虫识别,以改变其产卵行为[22-23]。研究发现,影响蚊虫产卵的化合物主要有醚类、酯类、醋酸盐、烷类、氯化钠(盐)、酰胺类、蛋白质和糖类等[24-26]。相同化合物对不同蚊种产卵的影响不同,如正二十三烷和正二十一烷可抑制长纹脉毛蚊(Culiseta longiareolata)产卵,但对冈比亚按蚊(An.gambiae)产卵却无该作用[27]。GC-MS检测结果显示,在诱卵效果明显的时间内,2,4-二苯酚和苯甲醛含量均较高,提示两种化合物可能是诱集雌蚊产卵的关键化合物。醇类、醛类和酯类化合物一般有香气、低沸点,具有高流动性,其丰度和种类差异,可形成不同气味[28]。本研究植物浸液中存在多种上述化合物,且丰度有差异,影响白纹伊蚊对产卵地的选择是肯定的,故此诱集孕蚊产卵的成分也可能是由多种化合物形成。
志谢: 现场实验得到海口市疾病预防控制中心王晓花、林怡、林春燕和林忠岭等帮助,特此志谢| [1] | 陆宝麟. 中国动物志. 昆虫纲. 第8卷. 双翅目:蚊科(上)[M]. 北京: 科学出版社, 1997: 243-245. |
| [2] | Bonizzoni M, Gasperi G, Chen XG, et al. The invasive mosquito species Aedes albopictus:current knowledge and future perspectives[J]. Trends Parasitol, 2013, 29(9) : 460–468 .DOI:10.1016/j.pt.2013.07.003. |
| [3] | Enserink M. Entomology:a mosquito goes global[J]. Science, 2008, 320(5878) : 864–866 .DOI:10.1126/science.320.5878.864. |
| [4] | Miller MJ, Loaiza JR. Geographic expansion of the invasive mosquito Aedes albopictus across Panama-implications for control of dengue and Chikungunya viruses[J]. PLoS Negl Trop Dis, 2015, 9(1) : e0003383.DOI:10.1371/journal.pntd.0003383. |
| [5] | 孟凤霞, 王义冠, 冯磊, 等. 我国登革热疫情防控与媒介伊蚊的综合治理[J]. 中国媒介生物学及控制杂志, 2015, 26(1): 4–10. |
| [6] | 李凯利, 马雅军, 曹洁. 蚊虫产卵影响因子的研究新进展[J]. 中国病原生物学杂志, 2016, 11(7): 675–678. |
| [7] | 乔树海, 宋传德, 赵树公. 白纹伊蚊产卵习性初步观察[J]. 医学动物防制, 1991, 7(2): 91–92. |
| [8] | Yu KX, Wong CL, Ahmad R, et al. Mosquitocidal and oviposition repellent activities of the extracts of seaweed Bryopsis pennata on Aedes aegypti and Aedes albopictus[J]. Molecules, 2015, 20(8) : 14082–14102 .DOI:10.3390/molecules200814082. |
| [9] | Sharma KR, Seenivasagan T, Rao AN, et al. Oviposition responses of Aedes aegypti and Aedes albopictus to certain fatty acid esters[J]. Parasitol Res, 2008, 103(5) : 1065–1073 .DOI:10.1007/s00436-008-1094-1. |
| [10] | 郝蕙玲. 蚊虫引诱因子及其在诱杀技术中的应用[J]. 中华卫生杀虫药械, 2014, 20(4): 297–302. |
| [11] | 邓天福, 莫建初, 程家安. 白纹伊蚊产卵引诱物研究[J]. 浙江大学学报:农业与生命科学版, 2009, 35(5): 532–536. |
| [12] | 邓天福, 莫建初. 糖和维生素对淡色库蚊及白纹伊蚊产卵选择的影响[J]. 中国媒介生物学及控制杂志, 2011, 22(2): 114–116. |
| [13] | 邓天福, 刘吉起, 莫建初. 蛋白质和氨基酸对2种蚊虫产卵选择的影响[J]. 中国媒介生物学及控制杂志, 2012, 23(1): 51–53. |
| [14] | 张令要, 张险峰, 岳木生, 等. 不同植物浸液对白纹伊蚊的产卵引诱作用[J]. 昆虫知识, 2008, 45(2): 251–255. |
| [15] | 张令要, 雷朝亮. 嗅觉和视觉引诱物对白纹伊蚊产卵行为的影响[J]. 寄生虫与医学昆虫学报, 2012, 19(1): 25–28. |
| [16] | 李志强, 钟俊鸿, 肖维良, 等. 登革热媒介白纹伊蚊产卵的习惯化行为及可持续控制[J]. 广东农业科学, 2010, (9): 186–188. |
| [17] | 任旭琦, 刘彬, 向文龙, 等. 酵母来源的CO2在不同环境下的诱蚊效果[J]. 热带医学杂志, 2009, 9(6): 637–639. |
| [18] | 于德宪, 周文, 任旭琦, 等. 诱蚊诱卵器与诱引剂结合对白纹伊蚊的诱引作用[J]. 中国媒介生物学及控制杂志, 2009, 20(6): 507–510. |
| [19] | Kramer WL, Mulla MS. Oviposition attractants and repellents of mosquitoes:oviposition responses of Culex mosquitoes to organic infusions[J]. Environ Entomol, 1979, 8(6) : 1111–1117 .DOI:10.1093/ee/8.6.1111. |
| [20] | Obenauer PJ, Allan SA, Kaufman PE. Aedes albopictus(Diptera:Culicidae) oviposition response to organic infusions from common flora of suburban Florida[J]. J Vector Ecol, 2010, 35(2) : 301–306 .DOI:10.1111/jvec.2010.35.issue-2. |
| [21] | Torres-Estrada JL, Meza-Alvarez RA, Cruz-López L, et al. Attraction of gravid Anopheles pseudopunctipennis females to oviposition substrates by Spirogyra majuscula (Zygnematales:Zygnmataceae) algae under laboratory conditions[J]. J Am Mosq Control Assoc, 2007, 23(1) : 18–23 .DOI:10.2987/8756-971X(2007)23[18:AOGAPF]2.0.CO;2. |
| [22] | Ponnusamy L, Xu N, Böröczky K, et al. Oviposition responses of the mosquitoes Aedes aegypti and Aedes albopictus to experimental plant infusions in laboratory bioassays[J]. J Chem Ecol, 2010, 36(7) : 709–719 .DOI:10.1007/s10886-010-9806-2. |
| [23] | Ray A. Reception of odors and repellents in mosquitoes[J]. Curr Opin Neurobiol, 2015: 158–164 .DOI:10.1016/j.conb.2015.06.014. |
| [24] | Mbare O, Lindsay SW, Fillinger U. Pyriproxyfen for mosquito control:female sterilization or horizontal transfer to oviposition substrates by Anopheles gambiae sensu stricto and Culex quinquefasciatus[J]. Parasit Vectors, 2014, 7(1) : 280.DOI:10.1186/1756-3305-7-280. |
| [25] | Seenivasagan T, Sharma KR, Prakash S. Electroantennogram, flight orientation and oviposition responses of Anopheles stephensi and Aedes aegypti to a fatty acid ester-propyl octadecanoate[J]. Acta Trop, 2012, 124(1) : 54–61 .DOI:10.1016/j.actatropica.2012.06.009. |
| [26] | Kuppusamy C, Murugan K. Skin and oviposition deterrent, ovicidal and deleterious delayed mortality effects of α-amyrin acetate against the malarial vector Anopheles stephensi(Diptera:Culicidae)[J]. J Entomol Res Soc, 2012, 14(3) : 39–53 . |
| [27] | Warburg A, Faiman R, Shtern A, et al. Oviposition habitat selection by Anopheles gambiae in response to chemical cues by Notonecta maculata[J]. J Vector Ecol, 2011, 36(2) : 421–425 .DOI:10.1111/jvec.2011.36.issue-2. |
| [28] | 邵明辉, 王雪青, 赵文越, 等. 板栗花精油的化学组成及对白纹伊蚊驱避作用研究[J]. 中国媒介生物学及控制杂志, 2015, 26(1): 62–65. |
 2017, Vol. 28
2017, Vol. 28


