扩展功能
文章信息
- 田建国, 黎桂福, 彭丽霞, 蒋守富, 张小萍, 李俊
- TIAN Jian-guo, LI Gui-fu, PENG Li-xia, JIANG Shou-fu, ZHANG Xiao-ping, LI Jun
- 采用3种钉螺孵化方法检测有螺土壤中活性螺卵的比较研究
- A comparative study on hatching active eggs of Oncomelania hupensis in soil by three methods
- 中国媒介生物学及控制杂志, 2017, 28(6): 600-602
- Chin J Vector Biol & Control, 2017, 28(6): 600-602
- 10.11853/j.issn.1003.8280.2017.06.022
-
文章历史
- 收稿日期: 2017-08-15
- 网络出版时间: 2017-10-10 14:00
2 湖南省中医药研究院附属医院, 长沙 410006;
3 上海市疾病预防控制中心, 上海 200336
2 The Attached Hospital of Chinese Medicine Institute of Hunan Province;
3 Shanghai Center for Disease Control and Prevention
钉螺(Oncomelania hupensis)是传播日本血吸虫(Schistosoma japonicum)的唯一中间宿主,可以通过多种媒介传播[1]。研究发现,泥土中含有可孵化的螺卵[2-3]。因此,含有钉螺螺卵的泥土可能作为介质传播钉螺。目前,对有螺地区泥土中钉螺螺卵的检测和泥土中螺卵孵化实验有2种方法,即显微镜下直接检查螺卵[4]和收集螺卵恒温孵化法[5]。研究证实,直接孵化法可检测出泥土中的活性螺卵,孵化出幼螺,该方法可作为泥土中检测钉螺方法的替代和补充[6],但在现场应用中还未得到验证。因此,采用3种检测方法在现场有螺土壤中进行螺卵孵化实验进行比较研究,现将结果报告如下。
1 材料与方法 1.1 采集地点于2016年5月8日,选择2014年新发现的上海市青浦区练塘镇星浜村朱家埭河和青松港附近断头浜有螺区作为采集点。
1.2 仪器电子天平(型号:JJ1000,江苏省常熟市双杰测量仪器厂产重校验设备有限公司);解剖镜(型号:SZX16,OLYMPUS,JAPAN)。
1.3 样品的采集和处理采用系统抽样法结合环境抽查法(双重查螺法)[7],确定并采集有螺地区土壤20块(用全球定位系统定位分别位于121°5′43″E,31°0′4″N;121°5′44″E,30°59′49″N;121°5′44″E,30°59′50″N)。每块土壤取样品体积为330 cm×330 cm×7 cm。带回实验室柔性混匀,每块土壤分别称取3份(每份500 g)。称取2份(各500 g)泥土,用双层箩筛水洗获得筛取物[5],2份筛取物分别放入2个小型搪瓷碗内,肉眼检查有无幼螺,加去氯水至搪瓷碗1/2处,在实验室分别采用收集螺卵恒温孵化法和改良直接孵化法进行孵化实验。
1.4 方法 1.4.1 收集螺卵恒温孵化法[5]将筛取物放入搪瓷碗内加去氯水,置22~23 ℃的恒温实验室进行孵化,每日观察1次,检查有无幼螺并记录。35 d后用去氯水淘洗后计数幼螺及其死活只数并获取筛取物。采用镜检法对未孵化的螺卵进行检查并计数。
1.4.2 改良直接孵化法[6]将筛取物放入搪瓷碗内加去氯水,在实验室于室温条件下自然孵化。每天观察2次,检查有无幼螺,观察62 d。后用去氯水在铜箩内淘洗,计数有无幼螺并获取筛取物。采用镜检法对未孵化螺卵进行检查并计数。
1.4.3 直接孵化法[6]称取500 g土壤,置搪瓷碗中,以去氯水保持土壤湿度,在同一实验室进行自然孵化。每天观察2次,检查有无幼螺,观察62 d。后用去氯水在铜箩内淘洗并计数幼螺,获取筛取物,采用镜检法对未孵化的螺卵进行检查并计数。
1.5 镜检[4]将实验剩余物放入小型搪瓷盆内,加满清水,充分混匀后用20目铜筛过滤至另一只搪瓷盆内。未滤过物肉眼检查有无幼螺;在搪瓷盆内的滤过物加满水,静置5 min后轻轻倒去液体,再加满水,5 min后轻轻倒去液体,如此反复水洗多次至水清为止。最后,将沉淀物倒入培养皿,加适量水置解剖镜下(20倍)检查,若有疑似,在解剖镜下用解剖针小心剥离泥皮,见到透明胶球内有略显黄色的卵胚即可判定为螺卵。
1.6 计算方法实验观察最长73 d,采用双筛水洗法捡出孵化的幼螺,筛取物按照镜检方法检测未孵化螺卵,计算孵化率。孵化率(%)=孵化出的幼螺数/(孵化出的幼螺数+未孵化的螺卵数)×100。
1.7 统计学处理[8-9]采用SPSS 10.0软件进行统计学分析,Kappa值计算采用Excel软件自编程序分析。收集螺卵恒温孵化法和改良恒温直接孵化法实验条件下温度差异采用t检验;3种方法的一致性检验采用Kappa值;检出幼螺的时间采用Kruskal-Wallis检验;3种孵化方法孵化率的差异采用χ2检验。P<0.05为差异有统计学意义。
2 结果 2.1 实验室温湿度情况收集螺卵恒温孵化法是在条件较为特殊的恒温实验室内进行,除湿度有所变化外其温度变化不大。改良直接孵化法、直接孵化法选用普通实验室,不进行特别的温度和湿度调控,一般有螺地区实验室条件均具备。改良直接孵化法实验室温度最高26 ℃,最低20 ℃,平均23.62 ℃;收集螺卵恒温孵化法实验室温度最高23 ℃,最低22 ℃,平均为22.03 ℃。两种方法实验室温度差异有统计学意义(t=7.309,P=0.000)。
2.2 孵化方法的一致性分析对采回的20块土壤分别称取500 g,采用3种方法进行检测,收集螺卵恒温孵化法、改良直接孵化法和直接孵化法螺卵孵化检出率分别为90.00%(18/20)、90.00%(18/20)和100%(20/20)。其中收集螺卵孵化法与改良直接孵化法、收集螺卵恒温孵化法与直接孵化法、改良直接孵化法与直接孵化法经统计学分析,均不具有一致性(Kappa值=0.36、0.47、0.36,P>0.05)。
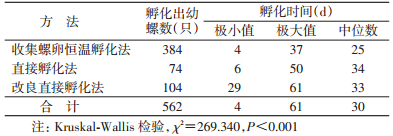
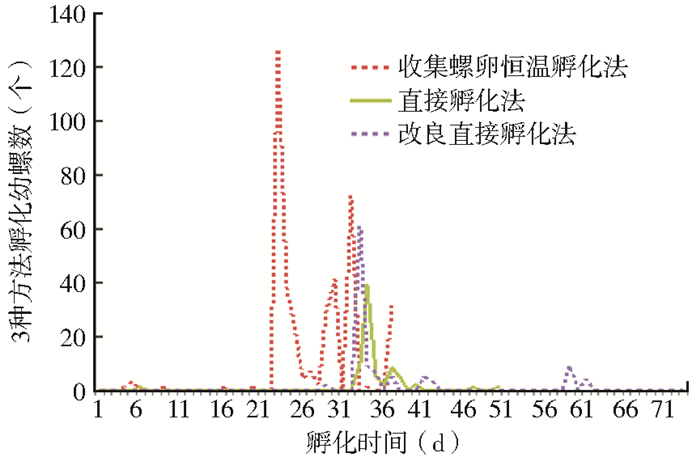
2.3 螺卵孵化时间通过73 d的观察发现,收集螺卵恒温孵化法、直接孵化法和改良直接孵化法最早孵化出钉螺分别在进入实验室的第4、6和29天,集中出现时间分别在第25、34和33天,最长仍能孵化出钉螺的时间为第61天(改良直接孵化法)。3种实验方法发现幼螺时间见图 1。经Kruskal-Wallis检验,3种实验方法孵化出幼螺的时间差异有统计学意义(χ2=269.340,P<0.001),见表 1。
|
| 图 1 发现幼螺数与孵化时间的关系 |
| |
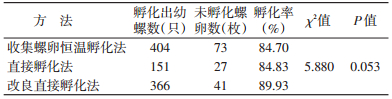
对每500 g有螺地区泥土采用收集螺卵恒温孵化法、直接孵化法和改良直接孵化法进行孵化,孵化率差异无统计学意义(χ2=5.880,P=0.053),见表 2。
有螺泥土可在实验室和自然状态下孵化出螺卵,说明泥土可能作为介质传播钉螺[2, 10],农业生产、苗木移植、有螺地区土壤的利用可导致钉螺的播散,有潜在隐患。因此,需要对有螺地区土壤和灭螺后土壤中的螺卵进行孵化检测,但收集螺卵恒温孵化法在条件较好的实验室可得到有效利用,一般实验室不具备恒温、大量产生去离子水等实验条件,且清洗泥土样本作业量大,限制了该方法使用。通过在自然状况下建立实验基地进行剂量投螺条件下检测方法的研究发现,直接孵化法(自然孵化法)可检测出泥土中的钉螺[6],但该方法还未在自然有螺的土壤中进行孵化钉螺实验,是否具有现场应用价值还需进一步研究。本研究发现,直接孵化法和改良直接孵化法均可在有螺地区的土壤中孵化出钉螺,但3种检测方法不具有一致性,检出钉螺时间差异有统计学意义(χ2=269.340,P<0.001),孵化率差异无统计学意义(χ2=5.880,P=0.053)。
3.1 温度对检测结果的影响在其他孵化条件一致的情况下,实验室影响钉螺孵化时间的主要因素是温度。改良直接孵化法和收集螺卵恒温孵化法的实验室温度差异有统计学意义(t=7.309,P<0.001)。在恒温实验室条件下泥土中钉螺孵化时间较自然孵化时间提前,说明温度在实验室钉螺孵化过程中起明显作用。
3.2 3种方法的时间差异分析从图 1、表 1可以看出,在22 ℃恒温条件下,收集螺卵恒温孵化法孵化时间较短,与未进行恒温调节的实验室比较,孵化时间中位数为25 d,较直接孵化法和改良直接孵化法提前约9 d。在相同温度条件下,改良直接孵化法和直接孵化法孵化出幼螺的时间中位数仅相差1 d,差异不明显。直接孵化法和改良直接孵化法可孵化出幼螺,但孵化周期较长,孵化时间>35 d,与以往研究结果相近[6],可能与钉螺物种自然孵化周期有关。黄菊梅等[11]研究认为与近些年气温升高,钉螺对气象因子的反应有关。但在普通实验室若有条件控制室温(如空调)在23 ℃左右进行孵化实验是否可缩短孵化时间,有待进一步研究。
3.3 3种方法的优劣性分析3种孵化法孵化出的钉螺绝对数差异与钉螺卵在泥土中不呈正态分布有关[7],检出率差异无统计学意义。本研究中采用的收集螺卵恒温孵化法需要对土壤进行预处理,需使用大量的去氯水,工作量大,而不具备生产大量去氯水设施及恒温条件的实验室难以开展检测。改良直接孵化法除不需要实验室恒温条件外,也同样存在该问题。直接孵化法可孵化出幼螺,比较简便,无需较高的实验室条件及对土壤进行预处理,只需使用不含氯的水保持土壤湿度即可达到同样的检测目的。直接孵化法的孵化率与收集螺卵恒温孵化法和改良直接孵化法差异无统计学意义,可作为普通实验室的检测方法。
本研究使用镜检法可较快地对实验后未孵化的螺卵进行检测[4],也可用于有螺地区土壤中钉螺螺卵的快速检测。但该法也需投入大量的人工和水对土壤样本进行预处理,在技术上受显微镜配备及人员操作熟练程度、对钉螺螺卵形态学的掌握程度以及土壤中其他混杂螺卵的干扰等因素限制。此外,该方法无法判定检出的钉螺螺卵是否具有可孵化活性,仍需进行孵化实验。
综上所述,改良直接孵化法和直接孵化法可作为检测有螺地区土壤是否含有可孵化螺卵的补充方法运用到实践中,特别是直接孵化法无需较高的实验室条件及土壤预处理,且方法简单,可作为普通实验室检测方法应用于现场。
| [1] |
田建国, 仲文江, 黎桂福, 等. 水网地区模拟输入性钉螺生存繁殖情况初步观察[J]. 中国血吸虫病防治杂志, 2011, 23(2): 204-206. |
| [2] |
田建国, 张小萍, 洪国宝, 等. 高温季节泥土中螺卵孵化结果分析[J]. 中国公共卫生, 2011, 27(5): 612-613. DOI:10.11847/zgggws-2011-27-05-39 |
| [3] |
田建国, 仲文江, 黎桂福, 等. 上海市青浦区钉螺再生性研究[J]. 中国媒介生物学及控制杂志, 2011, 22(2): 162-164. |
| [4] |
中华人民共和国卫生部. 血吸虫病防治手册[M]. 3版. 上海: 上海科学技术出版, 2000, 40-41.
|
| [5] |
周晓农, 张仪, 洪青标, 等. 实用钉螺学[M]. 北京: 科学出版社, 2005, 82-87.
|
| [6] |
田建国, 黎桂福, 张小萍, 等. 剂量投螺条件下泥土中活性螺卵检测方法研究[J]. 中国媒介生物学及控制杂志, 2014, 25(6): 557-559. |
| [7] |
闻礼永. 血吸虫病监测手册[M]. 北京: 人民卫生出版社, 2014, 53-54.
|
| [8] |
孙振球. 医学统计学[M]. 3版. 北京: 人民卫生出版社, 2011, 101-102.
|
| [9] |
夏邦世, 吴金华. Kappa一致性检验在检验医学研究中的应用[J]. 中华检验学杂志, 2006, 29(1): 83-84. |
| [10] |
谢娟, 闻礼永, 朱匡纪, 等. 浙江省中部某苗木产业区移栽苗木泥球携带钉螺输出的风险评估[J]. 中国寄生虫学与寄生虫病杂志, 2016, 34(6): 522-526. |
| [11] |
黄菊梅, 刘可群, 常艾, 等. 洞庭湖区血吸虫的中间宿主:钉螺对气象因子的响应[J]. 公共卫生与预防医学, 2015, 26(2): 27-30. |
 2017, Vol. 28
2017, Vol. 28