扩展功能
文章信息
- 薛晓嘉, 李学文, 李晓梅, 丁国永, 刘起勇
- XUE Xiao-jia, LI Xue-wen, LI Xiao-mei, DING Guo-yong, LIU Qi-yong
- 山东省干旱事件对人群传染病发病影响的研究
- Study on effects of drought events on infectious diseases in Shandong province
- 中国媒介生物学及控制杂志, 2017, 28(6): 538-542
- Chin J Vector Biol & Control, 2017, 28(6): 538-542
- 10.11853/j.issn.1003.8280.2017.06.006
-
文章历史
- 收稿日期: 2017-08-17
- 网络出版时间: 2017-10-10 14:00
2 山东大学公共卫生学院, 济南 250012;
3 中国疾病预防控制中心传染病预防控制所, 北京 102206
2 School of Public Health, Shandong University;
3 National Institute for Communicable Disease Control and Prevention, Chinese Center for Disease Control and Prevention
气候变化背景下大范围持续性干旱已成为经济损失最大的自然性灾害,21世纪末干旱和半干旱面积可能将占全球陆地表面积的50%以上[1]。山东省属暖温带季风气候,常年遭受干旱影响,旱灾面积为1 333 000~2 000 000 hm2,占各类自然灾害总受灾面积的50%左右,其发生频率最高、涉及面积最广[2]。山东省的干旱具有明显的季节性,常发生在春、夏、秋季节,并以春季为主。干旱不仅是农业生产的天敌,对生态环境也造成了危害,严重威胁人类健康[3]。
传染病在全世界仍是一个严重的公共卫生问题[4],其引起的伤残调整寿命年估计占全球疾病负担的23.5%左右,每年大约1 090.4万人死于该类疾病[5]。持续干旱不仅降低人类机体抵抗力,还会加剧空气水源的污染及食品中细菌、霉菌等的孳生,引发传染病流行。干旱对传染病的影响复杂,国内外对其多为单一或少量疾病专题调查,干旱对人类传染病的影响仍缺乏强有力的流行病学证据[6-7]。现有研究未能全面反映干旱事件引起的人群传染病敏感疾病谱及揭示干旱对相关敏感疾病的影响程度。本研究通过以往疫情资料,对2005-2013年山东省法定报告传染病数据进行生态学研究,识别研究区域干旱事件相关传染病,为后续的定量评估及预测奠定基础。
1 材料与方法 1.1 研究现场基于山东省地理分布特征,选取山东省济南、青岛、潍坊和泰安市辖区以及日照市莒县和滨州市惠民县作为研究现场。
1.2 数据来源2005-2013年山东省传染病发病数据来源于中国CDC法定报告传染病数据库。人口学数据来自中国CDC公共卫生科学数据中心(http://www.phsciencedata.cn/)。气象资料来自中国气象数据网(http://data.cma.cn/)。同时期气象灾害数据查阅《中国气象灾害年鉴》、《中国水利年鉴》、《全国气候影响评价》和《山东统计年鉴》。
1.3 研究设计本研究采用生态趋势研究探讨干旱事件与人群传染病的关系,进而筛选干旱敏感性传染病。首先,根据传染病的传播机制和生物学合理性,排除与干旱无关的传染病种类;并描述传染病的发病水平,剔除发病较少的病种(因在后续评价中会造成结果不稳定)。其次,采用Wilcoxon秩和检验比较暴露期与对照期传染病的发病率来粗筛干旱相关敏感性传染病,干旱对各传染病可能存在滞后效应(根据传染病的传播规律及潜伏期,对每种传染病给予不同滞后效应分析,肠道传染病一般为0~2个月,呼吸道传染病与自然疫源性及虫媒传染病一般为0~3个月),对于不同滞后期传染病的发病率也采用Wilcoxon秩和检验进行差异性比较。最后,在控制潜在混杂因素基础上进行多因素分析,将多因素回归模型认为有关联的传染病进行流行病学综合分析,最终确定干旱相关敏感性传染病。
因传染病发病的特殊性,本研究采用负二项分布描述传染病的分布和生物的群聚性。对于肠道传染病的细菌性痢疾、手足口病、呼吸道传染病的肺结核等病种,由于监测到发病人数较多,月发病例数极少出现0值,采用负二项回归模型可较好地评价干旱对传染病的影响。其他传染病发病人数相对较少,在某月中常常遇到发病例数为0的状况,被称为资料的零膨胀。若继续采用Poisson回归或负二项回归分析此类资料往往低估事件中0发生的概率。零膨胀计数模型建立过程如下:首先,观察计数资料是否存在零膨胀情况。其次,判断计数资料是否存在超离散,通过似然比α检验判断资料是否存在超离散。最后,进行Vuong检验决定模型的选择。
1.4 统计学分析根据各种传染病在人群中分布类型及各模型适用条件,选择负二项回归模型、零膨胀负二项回归模型和零膨胀Poisson回归模型拟合干旱与粗筛传染病发病率关系,并计算干旱对各传染病的OR值及其95%CI。采用Stata 12.0软件进行传染病数据的描述性分析、Wilcoxon秩和检验和建立多因素回归模型。
2 结果 2.1 干旱相关传染病初筛按照传播途径传染病大致分为5类:肠道传染病、呼吸道传染病、自然疫源性及虫媒传染病、血液及性传播传染病和体表传染病。流行病学综述显示,干旱可能与粪-口传播疾病、呼吸道传染病和自然疫源性及虫媒传染病有关。因此,首先排除不符合干旱期间生物学合理性的血液及性传播传染病(5种)和体表传染病(2种)。传染病发病数据整理发现,脊髓灰质炎(0例)、霍乱(1例)和副伤寒(29例)、严重急性呼吸系统综合征(0例)和白喉(0例)、鼠疫(0例)、钩端螺旋体病(0例)、日本血吸虫病(0例)、黑热病(0例)、丝虫病(0例)、炭疽(0例)、登革热(1例)和包虫病(7例)发病数较少,在下一步分析中剔除。其他传染病发病状况见表 1。
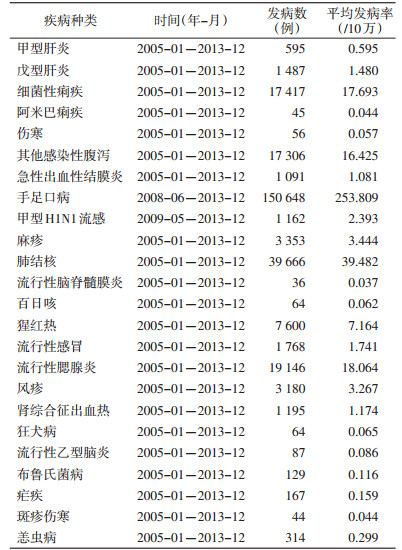 |
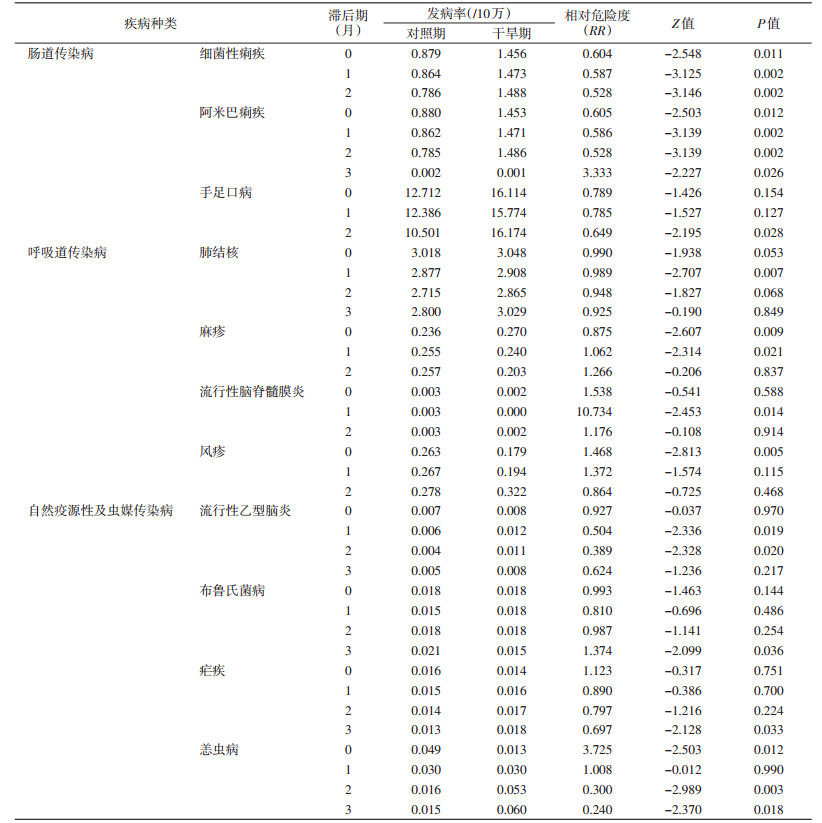
经Wilcoxon秩和检验,未观察到干旱对肠道传染病的甲型肝炎(甲肝)、戊型肝炎(戊肝)、伤寒、急性出血性结膜炎和其他感染性腹泻有影响;未观察到干旱对呼吸道传染病的百日咳、猩红热、流行性感冒、流行性腮腺炎、甲型H1N1流感有作用;也未观察到干旱对自然疫源性及虫媒传染病的肾综合征出血热(HFRS)、狂犬病和斑疹伤寒有影响。其他传染病在干旱期与对照期的发病水平状况显示(表 2),在滞后0~2个月内均发现干旱对细菌性痢疾的发病率有影响,滞后2个月时效应最强〔相对危险度(RR)=0.528,P=0.002〕,干旱对滞后3个月的阿米巴痢疾(RR=3.333,P=0.026)和滞后2个月的手足口病(RR=0.649,P=0.028)也有一定影响。在呼吸道传染病中,干旱对肺结核、麻疹、流行性脑脊髓膜炎(流脑)和风疹的发病起到重要作用,干旱在滞后1个月时对肺结核、流脑的发病有影响(RR=0.989、10.734);在滞后0~1个月时干旱对麻疹发病有一定影响,但结果不一致,可能与混杂偏倚影响有关;风疹则在滞后0个月时出现显著性效应(RR=1.468,P=0.005)。在自然疫源性及虫媒传染病中,干旱在滞后3个月时对布鲁氏菌病和疟疾有影响(RR=1.374和0.697);在滞后1~2个月时对流行性乙型脑炎(乙脑)也有明显影响;干旱在滞后0个月、2~3个月均对恙虫病发病有重要影响,其结果也不一致,可能与人类活动及恙螨的孳生繁殖条件有关,也可能与混杂偏倚影响有关。
 |
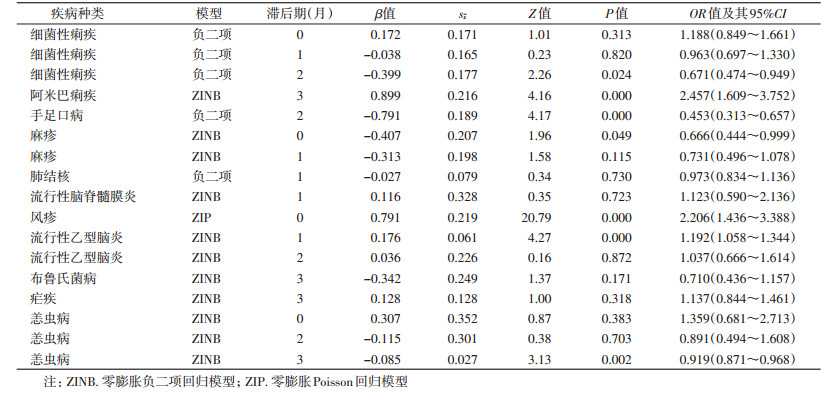
调整气象因素作用后显示,干旱对肠道传染病的细菌性痢疾、阿米巴痢疾和手足口病的发病率均有影响,细菌性痢疾的发病率在干旱滞后2个月时降低,而阿米巴痢疾的发病率在干旱滞后3个月时增加,OR及其95%CI分别为0.671(0.474~0.949)和2.457(1.609~3.752);干旱和手足口病的发病率也有一定关联,OR及其95%CI为0.453(0.313~0.657);干旱对呼吸道传染病的麻疹和风疹的发病率也有一定影响,麻疹的发病率在干旱发生后降低,而风疹的发病率却在干旱滞后0个月时增加,OR及其95%CI分别为0.666(0.444~0.999)和2.206(1.436~3.388)。多因素分析显示,干旱在滞后1个月时可显著增加乙脑的发病风险,滞后3个月可降低恙虫病的发病风险,OR及其95%CI分别为1.192(1.058~1.344)和0.919(0.871~0.968),见表 3。
 |
本研究首次使用生态趋势研究从长时间尺度对山东省的干旱敏感性传染病进行筛选。研究提示,肠道传染病的细菌性痢疾、阿米巴痢疾、手足口病,呼吸道传染病的麻疹、风疹,自然疫源性及虫媒传染病的乙脑、恙虫病是干旱相关敏感性传染病。该结果与一些流行病学报道相似,如2015年Yusa等[8]在加拿大对干旱与人类健康进行研究发现,干旱对呼吸道传染病、肠道传染病和虫媒传染病的发病率均有影响。Paull等[9]对干旱和免疫力影响进行研究发现,干旱可以影响人群传染病的传播动力学,从而导致传染病发病率的改变。
本研究表明,干旱发生后能明显增加阿米巴痢疾、风疹和乙脑的发病风险,其滞后反应分别出现在3、0和1个月。干旱期间阿米巴痢疾发病率升高可能因干旱导致水位降低,水分蒸发量升高,水资源严重不足,有利于水体污染物的持续增长和生存,使水质严重恶化及降雨模式的改变导致农作物受影响,农产品产量降低、质量不达标,从而影响人们的正常饮水和饮食,人群整体抵抗力下降,易感性增加,尤其是老年人和儿童特殊群体,引起阿米巴痢疾的发病率升高[10]。风疹发病率升高主要原因可能是干旱引起的空气中气溶胶浓度升高,继而使风疹病毒载体量升高,并且干旱常伴有气温升高,易于某些特定的微生物繁殖,使其发生风险增加[11-12]。对于乙脑,有研究表明干旱可以使蚊虫天敌减少,繁殖能力增强,蚊密度上升,其发病率呈阶段性升高[13-14]。
研究还发现,干旱发生后对许多传染病的流行具有一定保护作用。如细菌性痢疾、手足口病、麻疹和恙虫病在干旱发生后发病率呈降低趋势。根据干旱发生的强弱程度和持续时间来看,干旱在一定程度上又抑制细菌、病毒或一些寄生虫的生长效能,主要因缺水环境不适宜微生物生存与繁殖。Liu等[15]发现轻度湿润有助于细菌性痢疾发病率升高,干旱期间湿度降低,痢疾杆菌繁殖力下降,其细菌性痢疾发病率降低。Nguyen等[16]研究发现,每增加1个降水单位手足口病的发病率会增加0.5%,肠道病毒在潮湿环境中更易生存繁殖,而干旱环境不利于肠道病毒传播,其发病率有下降趋势。丁磊等[17]对山东省2010年秋冬型恙虫病流性特征及影响因素研究发现,居住环境潮湿是该病流行的危险因素,也是影响最严重的因素,说明干旱期间环境对恙虫病有一定保护作用。
在传染病粗筛时发现,不同滞后阶段干旱对麻疹和恙虫病影响不一致,可能与以下两方面原因有关:①在初筛阶段运用单因素方法分析,存在各种混杂因素导致不同滞后阶段的结果不同;②如恙虫病可能与人们的行为生活方式改变有关,干旱初期人们因干旱野外活动增多,接触恙螨概率增加,导致发病数增多,随着后期干旱持续时间延长,影响程度加深,恙螨繁殖能力下降,其发病率下降。
本研究也存在一定局限性。只证实干旱相关敏感性传染病,但对上述传染病传播影响的具体机制未进行深入研究。干旱造成敏感传染病的发病风险升高或降低的原因较多,可能是干旱环境影响相应病原体的发育与繁殖、传染力和传播途径,对昆虫和啮齿类动物等媒介生物的分布范围与栖息地及活动能力有明显影响。持续干旱可以降低人体抵抗力,影响受感染概率。本研究从人群角度研究干旱对传染病的影响,并未考虑个体的暴露情况,暴露与结局间存在的关联强度被削弱,可能导致生态学谬误。因此,需进一步开展干旱对传染病影响的研究,为最大限度地降低干旱对人群健康风险提供科学依据。
| [1] |
Stott P. How climate change affects extreme weather events[J]. Science, 2016, 352(6293): 1517-1518. DOI:10.1126/science.aaf7271 |
| [2] |
Tong SL, Berry HL, Ebi K, et al. Climate change, food, water and population health in China[J]. Bull World Health Organ, 2016, 94(10): 759-765. DOI:10.2471/BLT.15.167031 |
| [3] |
Santos-Vega M, Martinez PP, Pascual M. Climate forcing and infectious disease transmission in urban landscapes:integrating demographic and socioeconomic heterogeneity[J]. Ann N Y Acad Sci, 2016, 1382(1): 44-55. DOI:10.1111/nyas.2016.1382.issue-1 |
| [4] |
Wu XX, Lu YM, Zhou S, et al. Impact of climate change on human infectious diseases:empirical evidence and human adaptation[J]. Environ Int, 2016, 86: 14-23. DOI:10.1016/j.envint.2015.09.007 |
| [5] |
Wang HD, Naghavi M, Allen C, et al. Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980-2015:a systematic analysis for the global burden of disease study 2015[J]. Lancet, 2016, 388(10053): 1459-1544. DOI:10.1016/S0140-6736(16)31012-1 |
| [6] |
Greer A, Ng V, Fisman D. Climate change and infectious diseases in North America:the road ahead[J]. CMAJ, 2008, 178(6): 715-722. |
| [7] |
Kula N, Haines A, Fryatt R. Reducing vulnerability to climate change in sub-Saharan Africa:the need for better evidence[J]. PLoS Med, 2013, 10(1): e1001374. DOI:10.1371/journal.pmed.1001374 |
| [8] |
Yusa A, Berry P, Cheng JJ, et al. Climate change, drought and human health in Canada[J]. Int J Environ Res Public Health, 2015, 12(7): 8359-8412. DOI:10.3390/ijerph120708359 |
| [9] |
Paull SH, Horton DE, Ashfaq M, et al. Drought and immunity determine the intensity of West Nile virus epidemics and climate change impacts[J]. Proc Biol Sci, 2017, 284(1848): pii:20162078. DOI:10.1098/rspb.2016.2078 |
| [10] |
Khodaverdi H, Fowles T, Bick E, et al. Does drought increase the risk of insects developing behavioral resistance to systemic insecticides?[J]. J Econ Entomol, 2016, 109(5): 2027-2031. DOI:10.1093/jee/tow188 |
| [11] |
Lowen AC, Steel J, Mubareka S, et al. High temperature(30℃) blocks aerosol but not contact transmission of influenza virus[J]. J Virol, 2008, 82(11): 5650-5652. DOI:10.1128/JVI.00325-08 |
| [12] |
Levy K, Woster AP, Goldstein RS, et al. Untangling the impacts of climate change on waterborne diseases:a systematic review of relationships between diarrheal diseases and temperature, rainfall, flooding, and drought[J]. Environ Sci Technol, 2016, 50(10): 4905-4922. DOI:10.1021/acs.est.5b06186 |
| [13] |
Brown L, Medlock J, Murray V. Impact of drought on vector-borne diseases-how does one manage the risk?[J]. Public Health, 2014, 128(1): 29-37. DOI:10.1016/j.puhe.2013.09.006 |
| [14] |
Elbers AR, Koenraadt CJ, Meiswinkel R. Mosquitoes and Culicoides biting midges:vector range and the influence of climate change[J]. Rev Sci Tech, 2015, 34(1): 123-137. DOI:10.20506/rst.issue.34.1.58 |
| [15] |
Liu XN, Liu ZD, Zhang Y, et al. The effects of floods on the incidence of bacillary dysentery in baise (Guangxi province, China)from 2004 to 2012[J]. Int J Environ Res Public Health, 2017, 14(2): E179. DOI:10.3390/ijerph14020179 |
| [16] |
Nguyen HX, Chu C, Nguyen HLT, et al. Temporal and spatial analysis of hand, foot, and mouth disease in relation to climate factors:a study in the Mekong Delta region, Vietnam[J]. Sci Total Environ, 2017, 581: 766-772. |
| [17] |
丁磊, 王显军, 李忠, 等. 山东地区2010年秋冬型恙虫病流行特征及影响因素[J]. 中国公共卫生, 2013, 29(4): 543-545. DOI:10.11847/zgggws2013-29-04-26 |
 2017, Vol. 28
2017, Vol. 28


