扩展功能
文章信息
- 郭秀霞, 程鹏, 刘丽娟, 史琦琪, 王海防, 张崇星, 王怀位, 公茂庆
- GUO Xiu-xia, CHENG Peng, LIU Li-juan, SHI Qi-qi, WANG Hai-fang, ZHANG Chong-xing, WANG Huai-wei, GONG Mao-qing
- 9种蚊虫细胞色素C氧化酶亚基Ⅰ基因的分子进化分析
- Molecular evolution analysis of mitochondrial DNA cytochrome C oxidase subunitⅠgene among nine mosquito species
- 中国媒介生物学及控制杂志, 2017, 28(6): 530-534
- Chin J Vector Biol & Control, 2017, 28(6): 530-534
- 10.11853/j.issn.1003.8280.2017.06.004
-
文章历史
- 收稿日期: 2017-06-20
- 网络出版时间: 2017-10-10 14:00
蚊虫吸血骚扰人类,是多种疾病的重要传播媒介及重要的医学昆虫。全世界蚊虫超过3 000种,不同蚊媒种群可携带并传播不同的病原体,对病原体的传播具有种属特异性,进而影响其流行病学特征[1-2]。蚊虫分类是蚊虫传染病研究的基础[3],对蚊媒种属进行遗传变异研究和分子鉴别对于蚊媒疾病的防治具有重要意义。线粒体DNA(mtDNA)具有进化速率快、拷贝数量多、母系遗传和DNA不为蛋白质所压缩等特点,是种群遗传和系统进化研究的理想对象[4]。细胞色素C氧化酶亚基Ⅰ(COⅠ)是参与线粒体电子传递链末端氧化步骤的一种重要呼吸酶,为细胞色素提供重要的结合位点。其3个大亚基由mtDNA编码,其中COⅠ基因分子质量最大、位置较保守而被用于多种蚊虫的种群遗传结构分析,成为具有重要价值的分子标记[5-7]。通过对山东省济宁市9种常见蚊虫的COⅠ基因序列进行系统发育关系研究,探讨不同蚊种COⅠ的基因分化及遗传差异,为蚊媒监测及疾病防治提供依据。
1 材料与方法 1.1 蚊虫来源2016年采用人饵帐诱捕法在山东省济宁市北湖地区采集蚊虫样本,带回实验室进行鉴定。分类鉴定方法参照文献[8-10]。蚊虫用95%乙醇保存,置-20 ℃备用。
1.2 试剂与主要仪器dNTP、LA Taq聚合酶和DNA分子质量标准(DL 2000、1 000 bp Ladder)均购自TaKaRa公司;质粒提取试剂盒和凝胶回收试剂盒购于Axygen公司;其他试剂为国产分析纯。T-Gradient Thermoblock PCR扩增仪(Biometra)、Mini-Protean Tetra Cell电泳仪(Bio-Rad)和Smart Spec3000紫外分光光度计(Bio-Rad)。
1.3 方法 1.3.1 蚊虫基因组DNA提取按文献[11]操作,提取单蚊基因组DNA,具体步骤为裂解液(NaCl 0.467 g、乙二胺四乙酸2.233 g、十二烷基硫酸钠0.500 g、Tris HCl 1.121 g和蔗糖5.476 g,加H2O至100 ml),65 ℃预热。单只蚊虫置于1.5 ml离心管中,加入100 μl预热的裂解液,用塑料研磨棒研磨至匀浆状。65 ℃孵育30 min。加5 mol/ L(25 μl)乙酸钾至终浓度1 mol/L,混匀。4 ℃静置30 min。离心半径10 cm、13 200 r/min离心10 min。取上清液,抽取100~110 μl上清液,注意不要抽到沉淀。加2.0~2.5倍体积预冷的无水乙醇(-20 ℃)沉淀核酸。4 ℃静置30 min~3 h。离心半径10 cm、13 200 r/min离心10 min。弃上清液,加75%乙醇200~300 μl(-4 ℃)洗涤盐分;弃上清液,37 ℃烘干。加50~100 μl双蒸灭菌水溶解,置-20 ℃冰箱保存待用。紫外分光光度计测定DNA浓度及纯度,进行1%琼脂糖凝胶电泳分析。
1.3.2 线粒体DNA细胞色素C氧化酶亚基Ⅰ(mtDNA-COⅠ)基因的扩增与测序根据蚊虫mtDNA-COⅠ序列特征,在相对保守区域设计引物,引物由英潍捷基(上海)贸易有限公司合成。上游引物:5′-GGA GGA TTT GGA AAT TGA TTG-3′,下游引物:5′-CCC GGT AAA ATT AAA ATA TAA A-3′。以提取的蚊虫DNA为模板,用上述引物进行PCR扩增。采用50 μl反应体系:ddH2O 38.5 μl、10×LA PCR Buffer 5 μl、10 mmol/L dNTP 1 μl、模板DNA 1 μl、LA Taq聚合酶0.5 μl、10 pmol/L上下游引物各2 μl。反应条件:94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火45 s,72 ℃延伸1 min,共30个循环;最后72 ℃延伸5 min。取扩增产物5 μl进行1%琼脂糖凝胶电泳,利用凝胶成像系统观察拍照记录结果。扩增成功样品送英潍捷基(上海)贸易有限公司进行双向测序。
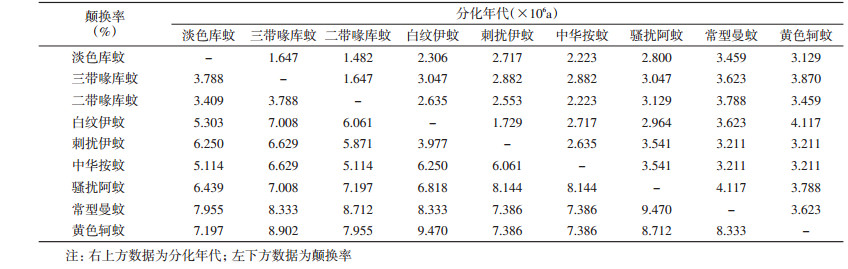
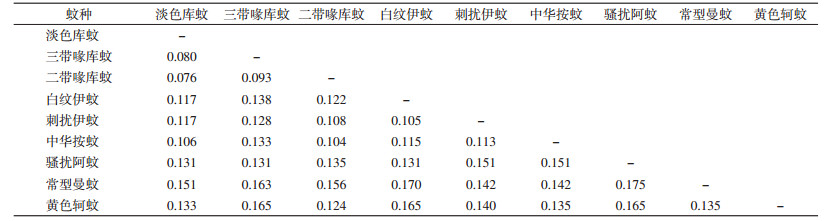
1.4 数据分析采用Bioedit 7.0软件对测序结果进行拼接处理,正反链序列结果一致的样本进行下一步分析。登录GenBank对序列进行Blast同源性比对,不同个体mtDNA-COⅠ序列用DNAman软件进行序列比对,用DNAStar、ClustalX 1.81和Mega 6.0软件进行序列分析,计算颠换率及各蚊种种间分化年代[12],基于遗传距离Kimura 2-parameter(K2P);采用Neighbor-Joining(NJ)法和非加权组平均法(UPGMA)构建系统进化树,系统树各分支的置信度由1 000次bootstrap重复检测。
2 结果 2.1 成蚊形态鉴定采集的蚊虫经鉴定为6属9种,分别为淡色库蚊(Culex pipiens pallens)、三带喙库蚊(Cx. tritaeniorhynchus)、二带喙库蚊(Cx. bitaeniorhynchus)、刺扰伊蚊(Aedes vexans)、白纹伊蚊(Ae. albopictus)、中华按蚊(Anopheles sinensis)、骚扰阿蚊(Armigeres subalbatus)、黄色轲蚊(Coquillettidia ochracea)和常型曼蚊(Mansonia uniformis)。
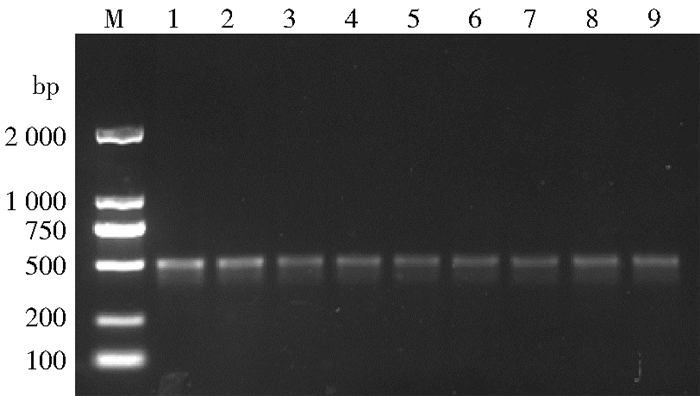
2.2 蚊虫mtDNA-COⅠ克隆以提取的9种蚊虫DNA为模板PCR扩增得到mtDNA-COⅠ基因片段,进行1%琼脂糖凝胶电泳检测,在500 bp附近可观察到与预期分子质量大小相符的DNA条带,见图 1。
|
| 注:M. Marker(DL 2000);1.淡色库蚊;2.三带喙库蚊;3.二带喙库蚊;4.白纹伊蚊;5.刺扰伊蚊;6.中华按蚊;7.骚扰阿蚊;8.常型曼蚊;9.黄色轲蚊 图 1 9种蚊虫的mtDNA-COⅠ基因PCR产物电泳结果 Figure 1 PCR amplified mtDNA-COⅠ genes of nine mosquito species |
| |
9种蚊虫的mtDNA-COⅠ基因片段长度均为528 bp,所有序列均未发现碱基插入或缺失。将测序结果进行Blast比对,同源性最高的均为同种蚊虫。COⅠ基因片段中A、C、G、T碱基的平均含量分别为28.25%、16.51%、16.17%和39.07%。(A+T)碱基含量为65.72%~69.32%(表 1)。变异分析发现,mtDNA-COⅠ基因片段528个位点中有375个保守位点,153个变异位点,104个简约信息位点,49个单态位点。通过计算序列间颠换率,发现不同蚊种间的颠换率在3.409%~9.470%之间,分化年代在1.482×106a~4.117×106a之间,其中,淡色库蚊和二带喙库蚊间的颠换率最低,为3.409%,分化年代最近,为1.482×106a;白纹伊蚊和黄色轲蚊及骚扰阿蚊和常型曼蚊间的颠换率最高,为9.470%,分化年代最远,为4.117×106a,见表 2。不同蚊种的mtDNA-COⅠ序列同源性为84.28%~92.94%,其中库蚊属种内同源性为90.91%~92.42%,伊蚊属种内同源性为90.15%。不同种群的遗传距离为0.076~0.175,骚扰阿蚊和常型曼蚊间的遗传距离最大,淡色库蚊和二带喙库蚊间的遗传距离最小,属间遗传距离最小的为中华按蚊和二带喙库蚊,见表 3。
 |
 |
 |
从图 2可以看出,两种不同分子系统树具有大致相同的拓扑结构。库蚊属的淡色库蚊、三带喙库蚊和二带喙库蚊聚成一类,常型曼蚊和黄色轲蚊聚成一类,但两个系统树中的中华按蚊和骚扰阿蚊的位置有所不同。在NJ树中,伊蚊属和阿蚊属存在一定的交叉,3种库蚊聚类为库蚊属后与白纹伊蚊和骚扰阿蚊聚类为库蚊亚科,中华按蚊为独立的分支(图 2A);而在UPGMA树中,骚扰阿蚊为独立分支,伊蚊属与中华按蚊聚在一起(图 2B)。

|
| 注:分支上数值为1 000次bootstrap检测得到的对该支的支持率,支长代表分歧度 图 2 基于mtDNA-COⅠ基因序列构建的NJ树(A)和UPGMA树(B)(重复次数为1 000次) Figure 2 Phylogenic relationship among mosquito species based on pairwise genetic distance |
| |
蚊虫隶属于节肢动物门、昆虫纲、双翅目、长角亚目蚊科,是严重危害人类健康的媒介昆虫。传统的蚊虫分类方法具有一定的局限性,随着分子生物学技术的发展,从DNA水平进行系统学研究,利用DNA序列信息了解物种间的遗传分化研究较多。COⅠ、COⅡ和细胞色素b基因常作为分析种群系统发育关系的分子工具[13-14]。COⅠ基因属于线粒体基因,普遍存在于真核生物细胞中,与昆虫其他线粒体基因相似,其富含更多的(A+T)碱基,作为应用频率最高的蛋白质编码基因,是研究近缘种和种内遗传变异的理想工具,尤其在双翅目昆虫进化机制和系统重建研究方面,是一种有效的分子标记[15-16]。
本研究以采集自济宁市的成蚊为材料,经过实验室传统形态学鉴定为6属9种。设计特异性引物PCR扩增获得mtDNA-COⅠ基因序列并进行序列分析发现,(A+T)含量明显高于(G+C)含量,表现出明显的A、T偏倚特征,符合昆虫线粒体DNA的特征[17]。骚扰阿蚊和常型曼蚊间同源性最低。骚扰阿蚊和常型曼蚊间的分化年代最远,遗传距离最大,COⅠ基因的属间最小遗传距离和种间最大遗传距离接近。
在分子系统发育研究中,为提高结果的可靠性,通常同时合用多种方法构建系统树。本研究采用NJ法和UPGMA法分别构建系统树,并通过1 000次重抽样评估结果的可靠性。结果显示,两种系统树有些差异,两种树均有聚类为库蚊属的结构及常型曼蚊和黄色轲蚊聚集一类的结构,但骚扰阿蚊和中华按蚊的位置有所不同,NJ树中中华按蚊为独立分支,白纹伊蚊和骚扰阿蚊聚类;而UPGMA树中,白纹伊蚊和刺扰伊蚊聚类为伊蚊属,然后与中华按蚊聚类,骚扰阿蚊位于单独分支,与其他蚊种的亲缘关系较远,其结果与师永霞等[18]研究结果一致。两种系统树均可用于较低分类阶元(属和种)的区分,但对各属间系统发育关系的区分有一定限制,其中NJ树的结构与传统蚊虫形态学分类结果较为一致。因此,COⅠ基因可用于蚊虫分类鉴定,进一步对COⅠ全基因核苷酸和氨基酸序列进行比较分析,以确定该基因在较高分类阶元区分中的应用。
| [1] |
Gemperli A, Sogoba N, Fondjo E, et al. Mapping malaria transmission in West and Central Africa[J]. Trop Med Int Health, 2006, 11(7): 1032-1046. DOI:10.1111/tmi.2006.11.issue-7 |
| [2] |
Onyango SA, Kitron U, Mungai P, et al. Monitoring malaria vector control interventions:effectiveness of five different adult mosquito sampling methods[J]. J Med Entomol, 2013, 50(5): 1140-1151. DOI:10.1603/ME12206 |
| [3] |
宋明昌. 中国口岸常见医学媒介生物鉴定图谱[M]. 天津: 天津科学技术出版社, 2004, 78-161.
|
| [4] |
关申民, 高邦权. COⅠ序列:影响动物分类学与生态学的DNA barcode[J]. 生态学杂志, 2008, 27(8): 1406-1412. |
| [5] |
Fang Y, Shi WQ, Zhang Y. Molecular phylogeny of Anopheles hyrcanus group(Diptera:Culicidae)based on mtDNA COⅠ[J]. Infect Dis Poverty, 2017, 6: 61. DOI:10.1186/s40249-017-0273-7 |
| [6] |
Torres-Gutierrez C, Bergo ES, Emerson KJ, et al. Mitochondrial COI gene as a tool in the taxonomy of mosquitoes Culex subgenus Melanoconion[J]. Acta Trop, 2016, 164: 137-149. DOI:10.1016/j.actatropica.2016.09.007 |
| [7] |
Wang X, Tu WC, Huang EJ, et al. Identification of disease-transmitting mosquitoes:development of species-specific probes for DNA chip assay using mitochondrial COⅠ and ND2 genes and ribosomal internal transcribed spacer 2[J]. J Med Entomol, 2017, 54(2): 396-402. |
| [8] |
陆宝麟, 陈汉彬, 苏龙, 等. 中国动物志.昆虫纲.第8卷.双翅目:蚊科(上)[M]. 北京: 科学出版社, 1997, 56-460.
|
| [9] |
董学书. 云南蚊类志(上卷)[M]. 昆明: 云南科技出版社, 2010, 144-146.
|
| [10] |
董学书, 周红宁, 龚正达. 云南蚊类志(下卷)[M]. 昆明: 云南科技出版社, 2010, 36-366.
|
| [11] |
Collins FH, Mendez MA, Rasmussen MO, et al. A ribosomal RNA gene probe differentiates member species of the Anopheles gambiae complex[J]. Am J Trop Med Hyg, 1987, 37(1): 37-41. DOI:10.4269/ajtmh.1987.37.37 |
| [12] |
Monteiro FA, Barrett TV, Fitzpatrick S, et al. Molecular phylogeography of the Amazonian Chagas disease vectors Rhodnius prolixus and R. robustus[J]. Mol Ecol, 2003, 12(4): 997-1006. DOI:10.1046/j.1365-294X.2003.01802.x |
| [13] |
Bourke BP, Oliveira TP, Suesdek L, et al. A multi-locus approach to barcoding in the Anopheles strodei subgroup (Diptera:Culicidae)[J]. Parasit Vectors, 2013, 6: 111. DOI:10.1186/1756-3305-6-111 |
| [14] |
Batovska J, Blacket MJ, Brown K, et al. Molecular identification of mosquitoes(Diptera:Culicidae)in southeastern Australia[J]. Ecol Evol, 2016, 6(9): 3001-3011. DOI:10.1002/ece3.2016.6.issue-9 |
| [15] |
Foley DH, Bryan JH, Yeates D, et al. Evolution and systematics of Anopheles:insights from a molecular phylogeny of Australasian mosquitoes[J]. Mol Phylogenet Evol, 1998, 9(2): 262-275. DOI:10.1006/mpev.1997.0457 |
| [16] |
Araki AS, Maia DA, Gil-Santana HR, et al. Variation in mitochondrial cytochrome C oxidase Ⅰ DNA can successfully identify Culex(Melanoconion)pedroi(Diptera:Culicidae)and Culex (Melanoconion) ribeirensis (Diptera:Culicidae)[J]. J Med Entomol, 2017, 54(2): 485-488. |
| [17] |
Yuan Y, Li Q, Kong LF, et al. The complete mitochondrial genome of the grand jackknife clam, Solen grandis(Bivalvia:Solenidae):a novel gene order and unusual non-coding region[J]. Mol Biol Rep, 2012, 39(2): 1287-1292. DOI:10.1007/s11033-011-0861-8 |
| [18] |
师永霞, 相大鹏, 李祖海, 等. 广东国境口岸不同蚊种COⅠ序列分析和分子鉴定方法[J]. 中国国境卫生检疫杂志, 2008, 31(2): 103-107. |
 2017, Vol. 28
2017, Vol. 28


