扩展功能
文章信息
- 石金峰, 耿聪, 张坤, 鞠文东, 王力翔, 王红霞, 李振江, 黄晓明, 程成
- SHI Jin-feng, GENG Cong, ZHANG Kun, JU Wen-dong, WANG Li-xiang, WANG Hong-xia, LI Zhen-jiang, HUANG Xiao-ming, CHENG Cheng
- 黑龙江省同江口岸首次发现花鼠携带Bartonella washoensis的分子生物学证据
- Molecular evidence of Bartonella washoensis carried by Tamias sibiricus in Heilongjiang Tongjiang port
- 中国媒介生物学及控制杂志, 2017, 28(5): 484-486
- Chin J Vector Biol & Control, 2017, 28(5): 484-486
- 10.11853/j.issn.1003.8280.2017.05.020
-
文章历史
- 收稿日期: 2017-06-23
- 网络出版时间: 2017-08-09 16:08
2 黑龙江国际旅行卫生保健中心, 哈尔滨 150001
2 Heilongjiang International Travel Healthcare Center
巴尔通体(Bartonella spp.)是营养要求苛刻的革兰染色阴性多形性球杆菌[1],其属于一个相对较大的分类群,目前包含超过30种巴尔通体,并且这其中有超过一半巴尔通体与啮齿类动物有关[2],不仅如此,研究者发现至少15种巴尔通体可导致人类疾病[3],Bartonella washoensis为其中之一,可引起人类的心肌炎和脑膜炎[4-5]。同江口岸位于黑龙江省东北部的松花江与黑龙江汇流处右岸,与俄罗斯下列宁斯阔耶口岸仅一江之隔。2016年,本研究组在对同江口岸鼠类携带巴尔通体情况调查时,首次在花鼠脾脏中扩增出与B. washoensis同源性较高的RNA聚合酶β亚单位〔RNA polymerase beta subunit gene(rpoB),rpoB〕基因阳性片段,这也是黑龙江省可能存在B. washoensis的直接证据。
1 材料与方法 1.1 鼠类标本采集2016年6月,在黑龙江省同江口岸林缘地中,以夹夜法(晚放晨收)和鼠笼法捕获鼠类,装入已编号鼠袋带回实验室,依据其外部形态特征进行鉴定、分类,无菌操作取脾脏,放置于2 ml无菌离心管中,置于-80 ℃备用,并记录所有鼠类样本的登记编号、采集时间、地点、生境、种类、雌雄等背景资料。
1.2 样本处理及提取将采集的脾脏样本置于冰上,向离心管内加入无菌不锈钢珠和400 μl无菌磷酸盐缓冲液(PBS),用组织研磨器研磨0.5~1 min(时间不宜过长),使组织匀浆。将匀浆液4 ℃,8 000×g离心1 min,弃上清,沉淀物用于核酸提取。DNA提取采用细菌基因组DNA提取试剂盒〔天根生化科技(北京)有限公司生产〕,具体步骤按照说明书进行操作。
1.3 PCR法PCR反应体系50 μl,模板DNA加5 μl,10 μmol/L引物1 μl,Premix Taq DNA聚合酶(TaKaRa)25 μl,加去离子水至50 μl。利用巴尔通体rpoB基因序列引物对所有样本进行特性扩增,并利用gltA基因序列引物对阳性样本进行验证(表 1)。取5 μl扩增产物,加入1 μl电泳载样液,1.2%琼脂糖电泳(4 V/cm)40 min,紫外灯下观察并拍照,2种引物均出现目标条带的样本为巴尔通体。
利用rpoB基因序列引物扩增的阳性PCR产物(333 bp)送吉林库美生物公司直接测序,获得序列应用BLAST与GenBank中的序列进行序列比对(https://www.ncbi.nlm.nih.gov)。选用Mega 6.0软件[8]进行系统进化分析,用邻接法(neighbor-joining method,NJ)构建系统进化树。本研究采用的参考菌株序列均取自GenBank。
2 结果 2.1 啮齿动物捕获情况本次调查共捕获鼠类113只,经鉴定隶属于3科4属5种,其中黑线姬鼠(Apodemus agrarius)85只,占捕鼠总数的75.22%,为优势鼠种,其次为大林姬鼠(Apodemus peninsulae)占15.93%(18/113),花鼠(Tamias sibiricus)占6.19%(7/113),大仓鼠(Tscherskia triton)占1.77 %(2/113),东方田鼠(Microtus fortis)占0.89%(1/113)。
2.2 测序及同源性比较共检测到阳性样本69份,阳性率为61.06%(69/113)(图 1),其中黑线姬鼠阳性样本60份,阳性率为53.10%(60/113),占捕获黑线姬鼠总数的70.59%(60/85);大林姬鼠阳性样本8份,阳性率为7.08%(8/113),占捕获大林姬鼠总数的44.44%(8/18);在花鼠中检测到阳性样本1份,阳性率为0.88%(1/113)。
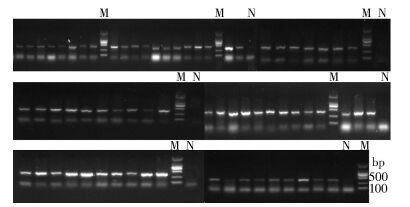
|
| 注:M. DL2000 Marker;N.阴性对照 图 1 黑龙江省同江口岸鼠类巴尔通体检测结果(rpoB基因) |
| |
通过应用GenBank中BLAST功能对所有序列进行比对发现,序列编号TJ2016-107均与分离自中国花鼠的B. washoensis(AB519122.1、AB520713.1)SR22-1株和SR25-1株同源性最高,分别为99%和98%。该阳性样本分离自1只雌性花鼠,将所测序列上传至GenBank,序列号KY072968,并对该阳性标本序列构建系统进化树,见图 2。

|
| 图 2 基于巴尔通体rpoB基因片段构建的系统进化树 |
| |
本研究以巴尔通体rpoB基因引物进行检测,rpoB基因是单拷贝基因,可排除单一生物内序列变化的影响,有助于区分种内生物[9],通过对获得的阳性产物测序,分析比对并进化分析,从而确定所分离的巴尔通体种类。本研究首次在黑龙江省同江口岸花鼠脾脏中扩增出与B. washoensis同源性较高的rpoB基因阳性片段,这也证实了黑龙江省可能存在该种巴尔通体,此次研究为B. washoensis的进一步确认提供了有力的分子生物学证据。
1995年,B. washoensis首次分离于美国内华达州1例心脏病患者,同时,研究者在同一地区加利福尼亚黄鼠中分离到与该患者相同的B. washoensis,并且发现该种松鼠感染率高达17%以上[4]。不仅如此,2003年,该种巴尔通体又在美国科罗拉多州1只黑尾草原犬心脏血液中检出[10],说明B. washoensis属于人兽共患病原体,并可能感染多种哺乳动物[11]。
松鼠科鼠种被认为是B. washoensis天然宿主库,现已知在多种鼠种中检出该巴尔通体,包括加利福尼亚州黄鼠(北美)、瑞士黄鼠(北美)、哥伦比亚黄鼠(北美)、达乌尔黄鼠(中国)、花鼠(中国)、红松鼠(北美)、美洲飞鼠(北美)、松鼠(中国)[12]等,均属于松鼠科,Inoue等[12]利用多基因分析发现,B. washoensis可能与松鼠科鼠种存在特异性宿主的关系,与地理因素无关。在中国,关于B. washoensis的报道较少,2015年,宋秀平等[13]在对内蒙古自治区小型兽类巴尔通体感染情况调查时,在达乌尔黄鼠中检测到该种巴尔通体,同年Li等[14]在黑龙江省黑瞎子岛花鼠中也检测到该种巴尔通体,上述结果均与Inoue等[12]的研究结论相符。
巴尔通体除常见的rpoB和gltA基因检测外,还包括16S rRNA、ftsZ、ribC和groEL基因,为了更充分证实该地区巴尔通体与其他一些相关文献所记载B. washoensis的差别与联系,应对其他基因作相应的检测,并进行序列分析,以提供更多能充分证明黑龙江省同江口岸存在B. washoensis的证据。从实验结果发现,该地区鼠类携带巴尔通体阳性率较高,研究者希望通过对所有阳性样本进行多基因检测,以便及时发现更多可能存在的不同种类的巴尔通体,以丰富黑龙江口岸病原体库,对病原体的传入传出提供有效的防控。
| [1] |
Morway C, Kosoy M, Eisen R, et al. A longitudinal study of Bartonella infection in populations of woodrats and their fleas[J]. J Vector Ecol, 2008, 33(2): 353-364. DOI:10.3376/1081-1710-33.2.353 |
| [2] |
Buffet JP, Kosoy M, Vayssier-Taussat M. Natural history of Bartonella-infecting rodents in light of new knowledge on genomics, diversity and evolution[J]. Future Microbiol, 2013, 8(9): 1117-1128. DOI:10.2217/fmb.13.77 |
| [3] |
Vieira-Damiani G, de Paiva Diniz PPV, Pitassi LHU, et al. Bartonella clarridgeiae Bacteremia detected in an asymptomatic blood donor[J]. J Clin Microbiol, 2015, 53(1): 352-356. DOI:10.1128/JCM.00934-14 |
| [4] |
Kosoy M, Murray M, Gilmore Jr RD, et al. Bartonella strains from ground squirrels are identical to Bartonella washoensis isolated from a human patient[J]. J Clin Microbiol, 2003, 41(2): 645-650. DOI:10.1128/JCM.41.2.645-650.2003 |
| [5] |
Probert W, Louie JK, Tucker JR, et al. Meningitis due to a "Bartonella washoensis"-like human pathogen[J]. J Clin Microbiol, 2009, 47(7): 2332-2335. DOI:10.1128/JCM.00511-09 |
| [6] |
Paziewska A, Harris PD, Zwolińska L, et al. Recombination within and between species of the alpha proteobacterium Bartonella infecting rodents[J]. Microb Ecol, 2011, 61(1): 134-145. DOI:10.1007/s00248-010-9735-1 |
| [7] |
Norman AF, Regnery R, Jameson P, et al. Differentiation of Bartonella-like isolates at the species level by PCR-restriction fragment length polymorphism in the citrate synthase gene[J]. J Clin Microbiol, 1995, 33(7): 1797-1803. |
| [8] |
Tamura K, Stecher G, Peterson D, et al. Mega 6:molecular evolutionary genetics analysis version 6.0[J]. Mol Biol Evol, 2013, 30(12): 2725-2729. DOI:10.1093/molbev/mst197 |
| [9] |
Bondoso J, Harder J, Lage OM. rpoB gene as a novel molecular marker to infer phylogeny in Planctomycetales[J]. Antonie Van Leeuwenhoek, 2013, 104(4): 477-488. DOI:10.1007/s10482-013-9980-7 |
| [10] |
Bai Y, Kosoy M, Martin A, et al. Characterization of Bartonella strains isolated from black-tailed prairie dogs (Cynomys ludovicianus)[J]. Vector Borne Zoonotic Dis, 2008, 8(1): 1-5. DOI:10.1089/vbz.2007.0136 |
| [11] |
Weinman D, Kreier JP. Bartonella and Grahamella[M]//Kreier JP. Parasitic Protozoa. London:Academic Press, 1977:197-233.
|
| [12] |
Inoue K, Kabeya H, Hagiya K, et al. Multi-locus sequence analysis reveals host specific association between Bartonella washoensis and squirrels[J]. Vet Microbiol, 2011, 148(1): 60-65. DOI:10.1016/j.vetmic.2010.08.007 |
| [13] |
宋秀平, 栗冬梅, 贾丽军, 等. 内蒙古小型兽类巴尔通体感染情况调查[J]. 中国媒介生物学及控制杂志, 2015, 26(3): 233-237. DOI:10.11853/j.issn.1003.4692.2015.03.004 |
| [14] |
Li DM, Hou Y, Song XP, et al. High prevalence and genetic heterogeneity of rodent-borne Bartonella species on Heixiazi Island, China[J]. Appl Environ Microbiol, 2015, 81(23): 7981-7992. DOI:10.1128/AEM.02041-15 |
 2017, Vol. 28
2017, Vol. 28