扩展功能
文章信息
- 单振菊, 邱德义, 陈佩, 岳巧云
- SHAN Zhen-ju, QIU De-yi, CHEN Pei, YUE Qiao-yun
- 克隆法检测不同环境下美洲大蠊携带细菌的比较研究
- The research of bacteria carried by Periplaneta americana from different environments by cloning method
- 中国媒介生物学及控制杂志, 2017, 28(5): 428-432
- Chin J Vector Biol & Control, 2017, 28(5): 428-432
- 10.11853/j.issn.1003.8280.2017.05.004
-
文章历史
- 收稿日期: 2017-04-26
- 网络出版时间: 2017-08-09 14:19
2 广东药科大学公共卫生学院, 广东 广州 510006;
3 中山大学生命科学学院, 广东 广州 510275
2 College of Public Health, Guangdong Pharmaceutical University;
3 College of Life Science Sun Yat-sen University
据资料报道,1只蜚蠊体表可携带1 400万个细菌,蜚蠊的一粒粪便也带有上百万个细菌[1],蜚蠊与人类生活关系密切,是全球性的卫生害虫,能传播多种疾病,危害人类健康[2]。随着我国国际贸易的持续增长,输入性蜚蠊的种类和数量也在不断增加,由蜚蠊传播引起的疾病也越来越多,给人类的健康带来很大威胁[3]。近10年来,国内外学者进行了大量关于蜚蠊携带细菌的调查研究,这些病原菌可引起肺炎、脓胸、脑膜炎、心内膜炎以及败血症等,有的还具有致死性[4-6]。16S rRNA基因(rDNA)是目前应用最广的细菌分子鉴定的靶基因之一,广泛存在于细菌等原核生物的基因组中。细菌16S rRNA基因序列由保守区和可变区组成,两者互相交错排列。保守区序列为所有细菌共有,细菌间差别较小[7]。细菌的16S rRNA有9个可变区(V1~V9),该可变区在不同种的细菌间序列存在一定差异,可用于细菌种类的鉴定[8-9]。
研究报道,V6区适合鉴定除肠杆菌外的其他所有细菌,V4、V5、V7和V8区不能用于种属鉴定[8]。V2、V3高变区能对大多数细菌进行鉴定,但其片段较短[10],V4高变区适合鉴定较复杂的细菌[11]。本研究尝试选取V3~V4两个高变区组合基因片段来鉴定医学媒介生物携带的细菌种类,利用克隆的方法对不同环境下蜚蠊体内、体表携带的细菌进行检测,掌握不同环境下蜚蠊携带细菌的基本情况,为指导中山地区口岸和疾病控制部门开展蜚蠊监测与防治提供资料。
1 材料与方法 1.1 样本采集2016年8-9月,利用捕捉法在中山地区医院、港口、居民区3个不同地点采集蜚蠊。采集后样本置于-70 ℃冰箱冷冻处死并保存。在生物安全柜中使用经75%乙醇擦拭灭菌后的显微镜鉴定其种类,每个地点选取4~5只美洲大蠊(Periplaneta americana)置于已灭菌的试管中,于-70 ℃保存备用。
1.2 蜚蠊携带细菌DNA的提取 1.2.1 蜚蠊体表携带细菌DNA的提取每个地点(医院、港口、居民区)各取4~5只冷冻处死的美洲大蠊,分别置于灭菌的离心管中,作为平行,在每个离心管中加入2 ml的0.9% NaCl,漩涡振荡30 s,8 900×g离心3 min,留下底部约50 μl,废弃物置于75%乙醇中消毒处理丢弃;剩余的50 μl溶液转移至另一只灭菌离心管中,该过程重复3次。将收集的菌液95 ℃水浴10 min热裂解细菌,13 400×g离心2 min,收集上清液,4 ℃保存备用。
1.2.2 蜚蠊体内携带细菌DNA的提取将1.2.1体表清洗过的蜚蠊移入装有1 ml 75%乙醇的离心管中浸泡5 min进行消毒处理,重复3次;之后加入2 ml 0.9% NaCl,漩涡振荡30 s清洗表面残余的乙醇,吸净溶液后将样本放置在生物安全柜中晾干15 min。用灭菌镊子将样本移入到新离心管中,将标本腹部研碎成糊状,然后采用1.2.1中同样的收集方式收集模板DNA,废弃物置于75%乙醇中消毒处理后丢弃。
1.3 细菌的扩增16S rDNA V3~V4可变区引物:V3-F:5′-CCA GAC TCC TAC GGG AGG CAG-3′,V4-R:5′-GGA CTA CHV GGG TWT CTA AT-3′[12](由Thermo Fisher Scientific Inc广州公司合成)。对提取的蜚蠊体内、体表的细菌DNA进行PCR扩增和凝胶电泳分析。
PCR反应体系(100 μl):2×KOD Buffer 50 μl;dNTP(2 mmol/L)5 μl,KOD FX polymerase(Toyobo Life Science Department)2 μl(1 U/μl),引物V3-F(20 mmol/L)2 μl,引物V3-R(20 mmol/L)2 μl,模板DNA 6 μl,加ddH2O补足至100 μl。PCR反应条件:94 ℃预变性2 min;98 ℃变性10 s,45 ℃退火30 s,68 ℃延伸30 s,30个循环;68 ℃延伸10 min,10 ℃保温。
1.4 克隆和测序将PCR产物进行连接、转化、蓝白斑筛选[13],每个样品挑取50个菌落送上海立菲生物科技有限公司进行测序。
1.5 序列分析将测得的DNA序列在美国国立生物技术信息中心(https://www.ncbi.nlm.nih.gov/pubmed/)数据库和中国微生物与病毒主题数据库(http://www.micro.csdb.cn/index.html)中进行检索,选择同源性≥95%的确定为同一个属[14],同源性≥98%的确定为同一个种。
1.6 细菌致病性分析根据《人及动物病原细菌学》[15],将比对获得的细菌进行致病性分析。
2 结果 2.1 细菌16S rDNA PCR扩增利用V3F-V4R引物,对蜚蠊携带细菌16S rDNA进行扩增,能获得有效的DNA条带,见图 1。
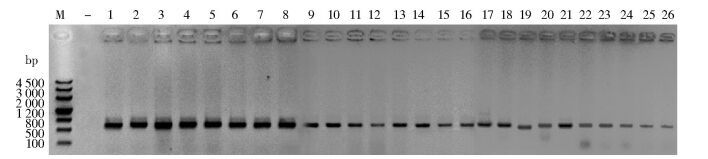
|
| 注:M. Marker,标准分子质量;-.阴性对照;1~8.港口样品;9~16.居民区样品;17~26.医院样品 图 1 美洲大蠊体内外携带细菌V3~V4扩增结果 Figure 1 V3-V4 amplification of bacteria carried by P. americana inside and outside of the body |
| |
在港口内采集的美洲大蠊体内检出细菌32属34种,体表检出35属40种,体内、体表共检出55属65种,其中致病菌16属21种。在居民区内采集的美洲大蠊体内检出细菌31属37种,体表检出51属59种,体内、体表共检出73属86种,其中致病菌13属19种。在医院内采集的美洲大蠊体内检出细菌33属42种,体表检出54属73种,体内、体表共检出68属101种,其中致病菌15属25种,见表 1。
 |
从图 2可见,从港口、居民区、医院采集的美洲大蠊,同一地点美洲大蠊体表携带细菌种类多于体内(A5、B5、C6);同一个体体内、体表携带相同种类的细菌所占比例较低,最低的为港口的A3和居民区的B4,其体内、体表共同携带的细菌种类均为0,最高的为居民区的B3,其体内、体表共同携带的细菌种类达38.8%。

|
| 注:A1~A4.港口4个平行样本蜚蠊体内、体表分别携带细菌种类;A5.港口4个样本体内、体表携带细菌种类。B1~B4.居民区4个平行样本蜚蠊体内、体表分别携带细菌种类;B5.居民区4个样本体内、体表携带细菌种类。C1~C5.医院5个平行样本蜚蠊体内、体表分别携带细菌种类;C6.医院4个样本体内、体表携带细菌种类。左边圆圈代表体内携带的细菌种类数,右边圆圈代表体表携带的细菌种类数,交叉部分代表体内、体表携带相同种类的细菌种类数 图 2 中山地区不同地点美洲大蠊同一个体体内、体表携带细菌种类韦恩分析 Figure 2 Venn analysis of bacteria carried by P. americana inside and outside of the body from the same individual collected from port, residential and hospital areas |
| |
从图 3可见,从港口、居民区、医院采集的美洲大蠊,同一地点不同个体体内、体表携带相同种类细菌所占比例较低。港口美洲大蠊4个不同个体体内、体表、体内+体表携带相同种类的细菌分别为1、1和2种;居民区美洲大蠊4个不同个体体内、体表、体内+体表携带相同种类的细菌均为0,医院美洲大蠊体内、体表、体内+体表携带相同种类细菌分别为0、1和2种。

|
| 注:A1~A3、B1~B3、C1~C3.分别为港口、居民区、医院采集的美洲大蠊不同个体间体内、体表携带细菌种类。GK.港口;XQ.居民区;YY.医院;N.体内;W.体表 图 3 中山地区不同地点美洲大蠊不同个体体内、体表携带细菌种类韦恩分析 Figure 3 enn analysis of bacteria carried by different individual P. americana inside and outside of the body collected from ports, residential and hospital areas |
| |
不同环境下美洲大蠊携带相同种类的细菌所占比例均较低,分别为4、4、11种,见图 4。
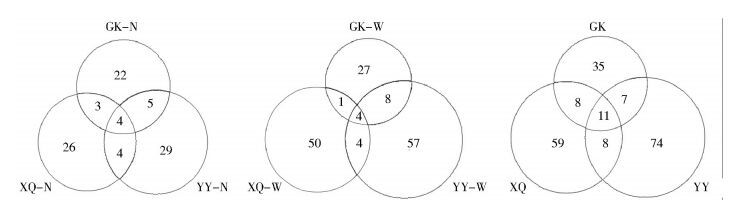
|
| 注:GK.港口;XQ.居民区;YY.医院;N.体内;W.体表 图 4 中山地区不同地点采集美洲大蠊体内、体表、体内+体表携带细菌种类韦恩分析 Figure 4 Venn analysis of bacteria carried inside and outside the body of P. americana collected from ports, residential and hospital areas |
| |
蜚蠊是全球性的卫生害虫,有很多种类生活在室内,取食并污染食物、衣物和生活用具,传播疾病和寄生虫。近年来,一些学者也致力于蜚蠊携带细菌的研究,如马晓光等[6]对从福建口岸截获的德国小蠊(Blattella germanica)携带细菌情况进行了研究;唐振强等[7]对河南省城市居民区德国小蠊携带的细菌进行了研究;这些均是针对某一环境下蜚蠊携带细菌进行的研究,未对不同环境下蜚蠊体内、体表携带细菌的情况进行系统的比较和分析。本研究利用克隆法对细菌16S rRNA V3~V4区进行了分析,以了解中山地区不同环境下美洲大蠊体内、体表携带细菌的情况,并对其细菌致病性进行了分析。
实验数据表明,港口、医院和居民区3个地点采集的蜚蠊体外携带的细菌种类均多于体内。医院内采集的美洲大蠊体内外携带的细菌种类最多,且致病菌的种类较多,致病性较强;居民区内采集的美洲大蠊体内外携带的细菌种类相对次之,致病菌较少;而港口内采集的美洲大蠊体内外携带的细菌种类最少;但致病菌数量较多,仅次于医院。
从实验结果看,无论同一地点还是不同地点捕获的美洲大蠊体内、体表携带细菌的种类均有差异。因此,很难确定蜚蠊体内、体表携带的细菌与环境有关。导致该结果的原因:① 可能是由于蜚蠊在采集前的活动范围不同;② 由于非单一菌株16S rRNA的分子鉴定扩增转化后挑单克隆进行,存在菌落漏检等弊端,导致同一地点采集的蜚蠊不同个体间所携带的细菌种类有所差异。该结果还有待于进一步研究。
通过对不同地点美洲大蠊携带的致病菌进行分析,3个地点均检出了较多的致病菌和条件性致病菌,主要包括不动杆菌属、假单胞菌属、各种肠杆菌科(包括克雷伯菌属、大肠埃希菌、沙雷菌属和变形杆菌属)。最近,WHO发表了首份抗生素耐药“重点病原体”清单,这些细菌均包括在内,这是对人类健康构成最大威胁的12种细菌种族。环境中存在的这些致病菌会由于蜚蠊特有的生物学习性传染到食物或者工具上而引起人类感染,造成疾病的传播。特别是医院环境下,蜚蠊携带的细菌致病性较强,很多细菌均能通过伤口进行感染,如果医院中患者带有伤口,或者医疗工具被蜚蠊接触过很容易引起人类感染。因此,医院、口岸等部门应加强蜚蠊的监测与防制。
| [1] |
朱临, 孙立新, 胡红霞, 等. 16S rRNA基因序列分析法在输入性蜚蠊携带病原菌检测中的应用研究[J]. 中国国境卫生检疫杂志, 2011, 34(3): 158-161. |
| [2] |
徐毅. 蜚蠊病原体携带研究进展[J]. 实用预防医学, 2015, 22(5): 636-639. |
| [3] |
王宝麟. 中国国境口岸媒介生物监测与控制策略[J]. 中华卫生杀虫药械, 2007, 13(2): 77-79. |
| [4] |
蒋三俊. 药用地鳖虫种类及其螨害的防治[J]. 特种经济动植物, 2001, 4(4): 9. |
| [5] |
宋锋林, 吴刚, 薛芳, 等. 国境口岸媒介生物携带病原体的研究[J]. 中国国境卫生检疫杂志, 2009, 32(5): 368-374. |
| [6] |
马晓光, 宋秀平, 高博, 等. 16S rRNA序列分析法检测国境口岸截获德国小蠊携带病原菌初探[J]. 中国媒介生物学及控制杂志, 2007, 18(6): 459-461. |
| [7] |
唐振强, 赵奇, 刘吉起, 等. 16S rRNA序列分析法对城市居民区德国小蠊携带致病菌检测研究[J]. 中国媒介生物学及控制杂志, 2013, 24(1): 64-66. |
| [8] |
Chakravorty S, Helb D, Burday M, et al. A detailed analysis of 16S ribosomal RNA gene segments for the diagnosis of pathogenic bacteria[J]. J Microbiol Met, 2007, 69(2): 330-339. DOI:10.1016/j.mimet.2007.02.005 |
| [9] |
Moreau MM, Eades SC, Reinemeyer CR. Illumina sequencing of the V4 hyspervariable region 16S rRNA gene reveals extensive changes in bacterial communities in the cecum following carbohydrate oral infusion and development of early-stage acute laminitis in the horse[J]. Vet Microbiol, 2014, 168(2/4): 436-441. |
| [10] |
Becker K, Harmsen D, Mellmann A, et al. Developmentand evaluation of a quality-controlled ribosomal sequence database for 16S ribosomal DNA-based identification of Staphylococcus species[J]. J Clin Microbiol, 2004, 42(11): 4988-4995. DOI:10.1128/JCM.42.11.4988-4995.2004 |
| [11] |
Claesson MJ, Wang Q, O'Sullivan O, et al. Comparison of two next-generation sequencing technologies for resolving highly complex microbiota composition using tandem variable 16S rRNA gene regions[J]. Nucleic Acids Res, 2010, 38(22): e200. DOI:10.1093/nar/gkq873 |
| [12] |
Jin CY, Zeng ZY, Fu ZW, et al. Oral imazalil exposure induces gut microbiota dysbiosis and colonic inflammation in mice[J]. Chemosphere, 2016, 160: 349-358. DOI:10.1016/j.chemosphere.2016.06.105 |
| [13] |
Yue QY, Wu KL, Qiu DY, et al. A formal re-description of the cockroach Hebardina concinna anchored on DNA barcodes confirms wing polymorphism and identifies morphological characters for field identification[J]. PLoS One, 2014, 9(9): e106789. DOI:10.1371/journal.pone.0106789 |
| [14] |
焦振泉, 刘秀梅. 16S rRNA序列同源性分析与细菌系统分类鉴定[J]. 国外医学卫生学分册, 1998, 25(1): 12-16. |
| [15] |
杨正时, 房海. 人及动物病原细菌学[M]. 石家庄: 河北科学技术出版社, 2003, 2-180.
|
 2017, Vol. 28
2017, Vol. 28


