扩展功能
文章信息
- 陈佩, 陈健, 邱德义, 何秋星
- CHEN Pei, CHEN Jian, QIU De-yi, HE Qiu-xing
- 广东省中山地区蜚蠊中共生菌沃尔巴克氏体的监测与分析
- Monitoring and analysis of symbiotic Wolbachia in cockroaches at Zhongshan area
- 中国媒介生物学及控制杂志, 2017, 28(5): 422-427
- Chin J Vector Biol & Control, 2017, 28(5): 422-427
- 10.11853/j.issn.1003.8280.2017.05.003
-
文章历史
- 收稿日期: 2017-06-20
- 网络出版时间: 2017-08-09 16:08
2 广东药科大学, 广州 510006
2 Guangdong Pharmaceutical University
沃尔巴克氏体(Wolbachia)属于变形菌门(Proteobacteria)变形菌纲α亚群(Alphaproteobacteria)立克次体目(Rickettsiales)立克次体科(Rickettsiaceae)沃尔巴克氏体属(Wolbachia),是一类在节肢动物内广泛存在、呈母系遗传的革兰阴性胞内共生菌[1]。沃尔巴克氏体于1924年在尖音库蚊(Culex pipiens)的生殖组织里首次发现[2],研究表明约40%的节肢动物体内自然携带沃尔巴克氏体,而昆虫的感染率高达65%[3-4]。在沃尔巴克氏体分型及系统发育研究中,wsp是一种编码沃尔巴克氏体表面蛋白的基因,进化速率是所有已知沃尔巴克氏体基因中最快的[5],可以准确地揭示沃尔巴克氏体品系间的差异,Zhou等[6]基于wsp 2.5%的差异,通过建立系统进化树将沃尔巴克氏体分为4个组(A~D);随着研究的深入,在结合多种沃尔巴克氏体分型引物的基础上,目前沃尔巴克氏体被分为A~Q共16个组[7]。沃尔巴克氏体通过诱导孤雌生殖、雌性化和杀雄现象,不仅能调控其宿主生殖活动的机制[8],还可能引起其宿主种群偏雌性比,如潘雪红等[9]在对赤眼蜂种群的研究中提出沃尔巴克氏体的存在趋向于使该种群形成100%的偏雌性比。
蜚蠊可以携带多种病原体,与人类的健康息息相关,它作为一种医学媒介生物一直是卫生防疫和检验检疫的重点监控对象[10]。目前国内外关于沃尔巴克氏体的研究主要集中在蚊虫、果蝇、叶蝉、粉虱类、白蚁和蜘蛛等,而对于蜚蠊感染沃尔巴克氏体的研究较少,仅Vaishampayan等[11]研究证实Supella longipalpa和Blattella sp.两种蜚蠊体内携带沃尔巴克氏体以及金小宝等[12]在德国小蠊(Blattella germanica)体内检测到沃尔巴克氏体的存在。本研究选用广东省中山地区生存的多种蜚蠊为研究对象,以wsp为靶基因对沃尔巴克氏体进行分子检测,初步调查其沃尔巴克氏体的感染情况;根据基因序列及其编码氨基酸的差异,参照Zhou等[6]的分型方法将获得的42条wsp基因序列分为不同的单倍型,通过构建系统进化分析树对感染的沃尔巴克氏体进行分型研究,为进一步开展沃尔巴克氏体对蜚蠊种群影响的研究提供依据。
1 材料与方法 1.1 样本采集 1.1.1 采集地点样本采集地点均位于广东省中山市,分别为紫马岭公园(22°30′39″N,113°24′19″E)、金字山隧道(22°29′40″N,113°24′9″E)和金钟水库(22°28′49″N,113°22′42″E),以及在中山港口岸(22°34′19″N,113°28′25″E)截获的入境样本。
1.1.2 采集方法夜晚仔细搜索小灌木的叶尖、下水道口和角落,用小广口瓶捕捉蜚蠊,置于有小洞(透气)的瓶中,带回实验室进行形态鉴定和后续研究。口岸截获的入境样本为口岸一线卫生检疫人员送样。
1.1.3 种类鉴定形态鉴定参照《实用蜚蠊彩色图鉴》[13]。每只标本分别置于1.5 ml无菌离心管,-20 ℃保存备用。
1.2 总DNA的提取样本DNA提取均采用天根生化科技(北京)有限公司生产的血液/细胞/组织基因组DNA提取试剂盒(目录号:DP304)。在无菌操作环境下,切取单只成虫腹部装入1.5 ml离心管,研磨匀浆,按照试剂盒使用说明书提取基因组DNA。
1.3 wsp基因的PCR扩增wsp基因片段的PCR扩增引物为wsp 81F(5′-TGG TCC AAT AAG TGA TGA AGA AAC-3′)和wsp 691R(5′-AAA AAT TAA ACG CTA CTC CA-3′)[6],由宝生物工程(大连)有限公司合成。EX-Taq DNA聚合酶、dNTP等PCR试剂从TaKaRa公司购置。
wsp基因的PCR扩增参照Zhou等[6]的方法。PCR反应体系为50 μl:10倍PCR缓冲液5 μl,正向引物(20 μmol/L)1 μl,反向引物(20 μmol/L)1 μl,dNTP(10 μmol/L)4 μl,Ex-Taq DNA聚合酶1 μl,模板DNA 4 μl,无菌水定容至50 μl。PCR反应条件:95 ℃变性3 min;94 ℃ 1 min,52 ℃ 1 min,72 ℃ 1 min,35个循环;72 ℃延伸10 min。PCR反应结束后,PCR产物电泳检测(100 V电压,340 mA电流,电泳缓冲液为1×TAE,电泳30 min)。凝胶系统成像并记录。
1.4 测序与分析采用PCR产物直接测序法,将PCR产物送交上海立菲生物科技有限公司测序,测序引物同扩增引物。
1.5 数据分析 1.5.1 序列分析将测序所得序列去除两端引物部分,并与GenBank中相关序列进行同源性分析,同时从GenBank中下载相关序列,利用Mega 6.0软件中的Test Maximum Likelihood tree进行系统进化分析和进化树的制作。在Transeq网站(http://www.ebi.ac.uk/Tools/st/emboss_transeq/)上选择编码细菌蛋白的密码子表,将wsp基因序列翻译成蛋白质序列。
1.5.2 统计学分析蜚蠊雌雄样本之间感染率的差异分析采用SPSS 20.0软件处理数据,统计方法采用配对t检验,检验标准α=0.01,P<0.01为差异有统计学意义。t值按照以下公式计算:
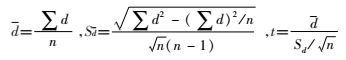
|
本研究收集到中山地区不同采集地点的蜚蠊11种及中山港口岸截获入境蜚蠊1种,共12种154只蜚蠊样本。具体种类、性别、数量和采集地点见表 1。
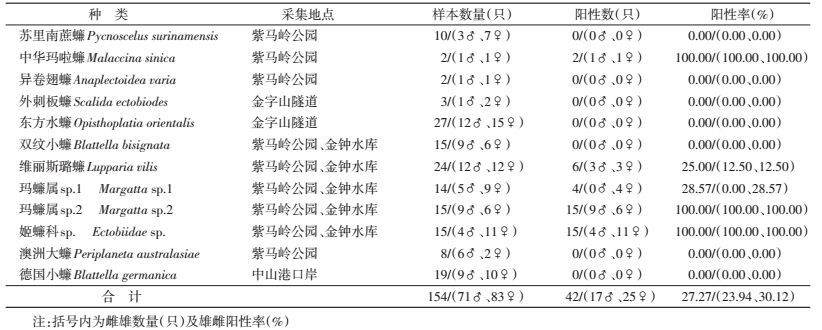 |
154只样本的PCR产物经凝胶电泳检测共有42个样本有目标PCR产物,经测序后,共得到42条沃尔巴克氏体wsp基因序列。与GenBank中相关序列进行同源性分析,中华玛啦蠊、玛蠊属sp.1、玛蠊属sp.2和姬蠊科sp.的wsp基因序列相似性均高于98%,维丽丝璐蠊的wsp基因序列相似性仅为81%。将所得到的42条wsp基因序列上传至GenBank,结果见表 2。
测序获得的42条wsp基因序列的序列长度在555~570 bp之间,均在文献报道的wsp引物所能扩增的序列长度范围(550~592 bp)内[6],见表 2。测序wsp基因进行蛋白质翻译分析,并将其氨基酸序列进行同源性比对,发现42条氨基酸序列可以聚类为8种不同的氨基酸序列,即可划分为8类wsp基因单倍型,编号分别为DBX001~DBX008。其中,在玛蠊属sp.2样本中存在两种wsp单倍型序列,而维丽斯璐蠊和姬蠊科sp.存在3种,中华玛啦蠊和玛蠊属sp.1仅存在1种(表 2)。进而比对每类wsp基因单倍型包含的编码序列,并无碱基差异,相似度均为100%。单倍型序列的差异在64.53%~99.82%之间,其中最低同源性在DBX005与DBX008之间,最高同源性在DBX006与DBX007之间,8种单倍型序列对应的氨基酸差异在51.45%~99.45%之间(表 3)。
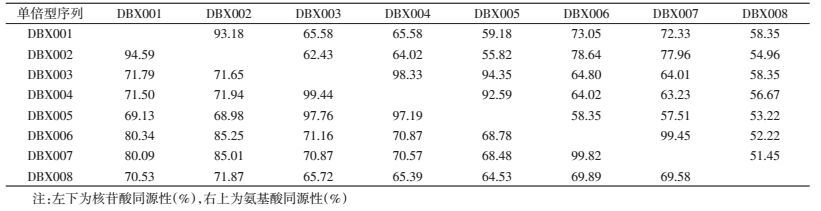 |
经测序分析后,在检测的154只蜚蠊(雄虫71只、雌虫83只)中,42只样本检测结果为阳性(雄虫17只、雌虫25只),总阳性率为27.27%;在检测的14种蜚蠊中,种群阳性率为35.71%,其中维丽斯璐蠊、玛蠊属sp.1、玛蠊属sp.2、姬蠊科sp.和中华玛啦蠊5种蜚蠊存在沃尔巴克氏体阳性样本,而所有的苏里南蔗蠊、双纹小蠊、外刺板蠊、异卷翅蠊、澳洲大蠊、东方水蠊、德国小蠊样本检测结果均为阴性。
2.3.2 雌雄个体感染差异在5种感染沃尔巴克氏体的样本中,中华玛啦蠊、维丽斯璐蠊、玛蠊属sp.2和姬蠊科sp.的雌雄感染率相同,仅玛蠊属sp.1中,雌性感染率为28.57%,雄性未检出个体感染(表 4),雄性总体感染率为23.94%,雌性为30.12%;经统计学检验,雌雄个体间感染率差异无统计学意义(|t|=0.542,|t|<t0.01(4)=2.776,P>0.01)。
 |
将所获得的8个wsp单倍型基因序列与GenBank中的wsp序列共同进行Maximum Likelihood tree(ML)树分析,系统进化分析结果显示,8个序列被划分在3个超级大组中(图 1),其中DBX001、DBX002、DBX006和DBX007为wAlbB型沃尔巴克氏体,属于Supergroup B、DBX001和DBX002的核酸同源性为94.59%,处于单独的一个进化分支上,DBX006和DBX007的核酸同源性为99.82%,与来自致倦库蚊(Culex pipiens quinquefasciatus)(DQ842462)的一个wsp基因序列遗传距离最近;DBX008为wAlbD型沃尔巴克氏体,属于Supergroup D;DBX003、DBX004和DBX005为wAlbF型沃尔巴克氏体,与来自温带臭虫(Cimex lectularius)(登记号为DQ842459)的一个wsp基因序列同属于Supergroup F。

|
| 图 1 沃尔巴克氏体wsp序列系统进化树 Figure 1 Phylogenetic analysis of wsp genes from Wolbachia |
| |
中华玛啦蠊样本中存在的DBX001和DBX002均属于Supergroup B,因此感染中华玛啦蠊的沃尔巴克氏体为wAlbB型;感染玛蠊属sp.1和玛蠊属sp.2的沃尔巴克氏体同为wAlbB型;感染维丽斯璐蠊的沃尔巴克氏体为wAlbF型,但其置信值仅为55;而姬蠊科sp.样本中存在的DBX001和DBX008分别属于Supergroup B和Supergroup D,因此感染姬蠊科sp.种群的沃尔巴克氏体为wAlbB型和wAlbD型。
3 讨论在Vaishampayan等[11]研究的5种蜚蠊中,有2种蜚蠊感染沃尔巴克氏体,其感染沃尔巴克氏体物种的比率为40.00%,且均为wAlbF型;本研究在此基础上,检测了12种蜚蠊,有5种蜚蠊感染沃尔巴克氏体,其感染沃尔巴克氏体物种的比率为41.67%,与之前研究的比率相近。在本研究所得到的8种wsp单倍型基因序列中,不仅有wAlbF型,还有wAlbD型和wAlbB型;中华玛啦蠊、玛蠊属sp.2和姬蠊科sp.的感染率均为100%,维丽斯璐蠊和玛蠊属sp.1的感染率分别为25.00%和28.57%,其余7种蜚蠊包括德国小蠊均无感染。金小宝等[12]曾报道从德国小蠊中检测出沃尔巴克氏体,但其检测的标本仅为1只,与本研究中监测的19只德国小蠊全部wsp基因扩增阴性、未检测出沃尔巴克氏体的结果不一致。原因可能与德国小蠊的种群感染率较低,而本研究所用德国小蠊的样本量不足有关,或者与同一蜚蠊物种是否感染沃尔巴克氏体也可能存在地域差异性有关,有待进一步研究。
研究表明,沃尔巴克氏体的共生会对宿主的行为产生多种影响,包括诱导孤雌生殖、雌性化和杀雄现象等[14];诱导孤雌生殖是通过使内含沃尔巴克氏体的雌性个体产出的卵不经过受精的作用直接发育成雌性后代,雌性化是使原本应发育为雄性的个体发育成雌性个体,这两种方式均能提高雌性个体的出生率,而杀雄现象则是通过杀死未产出的雄性个体从而降低雄性出生率[15];综上所述,这3种作用均能引起宿主种群偏雌性比。本研究在进行雌雄感染率分析时,通过统计学推断,雌雄之间感染率的差异无统计学意义。然而在14只玛蠊属sp.1样本中,雌雄之间的差异却很明显,检出的4只阳性样本均为雌性,雄性则未检出感染;原因可能是中山地区内含沃尔巴克氏体的玛蠊属sp.1种群存在明显的偏雌性,抑或是本实验玛蠊属sp.1样本量太小,从而导致雌雄之间感染率差异明显,在后续研究中有必要提高样本基数进行更深入的研究分析。
将得到的维丽斯璐蠊的wsp基因序列与GenBank中相关序列进行同源性分析时,其序列相似性仅为81%,而且其wsp单倍型基因序列DBX003、DBX004、DBX005在进行ML进化树分析时,虽然其被分到了Supergroup F,但其置信度仅为55(<70),表示分组结果并不可信,原因可能是wsp基因在16S rDNA、ftsZ、groEL、gltA等用于沃尔巴克氏体分型的基因中进化速度最快,其基因重组率也较高,因此本研究所得到的wsp单倍型基因DBX003、DBX004和DBX005可能为目前未发现的wsp基因序列;但是也有研究表明,用wsp基因对沃尔巴克氏体进行基因分型会造成聚类混乱的问题,不能准确反映沃尔巴克氏体进化的真实情况[16],因此本研究中的wsp单倍型基因DBX003、DBX004和DBX005是否为新发现的wsp基因序列,还需进一步通过多位点序列分型技术来验证[5]。
| [1] |
郭颂, 凌锋, 王金娜, 等. 浙江省中东部白纹伊蚊共生菌沃尔巴克氏体的调查研究[J]. 中国媒介生物学及控制杂志, 2015, 26(6): 545-549. DOI:10.11853/j.issn.1003.4692.2015.06.002 |
| [2] |
Hertig M, Wolbach SB. Studies on rickettsia-like micro-organisms in insects[J]. J Med Res, 1924, 44(3): 329-374. |
| [3] |
Hilgenboecker K, Hammerstein P, Schlattmann P, et al. How many species are infected with Wolbachia?-a statistical analysis of current data[J]. FEMS Microbiol Lett, 2008, 281(2): 215-220. DOI:10.1111/fml.2008.281.issue-2 |
| [4] |
Zug R, Hammerstein P. Still a host of hosts for Wolbachia:analysis of recent data suggests that 40% of terrestrial arthropod species are infected[J]. PLoS One, 2012, 7(6): e38544. DOI:10.1371/journal.pone.0038544 |
| [5] |
Baldo L, Hotopp JCD, Jolley KA, et al. Multilocus sequence typing system for the endosymbiont Wolbachia pipientis[J]. Appl Environ Microb, 2006, 72(11): 7098-7110. DOI:10.1128/AEM.00731-06 |
| [6] |
Zhou WG, Rousset F, O'Neill S. Phylogeny and PCR-based classification of Wolbachia strains using wsp gene sequences[J]. P Proc R Soc B:Biol Sci, 1998, 265(1395): 509-515. DOI:10.1098/rspb.1998.0324 |
| [7] |
Glowska E, Dragun-Damian A, Dabert M, et al. New Wolbachia supergroups detected in quill mites(Acari:Syringophilidae)[J]. Infect Genet Evol, 2015, 30: 140-146. DOI:10.1016/j.meegid.2014.12.019 |
| [8] |
Sinkins SP. Wolbachia and cytoplasmic incompatibility in mosquitoes[J]. Insect Biochem Mol Biol, 2004, 34(7): 723-729. DOI:10.1016/j.ibmb.2004.03.025 |
| [9] |
潘雪红, 陈科伟, 吕燕青, 等. Wolbachia对赤眼蜂的性别调控机制及生理影响[J]. 昆虫知识, 2007, 44(1): 32-36. DOI:10.7679/j.issn.2095-1353.2007.007 |
| [10] |
金俊. 国际航行船舶传带医学媒介生物(蜚蠊)风险评估体系研究[D]. 南京: 南京理工大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10288-1014175327.htm
|
| [11] |
Vaishampayan PA, Dhotre DP, Gupta RP, et al. Molecular evidence and phylogenetic affiliations of Wolbachia in cockroaches[J]. Mol Phylogenet Evol, 2007, 44(3): 1346-1351. DOI:10.1016/j.ympev.2007.01.003 |
| [12] |
金小宝, 褚夫江, 朱家勇. 德国小蠊共生菌沃尔巴克氏体的分子检测与分析[J]. 中国媒介生物学及控制杂志, 2008, 19(2): 121-122. |
| [13] |
岳巧云. 实用蜚蠊彩色图鉴[M]. 广州: 暨南大学出版社, 2015, 21-151.
|
| [14] |
Werren JH, Baldo L, Clark ME. Wolbachia:master manipulators of invertebrate biology[J]. Nat Rev Microbiol, 2008, 6(10): 741-751. DOI:10.1038/nrmicro1969 |
| [15] |
郑雅. Wolbachia诱导昆虫宿主细胞质不亲和的分子机理研究[D]. 武汉: 华中师范大学, 2012.
|
| [16] |
Jiggins FM, von der Schulenburg JHG, Hurst GDD, et al. Recombination confounds interpretations of Wolbachia evolution[J]. Proc Roy Soc B:Biol Sci, 2001, 268(1474): 1423-1427. DOI:10.1098/rspb.2001.1656 |
 2017, Vol. 28
2017, Vol. 28