扩展功能
文章信息
- 许艳子, 吴楠, 张振, 王敬忠
- XU Yan-zi, WU Nan, ZHANG Zhen, WANG Jing-zhong
- 深圳市2014年登革热疫情时空分析
- Spatial-temporal analysis of dengue fever in Shenzhen, China, 2014
- 中国媒介生物学及控制杂志, 2017, 28(4): 340-342
- Chin J Vector Biol & Control, 2017, 28(4): 340-342
- 10.11853/j.issn.1003.8280.2017.04.008
-
文章历史
- 收稿日期: 2017-04-25
- 网络出版时间: 2017-06-12 16:24
2 深圳市疾病预防控制中心, 广东 深圳 518055
2 Shenzhen Center for Disease Control and Prevention
登革热(dengue fever,DF)是一种重要的热带传染病,重症登革热是一些亚洲和拉美国家儿童的重要死因,我国本地暴发流行区域集中在东南沿海地区[1-3]。当前全球气候变暖出现显著变化,政府间气候变化专门委员会(IPCC)预测气候变暖可加剧登革热和血吸虫病等疾病的流行,使登革热分布扩散到较高纬度或高海拔地区。2013年河南省暴发登革热,预示我国登革热的发生范围在扩大,将可能有更多区域面临其暴发流行的风险[4]。2014年深圳市登革热病例数达近年来的高峰。有研究应用描述性流行病学方法对2014年深圳市登革热病例资料进行了统计,但未对数据的时间及空间属性进行分析[5]。本研究利用地理信息系统(GIS)和SaTScan软件回顾性整理2014年深圳市登革热病例资料,以月为时间单位、以街道为空间单位进行时空聚集性分析,为登革热监测和防控提供相关依据。
1 材料与方法 1.1 研究对象病例数据由深圳市CDC提供,包括2014年全年各月、各街道的登革热发病数。深圳市本地登革热发病总数达454例,疫情共持续6个月(7-12月)。
1.2 研究区域深圳市街道级电子地图由深圳市国土资源管理局提供;人口数据通过深圳市统计局网站统计年鉴查阅获取。
1.3 方法 1.3.1 空间自相关分析空间自相关分析是指同一变量在不同空间位置的相关性,包括全局自相关分析和局部自相关分析[6-7]。本研究利用ArcGIS 10.2软件,选择Moran’s I系数进行分析。随机分布假设下Moran’s I用Z检验,当Z>1.96,差异有统计学意义,说明存在空间自相关性[8]。选择热点分析(Getis-Ord Gi*)进行局部自相关分析,分析登革热发病热点、冷点区域的分布情况[9]。
1.3.2 时空扫描分析采用SaTScan软件进行时空扫描分析,即探测研究区域内是否存在聚集性及其确切位置、风险大小,并检验聚集性有无统计学意义[10-11]。基于泊松模型(Poisson Model)计算其理论发病数,用实际发病数和理论发病数构建对数似然比(log likelihood ratio,LLR)检验统计量,选取LLR值最大的窗口为高发病聚集中心[12]。RR值为观测地区实际病例数与对应的SaTScan分析中预期的病例数的比值,数值越大,说明该案例区出现疫情异常的可能性越大。
2 结果 2.1 登革热报告发病率空间分布2014年深圳市本地登革热发病数为454例,发病率为3.60/10万,疫情持续6个月(7-12月)。2014年深圳市各街道登革热发病率以颜色来区分,颜色越深表示该区域发病率越高,见图 1。发病率最高是华富(25.06/10万)和蛇口(19.39/10万)街道,其次是新安(13.95/10万)、招商(12.92/10万)、南山(11.71/10万)、清水河(11.12/10万)、梅林(10.90/10万)、西丽(9.14/10万)、沙河(9.39/10万)、桃源(7.25/10万)和沙头(6.31/10万)街道。

|
| 图 1 2014年深圳市登革热发病率空间分布 Figure 1 Distribution of incidence of local dengue fever in Shenzhen city, 2014 |
| |
2014年深圳市本地登革热报告发病率呈全局正向空间自相关(Moran’s I=0.11,Z=2.88,P=0.003)。
2.3 登革热发病局部自相关性利用GIS空间分析方法对2014年深圳市本地登革热发病数进行热点分析(Getis-Ord Gi*),其中登革热发病高聚集区在深圳市西南地区,包括蛇口、招商、南山、粤海、南头、桃源、新安、沙河、香蜜湖、沙头和福保街道;登革热发病低聚集区包括松岗、光明、横岗和海山街道,其分布变化规律见图 2。
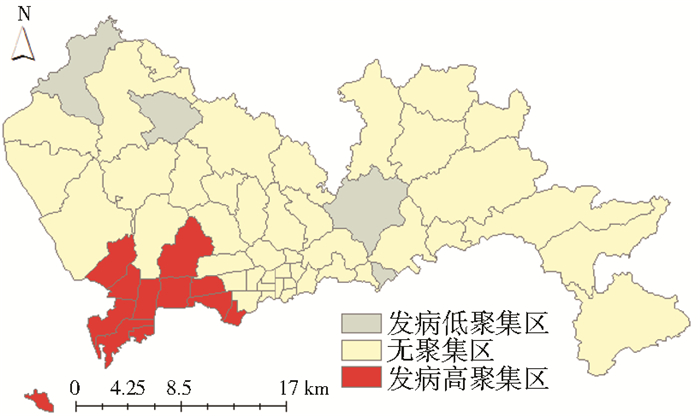
|
| 图 2 2014年深圳市登革热发病率局部空间自相关 Figure 2 Local spatial autocorrelation analysis of incidence of local dengue fever in Shenzhen city, 2014 |
| |
采用SaTScan软件,所选概率模型为Poisson分布,最大空间聚集选为危险总人口数的50%。对时间窗口进行逐月扫描。登革热高发病区域集中在蛇口、招商和粤海街道(LLR= 44.46,RR=7.30,P<0.001),高发病时间集中在9、10月。
3 讨论本研究采用空间自相关分析和时空扫描聚类分析方法对2014年深圳市登革热病例进行回溯性研究。应用Moran’s I系数进行全局自相关分析得出,2014年深圳市登革热发病全局呈空间正相关关系和空间聚集性。局部自相关分析结果显示,登革热发病高聚集区域主要在深圳市西南。SaTScan时空扫描分析结果与局部自相关分析结果相似。
气候变化通过影响虫媒的地理分布范围、提高繁殖速度及缩短病原体的潜伏期而直接影响登革热的传播[13]。深圳市是典型的亚热带季风气候,具有湿热的夏季、温暖的冬季,年平均气温22.4 ℃,雨量充足,年降雨量1 933.3 mm,有利于登革热传播媒介蚊类的孳生及繁殖。同时,深圳市边界有多个出入境口岸和海港码头,水网丰富,经济发展迅速,贸易往来活跃,境内外人口流动大且人口分布不均衡,集中在中部和西南部。地理环境、自然生态系统环境及社会因素的变化(人口流动大)等,均对登革热产生一定的影响[14]。可能是深圳市西南地区登革热发病率高和聚集流行的原因。
根据时间扫描结果分析,高发病率聚集的时间为9、10月,发病数较多,疫情暴发并迅速蔓延。易彬樘等[15]研究发现,媒介蚊虫密度影响登革热的传播,而蚊虫密度主要受气象因子气温和湿度的影响,气温是决定因子。温度对登革热病毒在蚊虫体内的发育及登革热的传播发挥重要作用。在18~36 ℃范围内,随着温度的增加,登革热病毒在蚊虫体内的发育时间缩短,在31 ℃达到高峰,然后开始下降[16]。有研究发现,在蚊虫的生存范围内,温度的小幅度升高使蚊虫叮咬更加频繁,从而增加传染性[17]。甘立勤等[18]研究2014年7-11月深圳市登革热发病资料及同期气象条件发现,登革热发病数与气象因素有相关性。2014年深圳市9-10月平均气温达到27.5 ℃,高于往年同期,且2014年深圳市全年相对湿度较高,达到74.3%,可能是深圳市登革热9、10月高发的原因。
通过GIS空间分析可视化及SaTScan时空扫描统计的结合分析,可最大限度地进行数据信息挖掘,时间空间聚集性直观地反映登革热的时空分布和变化特征,对登革热的监测与防控有重要意义。
| [1] |
岳玉娟, 任东升, 刘起勇. 2005-2013年中国大陆登革热疫情时空分布[J]. 疾病监测, 2015, 30(7): 555-560. DOI:10.3784/j.issn.1003-9961.2015.07.008 |
| [2] |
Brady OJ, Gething PW, Bhatt S, et al. Refining the global spatial limits of dengue virus transmission by evidence-based consensus[J]. PLoS Negl Trop Dis, 2012, 6(8): e1760. DOI:10.1371/journal.pntd.0001760 |
| [3] |
Halstead SB. Dengue haemorrhagic fever-a public health problem and a field for research[J]. Bull World Health Organ, 1980, 58(2): 1-21. |
| [4] |
Huang XY, Ma HX, Wang HF, et al. Outbreak of dengue fever in central China, 2013[J]. Biomed Environ Sci, 2014, 27(11): 894-897. |
| [5] |
黄亚兰, 阳帆, 黄达娜, 等. 2014年深圳市登革热流行特征分析[J]. 热带医学杂志, 2016, 16(2): 131-135. |
| [6] |
王劲峰. 空间分析[M]. 北京: 科学出版社, 2006, 112-120.
|
| [7] |
汤国安, 杨昕. ArcGIS地理信息系统空间分析实验教程[M]. 北京: 科学出版社, 2012, 232-292.
|
| [8] |
邓特, 黄勇, 顾菁, 等. 空间分析中空间自相关性的诊断[J]. 中国卫生统计, 2013, 30(3): 343-346. |
| [9] |
张冰冰, 姜祥坤, 张世英, 等. 空间自相关分析在探究疾病分布热点区域中的应用[J]. 山东大学学报:医学版, 2012, 50(5): 129-132. |
| [10] |
郭鹏飞, 何红燕, 张韬, 等. 扫描统计量模型在地方病流行病学中的应用初探[J]. 现代预防医学, 2011, 38(2): 215-218. |
| [11] |
唐咸艳, 周红霞. 扫描统计及其在流行病学中的应用[J]. 中国卫生统计, 2011, 28(3): 332-337. |
| [12] |
Stelling J, Yih WK, Galas M, et al. Automated use of WHONET and SaTScan to detect outbreaks of Shigella spp. using antimicrobial resistance phenotypes[J]. Epidemiol Infect, 2010, 138(6): 873-883. DOI:10.1017/S0950268809990884 |
| [13] |
曾四清. 全球气候变化对传染病流行的影响[J]. 国外医学医学地理分册, 2002, 23(1): 36-38. |
| [14] |
Tran A, Raffy M. On the dynamics of dengue epidemics from large-scale information[J]. Theor Popul Biol, 2006, 69(1): 3-12. DOI:10.1016/j.tpb.2005.06.008 |
| [15] |
易彬樘, 张治英, 徐德忠, 等. 广东省登革热流行与气候因素变化的相关性[J]. 第四军医大学学报, 2003, 24(2): 143-146. |
| [16] |
Xiao FZ, Zhang Y, Deng YQ, et al. The effect of temperature on the extrinsic incubation period and infection rate of Dengue virus serotype 2 infection in Aedes albopictus[J]. Arch Virol, 2014, 159(11): 3053-3057. DOI:10.1007/s00705-014-2051-1 |
| [17] |
俞善贤, 李兆芹, 滕卫平, 等. 冬季气候变暖对海南省登革热流行潜势的影响[J]. 中华流行病学杂志, 2005, 26(1): 25-28. |
| [18] |
甘立勤, 王荀, 马智超, 等. 登革热发病与气象因素关系的研究[J]. 中国热带医学, 2015, 15(11): 1333-1337. |
 2017, Vol. 28
2017, Vol. 28


