扩展功能
文章信息
- 胡双双, 陆永昌, 吴炳耀, 杨庆贵, 蔡佳, 何江, 孙立新
- HU Shuang-shuang, LU Yong-chang, WU Bing-yao, YANG Qing-gui, CAI Jia, HE Jiang, SUN Li-xin
- 小家鼠线粒体DNA控制区多态性和系统进化研究
- Genetic polymorphisms and phylogenetic relationships of Mus musculus based on sequences of mitochondrial DNA D-loop
- 中国媒介生物学及控制杂志, 2017, 28(4): 332-335
- Chin J Vector Biol & Control, 2017, 28(4): 332-335
- 10.11853/j.issn.1003.8280.2017.04.006
-
文章历史
- 收稿日期: 2017-02-23
- 网络出版时间: 2017-06-12 16:24
2 江苏出入境检验检疫局, 南京 210001;
3 江苏国际旅行卫生保健中心, 南京 210019
2 Jiangsu Entry-Exit Inspection and Quarantine Bureau;
3 Jiangsu International Travel Healthcare Center
小家鼠(Mus musculus)食性杂、繁殖快、数量多、分布广,主要危害农作物,盗食粮食,是重要的农田害鼠。同时,小家鼠可携带多种病原体,并传播多种疾病,目前已达20多种[1],如鼠疫、蜱传斑疹伤寒和钩端螺旋体病等。线粒体基因是裸露DNA,分子结构简单,易受诱变且遵循严格的母系遗传,其进化速率约为单拷贝核DNA的5~10倍[2],从而成为研究群体水平和近缘种间关系的有力分子标记[3],被广泛应用于物种遗传和进化规律研究。哺乳动物线粒体全基因组大小一般为15 000~18 000 bp[4-5],包含13个编码蛋白基因、22个转运RNA基因、2个核糖体RNA基因(12S rRNA和16S rRNA)和2个非编码区序列即轻链复制起始区和控制区(D-loop)。各基因间只存在很小的重叠和间隔,不同物种间各基因以固定顺序排列[6]。线粒体基因组中不同基因的进化速率不同,其中2核糖体RNA基因比较保守,13个编码蛋白基因进化速率相对较快,D-loop基因进化速率最快,突变率最高,常被用于种群遗传结构分析及基因多样性研究,尤其适于较近亲缘关系种间、种内的系统分类研究。
Prager等[7]利用线粒体DNA的控制区和侧翼tRNA基因对小家鼠的演化历程进行研究,发现4个主要谱系,即domesticus、musculus、castaneus和在也门发现的1个新谱系Yemeni;分析认为,小家鼠起源于亚洲中西部,向外扩散时首先进入阿拉伯半岛南部,由此向北进入中南亚,再由中南亚到中北亚和东南亚,经中北亚进入欧洲北部各地。侯新远等[8]利用线粒体D-loop基因研究我国12种虾虎鱼类的系统进化关系,并将其亲缘关系重新划分。董志国等[9]以线粒体控制区D-loop基因作为分子标记,对中国海三疣梭子蟹野生群体的遗传多样性及其遗传结构进行分析发现,该种群的遗传距离与地理距离无显著的相关性,群体的发生及扩散可能存在更复杂原因。本研究主要以江苏口岸本底和境外输入的小家鼠为研究对象,对D-loop基因的多态性和遗传进化关系进行分析,为口岸鼠类的鉴定和溯源提供可靠的技术支持。
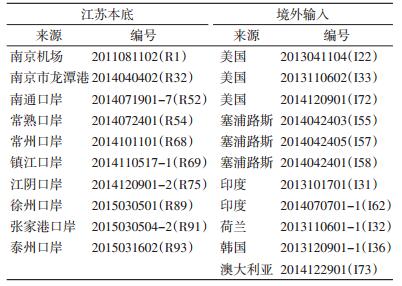
1 材料与方法 1.1 样本来源江苏口岸本底监测捕获的小家鼠10只和口岸截获的境外输入性小家鼠11只(表 1),分别取其肝组织置95%乙醇溶液中保存,备用。
采用DNeasy Blood and Tissue Kit(QIAGEN)试剂盒说明书提取小家鼠肝组织的总DNA,置-20 ℃备用。
1.2.2 PCR反应体系为10×PCR Buffer(无Mg2+)3.5 μl,上、下游引物各1.5 μl,dNTP Mixture(各2.5 mmol/L)3 μl,MgCl2溶液(25 mmol/L)3 μl,模板3 μl,Taq DNA聚合酶(5 U/μl)(TaKaRa)0.4 μl,灭菌去离子H2O补足至35 μl。扩增上游引物EGL4L:5′ -CCA CCA TCA ACA CCC AAA G-3′,下游引物R73R:5′ -CAT GCC TTG ACG GCT ATG TTG-3′。扩增条件:预扩增94 ℃ 5 min;扩增94 ℃ 1 min,60 ℃ 1 min,72 ℃ 1 min,35个循环;延伸72 ℃ 10 min。
1.2.3 PCR产物纯化经1.5%琼脂糖凝胶电泳检测后,选择目的条带清晰的扩增产物利用OMEGA Cycle-Pure Kit(200)试剂盒进行割胶纯化。
1.2.4 测序反应测序反应体系为Big Die 0.5 μl,5×Buffer 1.75 μl,单向引物0.5 μl,灭菌去离子水6.25 μl,再加DNA模板1 μl。反应条件:96 ℃预变性1 min;96 ℃变性10 s,50 ℃退火5 s,60 ℃延伸4 min,共25个循环;4 ℃终延伸7 min。根据OMEGA Mag-Bind SE DTR Kit试剂盒进行纯化。将纯化后的产物溶于Applied Biosystems Hi-Di Formamide试剂中,进行测序。
1.2.5 DNA序列分析利用Chromos软件观察测序峰图,评价测序质量。通过Lasergene 7.0软件的Seqman模块进行双向序列自动拼接与适当的手工调整。然后将测定的序列在NCBI上进行Blast比对,以确保所获得的序列是目标序列。将所有序列在Mega 6.0软件的ClustalW 1.83模块中对齐,基于赤池信息标准(akaike information criterion,AIC),通过Modeltest v2.1.7软件筛选最佳进化模型,在Mega 6.0软件中采用最大似然法(Maximum Likelihood)构建小家鼠D-loop基因系统进化树,各分支的置信度由1 000次自举法(Bootstrap)重复检测。利用DnaSP 5.0软件计算小家鼠D-loop的碱基替换数目、单倍型数目和核苷酸多态性。
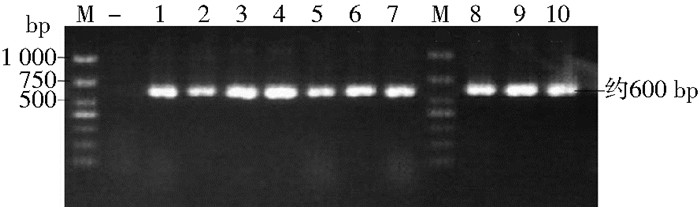
2 结果 2.1 小家鼠D-loop基因扩增以江苏口岸监测捕获的10只本底小家鼠和江苏口岸截获的11只境外输入小家鼠的DNA为模板,扩增D-loop基因,均扩增出相应条带,阴性对照未见扩增条带(图 1)。
|
| 注:M. DNA分子质量标准;-.阴性对照;1~10.小家鼠D-loop基因 图 1 江苏本底部分小家鼠D-loop基因扩增产物电泳结果 Figure 1 The electrophoretogram of D-loop genes for M. musculus from Jiangsu province |
| |
共测得21个小家鼠D-loop基因,测序峰图见图 2。
|
| 图 2 小家鼠基因扩增产物测序片段 Figure 2 The sequencing image segment of D-loop genes for M. musculus |
| |
通过Lasergene 7.0软件的Seqman模块进行双向序列自动拼接和适当手工调整。本研究的南京小家鼠(编号:2011081102)D-loop基因序列为CTG GTA TTC TAA TTA AAC TAC TTC TTG CGT ACA TAA ATT TAC ATA GTA CAA TAG TAC ATT TAT GTA TAT CGT ACA TTA AAC TAT TTT CCC CAA GCA TAT AAG CAA GTA CAT TTA ATC AAT GAT ATA GGC CAT AAA ACA ATT ATC AAC ATA AAC TGA CAC AAA CCA TGA ATA TTA TAC TAA TAC ATT AAA TTA ATG CTT TAA AGA CAT ATC TGT GTT ATC TGA CAT ACA CCA TAC AGT CAT AAA CTC TTC TCT TCC ATA TGA CTA TCC CCT TCC CCA TTT GGT CTA TTA ATC TAC CAT CCT CCG TGA AAC CAA CAA CCC GCC CAC CAA TGC CCC TCT TCT CGC TCC GGG CCC ATT AAA CTT GGG GGT AGC TAA ACT GAA ACT TTA TCA GAC ATC TGG TTC TTA CTT CAG GGC CAT CAA ATG CGT TAT CGC CCA TAC GTT CCC CTT AAA TAA GAC ATC TCG ATG GTA TCG GGT CTA ATC AGC CCA TGA CCA ACA TAA CTG TGG TGT CAT GCA TTT GGT ATT TTT TTA TTT T。
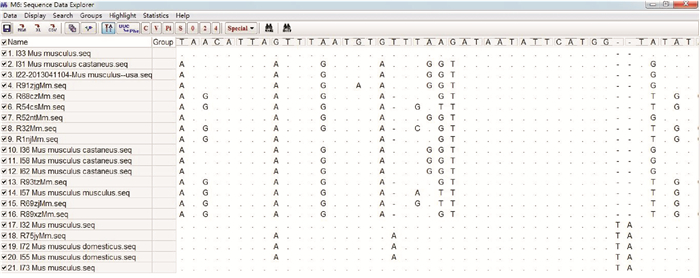
2.3 小家鼠D-loop基因比对结果利用Mega 6.0软件的ClustalW 1.83模块对21只小家鼠D-loop基因进行人工比对和手动调整,获得序列长度一致的21条D-loop序列,见图 3。
|
| 图 3 小家鼠D-loop基因比对片段 Figure 3 Sequences alignment segment of D-loop for M. musculus |
| |
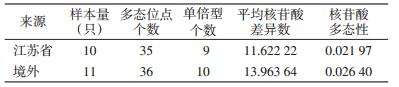
21只小家鼠D-loop基因中各测得位点533个,其中保守位点488个,可变异位点41个。其中单碱基位点5个,分别是第22、347、390、530和532位;兼并碱基位点有32个,分别是第11、271、325、328、332、334、340、344、349、353、355、374、376、378、379、380、396、398、403、404、405、409、410、412、421、430、453、474、482、492、506和529位;缺失位点有4个。21只小家鼠D-loop基因中,碱基(G+C)和(A+T)含量分别为0.366和0.634,有明显的A、T碱基偏好。
2.4.2 小家鼠D-loop基因的核苷酸多态性所测序列总突变数为46,核苷酸平均差异数为14.752 38,核苷酸多态性为0.027 89,核苷酸多态性的平均方差为0.000 005 6,核苷酸多态性的平均标准差为0.002 36。江苏本底与境外输入小家鼠D-loop基因的遗传多样性见表 2。
21只小家鼠D-loop基因共有17个单倍型,单倍型多态性为0.976 19,平均方差为0.000 53,标准差为0.023。10只江苏省本底小家鼠和11只境外输入小家鼠D-loop基因各有9个单倍型,单倍型的多态性分别为0.977 78和0.945 45。
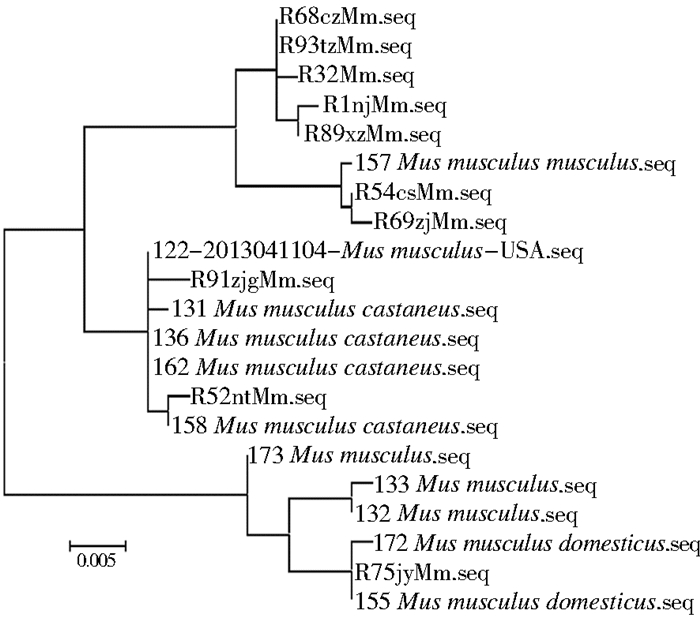
2.5 小家鼠D-loop基因的遗传进化关系由图 4可见,21只小家鼠D-loop基因在ML系统树上被分为3个分支。第1个分支由7只来自中国江苏省的小家鼠和1只来自塞浦路斯的小家鼠组成;第2个分支由来自印度、韩国、塞浦路斯和中国江苏省本底的6只亚洲小家鼠及1只来自美国的小家鼠组成;第3个分支由来自美国、荷兰、澳大利亚和塞浦路斯的5只小家鼠及1只来自中国江苏省江阴县的小家鼠组成。
|
| 图 4 小家鼠D-loop基因序列的ML系统发育树 Figure 4 The ML phylogenetic tree of D-loop gene sequences for M. musculus |
| |
D-loop作为线粒体基因的非编码区,普遍认为是线粒体基因组上进化最快的部分,其进化速率每百万年可达19% [10]。其高度的多态性在研究群体遗传时对难以获得的研究对象或近缘物种间和种内遗传非常有效。本研究的21只小家鼠D-loop基因共有17个单倍型,可见同一物种不同个体间的D-loop基因差异很大。(A+T)的含量为0.634,有明显的A、T碱基偏好,符合脊椎动物mtDNA D-loop区域碱基组成的特点[11]。本研究小家鼠D-loop基因的平均核苷酸差异数为14.752 38,而前期研究小家鼠线粒体基因的COⅠ基因平均核苷酸多态性为7.931[12],且前期实验样本较多,可见物种内D-loop基因具有丰富的种内多态性,有待进一步挖掘利用。
本研究发现,来自中国江苏省本底的小家鼠大致分布在同一分支;来自印度、韩国等亚洲的小家鼠也基本分布在同一分支;第3个分支主要以来自美国、荷兰等欧美国家的小家鼠为主。由此可见,小家鼠种群遗传分化与地理位置有关,该现象为地理障碍,即原本广泛分布的物种因地理障碍而将原有的连续分布区隔离开,并在隔离区内各自独立演化,进而形成一定的种内差异[13]。本研究中江苏省本地和境外输入性小家鼠,在一定程度上已显现出以地理位置为标志的种内差异,但并非完全按照地理位置划分,如3只来自亚非欧交界处塞浦路斯的小家鼠毫无规律地分布在3个分支中;1只来自美国的小家鼠分布在亚洲小家鼠所在分支;1只来自中国江苏省江阴县的小家鼠分布在欧美小家鼠所在分支。可能因小家鼠个体小、活动性强,在不同地区间迁移频繁,或本研究样本数量过少,境外输入样本来源也仅限于江苏口岸截获的小家鼠,且D-loop基因作为线粒体基因组上的单个基因,所提供的信息有限,后期应对线粒体全基因组进行研究,进一步分析江苏口岸小家鼠的基因多态性和遗传进化关系。
| [1] |
郑智民, 姜志宽, 陈安国. 啮齿动物学[M]. 上海: 上海交通大学出版社, 2008, 164-167.
|
| [2] |
Boore JL. Animal mitochondrial genomes[J]. Nucleic Acids Res, 1999, 27(8): 1767-1780. DOI:10.1093/nar/27.8.1767 |
| [3] |
Castresana J, Feldmaier-Fuchs G, Yokobori SI, et al. The mitochondrial genome of the hemichordate Balanoglossus carnosus and the evolution of deuterostome mitochondria[J]. Genetics, 1998, 150(3): 1115-1123. |
| [4] |
Ingman M, Kaessmann H, P——bo S, et al. Mitochondrial genome variation and the origin of modern humans[J]. Nature, 2000, 408(6813): 708-713. DOI:10.1038/35047064 |
| [5] |
Paton T, Haddrath O, Baker AJ. Complete mitochondrial DNA genome sequences show that modern birds are not descended from transitional shorebirds[J]. Proc Roy Soc B Biol Sci, 2002, 269(1493): 839-846. DOI:10.1098/rspb.2002.1961 |
| [6] |
Saccone C, Gissi C, Reyes A, et al. Mitochondrial DNA in metazoa:degree of freedom in a frozen event[J]. Gene, 2002, 286(1): 3-12. DOI:10.1016/S0378-1119(01)00807-1 |
| [7] |
Prager EM, Orrego C, Sage RD. Genetic variation and phylogeography of central Asian and other house mice, including a major new mitochondrial lineage in Yemen[J]. Genetics, 1998, 150(2): 835-861. |
| [8] |
侯新远, 祝斐, 张丽娟, 等. 基于线粒体D-loop基因序列研究我国5种虾虎鱼类的系统进化关系[J]. 海洋渔业, 2013, 35(1): 1-7. |
| [9] |
董志国, 李晓英, 王普力, 等. 基于线粒体D-loop基因的中国海三疣梭子蟹遗传多样性与遗传分化研究[J]. 水产学报, 2013, 37(9): 1304-1312. |
| [10] |
Brown WM. The mitochondrial genome of animals[M]//MacIntyre RJ. Molecular Evolutionary Genetics. New York:Plenum Press, 1985:95-130.
|
| [11] |
Meyer A. DNA technology and phylogeny of fish[M]//Beaumont AR. Genetics and Evolution of Aquatic Organisms. London:Chapman and Hall, 1994:219-249.
|
| [12] |
胡双双, 吴炳耀, 何江, 等. 江苏口岸小家鼠细胞色素氧化酶亚基COⅠ基因的多态性研究[J]. 中华卫生杀虫药械, 2017, 23(1): 65-69. |
| [13] |
刘铸, 徐艳春, 戎可, 等. 啮齿动物分子系统地理学研究进展[J]. 生态学报, 2014, 34(2): 307-315. |
 2017, Vol. 28
2017, Vol. 28