扩展功能
文章信息
- 于保庭, 胡寅, 连留青, 宋晓钢, 丁艳梅, 莫建初
- YU Bao-ting, HU Yin, LIAN Liu-qing, SONG Xiao-gang, DING Yan-mei, MO Jian-chu
- 营养对幼虫期淡色库蚊生理状态及摄糖行为的影响
- Effect of larval nutritional regimes on the physiological condition and sugar feeding behavior of Culex pipiens pallens
- 中国媒介生物学及控制杂志, 2017, 28(4): 314-317
- Chin J Vector Biol & Control, 2017, 28(4): 314-317
- 10.11853/j.issn.1003.8280.2017.04.003
-
文章历史
- 收稿日期: 2017-02-28
- 网络出版时间: 2017-06-12 16:23
2 全国白蚁防治中心, 浙江 杭州 310011
2 National Termite Control Center of China
成蚊羽化后的飞行、寻找栖息生境、搜寻配偶与宿主、觅水产卵等生命活动均伴随能量消耗。若无充足的能量储备及持续的能量供给,几乎无法完成交配、吸血、卵块发育及产卵等行为[1]。此外,成蚊的营养物质和能量储备显著影响其群舞、交配、觅食等[2-3]及寿命和繁殖力等[4-5]。研究表明,疟原虫在成蚊体内的发育及传播疾病能力与成蚊生理状态密切相关[6-7]。
蚊虫的能量储备主要来自于幼虫期所储存的脂类和蛋白质,而成虫期所摄食的糖餐和血餐是补充能量的重要来源[1]。单独摄食水的新羽化成蚊仅存活几天,而摄食糖餐或血餐可显著延长其寿命[8-9]。有研究表明,幼虫期食物丰富度可显著影响成蚊对糖餐/血餐间的选择[10],但不同幼虫期的食物丰富度如何影响成蚊对糖餐的趋性尚不清楚。本研究通过提供淡色库蚊(Culex pipiens pallens)幼虫期不同量的食物,研究淡色库蚊幼虫期食物丰富度对成蚊能量物质储备的影响及淡色库蚊幼虫的摄糖情况,为不同栖息生境孳生的成蚊防治提供参考。
1 材料与方法 1.1 试虫于2014年8月在杭州市某居民小区蓄水池内采集淡色库蚊幼虫,在室内条件下喂食小鼠饲料(浙江省实验动物中心),待成蚊羽化后喂食5%蔗糖溶液,并以小鼠血液作为血餐喂食。将装有纯净水的小烧杯置于养虫笼内供雌蚊产卵,收集产卵块于纯净水内孵化。
1.2 试剂蒽酮和香草醛购自西格玛奥德里奇(上海)贸易有限公司;考马斯亮蓝G-250和牛血清白蛋白(BSA)均购自生工生物工程(上海)股份有限公司;大豆油购自阿拉丁公司;浓硫酸、85%磷酸、无水乙醇和氯仿等试剂均购自国药集团化学试剂有限公司。
1.3 不同食物量饲养幼虫吸取新孵化的淡色库蚊幼虫,按100只/L饲养于蒸馏水烧杯内,饲喂小鼠饲料,按照不同食物量饲养,并记录蚊幼虫开始化蛹的时间。高食物量组,于孵化后第1~3天,饲喂饲料50 mg/d;第4~6天,100 mg/d;第7天至化蛹,150 mg/d。中食物量组,于孵化后第1~3天,饲喂饲料20 mg/d;第4~6天,40 mg/d;第7天至化蛹,60 mg/d。低食物量组,于孵化后第1~3天,饲喂饲料5 mg/d;第4~6天,10 mg/d;第7天至化蛹,10 mg/d。
1.4 成蚊体型测定分别吸取各组新羽化的雌雄蚊约200只,称量其体质量,并分别取其前翅,置于解剖镜下测定其翅长。
1.5 生理状态测定将不同食物量饲养的淡色库蚊新羽化成蚊分别吸取30只雌雄蚊,于-80 ℃冷冻保存,重复3批,用于研究雌雄蚊的生理状况。
1.5.1 糖含量测定将0.2 g蒽酮溶于100 ml浓硫酸配制蒽酮试剂,参照Shin等[11]方法,用硫酸钠溶液对单只成蚊进行匀浆,加入氯仿甲醇混合液充分混合,离心后吸取上清液,加入蒽酮试剂加热10 min,待室温冷却后于波长630 nm下测其吸光度。在相同条件下,以不同浓度的无水葡萄糖溶液制作标准曲线,计算成蚊体内的糖含量。
1.5.2 脂类含量测定将120.0 mg香草醛溶于100 ml 68%磷酸溶液配制磷酸香草醛试剂,参照Shin等[11]方法加入氯仿甲醇混合液对单只成蚊进行匀浆,吸取上清液并加热使溶剂挥发,加入浓硫酸后密闭加热,待加入磷酸香草醛试剂后于波长525 nm下测其吸光度。在相同条件下,以溶于氯仿的不同浓度的大豆油制作标准曲线,计算成蚊体内的脂类含量。
1.5.3 蛋白质含量测定将考马斯亮蓝溶于95%乙醇后,加入磷酸配成考马斯亮蓝G-250试剂,参照Shin等[11]方法用氢氧化钠溶液对成蚊进行匀浆,经离心后吸取上清液加入考马斯亮蓝溶液,混合均匀后于波长595 nm下测其吸光度。在相同条件下,以不同浓度的BSA溶液制作标准曲线,计算成蚊体内的蛋白质含量。
1.6 成蚊摄糖比例取相同食物量喂养的同一时间羽化的雌雄蚊各50只,置于养虫笼内,以蒸馏水润湿的脱脂棉作为成蚊的水源,以添加1%食用色素的10%葡萄糖溶液作为成蚊的糖餐。在暗周期开始时将糖溶液置于笼内,于光周期开始时(12 h后)取出,并吸取笼内的成蚊于-80 ℃冷冻。利用体式显微镜观察成蚊腹部颜色,判断成蚊是否摄糖。
1.7 统计学处理利用SPSS 16.0软件进行统计学分析,采用单因素方差分析(ANOVA)LSD test对不同组雌雄成蚊的翅长、体质量及各营养物质含量进行分析,数据以平均数±标准误(x±sx)表示。P<0.05为差异有统计学意义。为评估不同处理组的成蚊能量储备情况,将成蚊体内的糖原、脂类及蛋白质含量分别按0.017、0.038和0.017 J/μg转化为相应的能量储备值[11-12]。
2 结果 2.1 幼虫发育历期食物丰富度对淡色库蚊幼虫的发育有一定影响。高食物量组淡色库蚊幼虫自孵化后平均7.5 d后开始化蛹,而中食物量和低食物量组分别需要8.75和10.75 d。
2.2 成蚊体型幼虫期高食物量的雌蚊翅长大于中、低食物量,差异有统计学意义(F=459.71,df=2,P<0.001)。不同幼虫期食物量的雄蚊翅长间差异亦有统计学意义(F=451.27,df=2,P<0.001)。此外,幼虫期食物量的丰富度也显著影响成蚊的体质量,幼虫期食物越充足,成蚊体质量越高(雄蚊:F=232.39,df=2,P<0.001;雌蚊:F=341.20,df=2,P<0.001)。此外,雄蚊翅长与体质量均低于同组的雌蚊(图 1)。

|
| 注:数据为(x±sx);A、B、C为不同食物量组的雌蚊翅长(E)与体质量(F)差异性比较,P<0.05;a、b、c为不同食物量组的雄蚊翅长(E)与体质量(F)差异性比较,P<0.05;不同组雄蚊和雌蚊的翅长与体质量经LSD检验后差异有统计学意义(P<0.05) 图 1 不同营养条件雌雄淡色库蚊成蚊的翅长(E)与体质量(F) Figure 1 The wing length(E)and body weight(F)of Cx. pipiens pallens adults from different larval nutritional regimes |
| |
不同食物组羽化的雄蚊体内脂类和蛋白质含量差异有统计学意义(F=91.04,df=2,P<0.05;F=55.64,df=2,P<0.05),高食物量组与中食物量组羽化的雄蚊体内糖类含量间差异无统计学意义,但均与低食物量组差异有统计学意义(F=39.69,df=2,P<0.05)。不同幼虫期食物量对雌蚊的糖类含量及脂类含量差异有统计学意义(F=13.59,df=2,P<0.05;F=32.14,df=2,P<0.05),高食物量组的雌蚊与中食物量组的雌蚊蛋白质含量间差异无统计学意义,但与低食物量组的雌蚊蛋白质含量间差异有统计学意义(F=65.77,df=2,P<0.05)。幼虫期的食物丰富度影响成蚊的能量储备,幼虫期食物越丰富,成蚊储备的能量也越充足(表 1)。
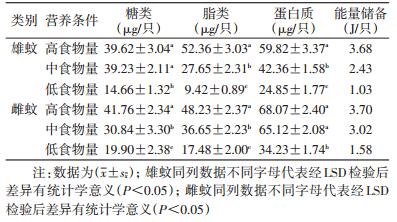
|
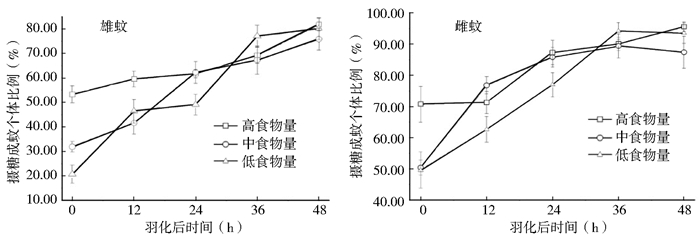
对羽化后不同处理组的雌雄蚊摄糖个体比例进行分析发现,幼虫期食物丰富度不同,成蚊摄糖个体比例不同。随着羽化后时间的延长,不同处理组的雌雄蚊摄食糖餐的个体比例不断升高。刚羽化后即喂食糖溶液的雄蚊个体幼虫期营养越丰富,摄糖比例越高,差异有统计学意义(F=66.62,df=2,P<0.05);羽化12 h后各食物组雄蚊摄糖个体比例为高食物量组>低食物量组>中食物量组;羽化24 h后高食物量组和中食物量组雄蚊摄糖个体比例相当,均高于低食物量组;羽化36 h后低食物量组雄蚊摄糖个体比例最高,约为75%;在羽化48 h后不同食物组的雄蚊摄糖个体比例约为80%,其中高食物量组和低食物量组雄蚊摄糖比例相当,均高于中食物量组(图 2)。新羽化的雌蚊以高食物量组摄糖比例最高,达(70.80±5.76)%,而中食物量组和低食物量组雌蚊摄糖比例约为50%;羽化12 h后各食物组雄蚊摄糖个体比例依次为中食物量组>高食物量组>低食物量组;羽化24 h后的高食物量组雌蚊与中食物量组雌蚊摄糖个体比例持平,约为86%,而低食物量组雌蚊摄糖个体比例为(76.98±3.91)%;羽化36 h后的低食物量组雌蚊摄糖个体比例高于高、低食物量组,达(94.23±2.70)%;羽化48 h后不同组雌蚊摄糖个体所占比例约为90%,其中高食物量组和低食物量组雌蚊摄糖个体比例均高于中食物量组,达93.52%~95.61%(图 2)。
|
| 图 2 不同营养条件新羽化雄蚊和雌蚊在羽化后不同时间摄糖个体比例 Figure 2 Temporal change of proportions of sugar⁃fed male and female Cx. pipiens pallens from different larval nutritional regimes |
| |
蚊虫的能量储备主要为幼虫阶段摄食的有机物类合成自身糖类、脂类及蛋白质等,并通过成蚊阶段摄食糖餐或血餐进行补充[9]。淡色库蚊幼虫期食物丰富度不同,羽化的成蚊体型明显不同,且成蚊体内糖类、脂类和蛋白质含量也有差异。此外,淡色库蚊幼虫期食物丰富度亦影响成蚊的摄糖趋性。
3.1 幼虫期食物丰富度对成蚊体型的影响成蚊体型通常与其幼虫期食物丰富度相关[7]。本研究发现,不同食物量组淡色库蚊成蚊翅长和体质量差异均有统计学意义,幼虫期食物越充足,其成虫翅长越长,体质量越大;相同食物组雌蚊的翅长和体质量均高于雄蚊,与Takken等[7]和Shin等[11]研究结果一致。有研究表明,成蚊翅长与体质量对成蚊存活和交配有重要影响[13],体型较大的雄蚊在群舞过程中可优先完成交配[12],而雄蚊在选择配偶时也偏好体型较大的雌蚊,使其后代更具有体型优势[14]。自然条件下,体型大的雌蚊寿命长于体型小的雌蚊,成蚊体型对其传播疾病能力有显著影响[6]。
3.2 幼虫期食物丰富度对成蚊生理状态的影响本研究发现,淡色库蚊生理状况和能量储备与幼虫期食物丰富度密切相关。以不同食物量饲养冈比亚按蚊(Anopheles gambiae)、斯氏按蚊(An. stephensi)和骚扰库蚊(Cx. molestus)幼虫后,对其成蚊营养物质含量分析也得到相似结果[5, 7]。正常食物量与高食物量饲养的雄蚊糖含量间差异无统计学意义。糖类是蚊类飞行的主要能量来源,很大程度上优先用于最基本的生命活动[15]。幼虫期食物丰富度对于雌蚊的能量储备影响较大。自育雌蚊成虫阶段卵巢发育所需营养主要来自幼虫阶段储备的糖类和脂类,而非自育雌蚊糖类和脂类储备对成蚊的繁殖力同样有显著影响[16]。因此,雌蚊体内的各营养物质如何影响其繁殖力有待深入研究。
3.3 幼虫期食物丰富度对成蚊趋糖性的影响大多数蚊虫在羽化后24 h内即需取食糖餐[1]。目前研究表明,成蚊摄食糖餐的频率与成蚊的日龄、糖源的丰富度和引诱力及蚊虫自身能量需求等因素相关[2, 10]。在相同时间内,相同幼虫期食物营养条件下的雌蚊摄糖个体比例始终高于同组雄蚊,证实了糖餐对于淡色库蚊维持正常生命活动的重要性,且幼虫期的食物丰富度影响成蚊对糖餐的趋性,对利用其摄糖习性防治蚊虫提供了重要理论依据。
| [1] |
Foster WA. Mosquito sugar feeding and reproductive energetics[J]. Annu Rev Entomol, 1995, 40: 443-474. DOI:10.1146/annurev.en.40.010195.002303 |
| [2] |
Hancock RG, Foster WA. Larval and adult nutrition effects on blood/nectar choice of Culex nigripalpus mosquitoes[J]. Med Vet Entomol, 1997, 11(2): 112-122. DOI:10.1111/j.1365-2915.1997.tb00299.x |
| [3] |
Ma-ga H, Dabiré RK, Lehmann T, et al. Variation in energy reserves and role of body size in the mating system of Anopheles gambiae[J]. J Vector Ecol, 2012, 37(2): 289-297. DOI:10.1111/j.1948-7134.2012.00230.x |
| [4] |
Telang A, Li Y, Noriega FG, et al. Effects of larval nutrition on the endocrinology of mosquito egg development[J]. J Exp Biol, 2006, 209(4): 645-655. DOI:10.1242/jeb.02026 |
| [5] |
Kassim NFA, Webb CE, Russell RC. The importance of males:larval diet and adult sugar feeding influences reproduction in Culex molestus[J]. J Am Mosq Control Assoc, 2012, 28(4): 312-316. DOI:10.2987/12-6274R.1 |
| [6] |
Vaidyanathan R, Fleisher AE, Minnick SL, et al. Nutritional stress affects mosquito survival and vector competence for West Nile virus[J]. Vector Borne Zoonotic Dis, 2008, 8(6): 727-732. DOI:10.1089/vbz.2007.0189 |
| [7] |
Takken W, Smallegange RC, Vigneau AJ, et al. Larval nutrition differentially affects adult fitness and Plasmodium development in the malaria vectors Anopheles gambiae and Anopheles stephensi[J]. Parasit Vectors, 2013, 6(1): 345. DOI:10.1186/1756-3305-6-345 |
| [8] |
Impoinvil DE, Kongere JO, Foster WA, et al. Feeding and survival of the malaria vector Anopheles gambiae on plants growing in Kenya[J]. Med Vet Entomol, 2004, 18(2): 108-115. DOI:10.1111/mve.2004.18.issue-2 |
| [9] |
Manda H, Gouagna LC, Foster WA, et al. Effect of discriminative plant-sugar feeding on the survival and fecundity of Anopheles gambiae[J]. Malaria J, 2007, 6(1): 113. DOI:10.1186/1475-2875-6-113 |
| [10] |
Foster WA, Takken W. Nectar-related vs. human-related volatiles:behavioural response and choice by female and male Anopheles gambiae (Diptera:Culicidae) between emergence and first feeding[J]. Bull Entomol Res, 2004, 94(2): 145-157. DOI:10.1079/BER2003288 |
| [11] |
Shin SM, Akram W, Lee JJ. Effect of body size on energy reserves in Culex pipiens pallens females (Diptera:Culicidae)[J]. Entomol Res, 2012, 42(3): 163-167. DOI:10.1111/j.1748-5967.2012.00448.x |
| [12] |
Ma-ga H, Niang A, Sawadogo SP, et al. Role of nutritional reserves and body size in Anopheles gambiae males mating success[J]. Acta Trop, 2014, 132(Suppl): S102-107. |
| [13] |
Yahouédo GA, Djogbénou L, Sa-zonou J, et al. Effect of three larval diets on larval development and male sexual performance of Anopheles gambiae s. s[J]. Acta Trop, 2014, 132(Suppl): S96-101. |
| [14] |
Okanda FM, Dao A, Njiru BN, et al. Behavioural determinants of gene flow in malaria vector populations:Anopheles gambiae males select large females as mates[J]. Malaria J, 2002, 1(1): 10. DOI:10.1186/1475-2875-1-10 |
| [15] |
Briegel H, Knusel I, Timmermann SE. Aedes aegypti:size, reserves, survival, and flight potential[J]. J Vector Ecol, 2001, 26(1): 21-31. |
| [16] |
Telang A, Wells MA. The effect of larval and adult nutrition on successful autogenous egg production by a mosquito[J]. J Insect Physiol, 2004, 50(7): 677-685. DOI:10.1016/j.jinsphys.2004.05.001 |
 2017, Vol. 28
2017, Vol. 28


