扩展功能
文章信息
- 高娃, 殷旭红, 郭生春, 乌兰图雅, 曹民治
- Gao wa, YIN Xu-hong, GUO Sheng-chun, Wulan tuya, CAO Min-zhi
- 嗜吞噬细胞无形体在不同组织细胞间抗原差异研究
- Analysis of antigenic diversity of Anaplasma phagocytophilum grown in different cells
- 中国媒介生物学及控制杂志, 2017, 28(3): 255-257
- Chin J Vector Biol & Control, 2017, 28(3): 255-257
- 10.11853/j.issn.1003.8280.2017.03.015
-
文章历史
- 收稿日期: 2016-12-29
- 网络出版时间: 2017-04-11 17:06
2 巴彦淖尔市疾病预防控制中心, 内蒙古 巴彦淖尔 015000
2 Byannur Center for Disease Control and Prevention
嗜吞噬细胞无形体(Anaplasma phagocytophilum)属立克次体目无形体科的专性细胞内寄生菌,可引起人粒细胞无形体病(HGA)。该病最初发现于1994年美国的一名不明原因发热症患者[1]。我国于2008年在安徽省首次证实HGA的存在[2]。嗜吞噬细胞无形体在机体中指向性地感染中性粒细胞,且具有在细胞质中形成类似于桑葚(morula)的寄生性空胞(包涵体)进行复制增殖等特点[3]。嗜吞噬细胞无形体表面有一种关联抗原变异的P44主要外膜蛋白群,是该菌的主要抗原蛋白。无形体基因组中存在113个P44主要外膜蛋白的相同性基因(p44多基因家族)的重复序列[4]。这些相同性基因在基因组的某个主要表达领域易发生交换,从而使机体出现不同的P44外膜蛋白产生抗原变异[5]。
2013年日本首次确诊2例HGA患者[6]。实验发现,作为抗原的受感THP-1组织培养细胞的反应性优于受感HL60细胞,即受感THP-1和HL60细胞间存在抗原差异[6]。为解决HGA血清诊断中抗体检测困难,对嗜吞噬细胞无形体在不同组织细胞中的抗原蛋白的表达差异进行分析。同时,利用真核无细胞蛋白表达系统表达出接近该菌天然结构的重组蛋白,将获得的重组抗原用于快速检测嗜吞噬细胞无形体感染血清中的特异抗体,为HGA的快速简便诊断提供科学依据。
1 材料与方法 1.1 实验材料细菌株嗜吞噬细胞无形体(美国分离株),为日本静冈县立大学药食生命科学综合学院微生物学实验室培养并保存;27份疑似立克次体病(斑点热和恙虫病诊断阴性)血清来自日本静冈县CDC。
1.2 实验方法 1.2.1 IFA利用IFA检测嗜吞噬细胞无形体IgM和IgG抗体,IFA抗原分别使用受感HL60和THP-1培养细胞抗原。二抗采用Goat F(ab′)2 Anti-Human IgM FITC和Goat F(ab′)2 Anti-Human IgG FITC(AH1308,Invitrogen)。
1.2.2 RNA提取及p44基因扩增使用RNA提取试剂盒(QIAGEN),以提取自受感HL60和THP-1培养细胞的RNA为模板。通过RT-PCR扩增 p44目的基因片段,对嗜吞噬细胞无形体表达的p44主要外膜蛋白基因家族进行分析。第1轮p44基因扩增引物为P3726F(5′-GCT AAG GAG TTA GCT TAT GA-3′)和P4183R〔5′-CAA TAG T(C/T)T TAG CTA GTA ACC-3′〕;第2轮为P3761F〔5′-CTG CTC T(T/G)G CCA A(A/G)A CCT C-3′〕和P4257R(5′-AGA AGA TCA TAA CAA GCA TTG-3′)。反转录条件为37 ℃ 15 min,85 ℃变性5 s;两轮PCR扩增条件相同,即94 ℃变性30 s,55 ℃退火1 min,72 ℃延伸1 min,45个循环。
1.2.3 扩增产物的克隆、测序与分析将琼脂糖凝胶电泳阳性条带进行纯化回收,按照DNA回收纯化试剂盒(TaKaRa)说明书操作。将回收产物连接到pCR2.1(Invitrogen)载体上,在含有IPTG和X-gal的平板上培养重组质粒转化感受态细胞DH5α(TOYOBO),以蓝白斑法进行筛选分离,挑取白色菌落进行传代培养。采用限制性酶EcoRⅠ进行插入片段确认,再测序。利用Blast search和DNAStar软件进行序列分析。
1.2.4 真核无细胞蛋白合成利用In-Fusion试剂盒(TaKaRa)将目的基因连接到质粒pTD1,然后转化到感受态细胞DH5α中,大量培养扩增后提取质粒进行PCR及酶切鉴定,将阳性重组质粒送Greiner Japan测序。确认后用T7 RiboMAXTM Express Large Scale RNA Production System(Promega)大量制备mRNA,再使用Transdirect insect cell蛋白质合成试剂盒(SHIMADZU)合成目标蛋白,最后采用亲和色谱法进行纯化。
1.2.5 蛋白质印迹法(Western-blot,Wb)利用Wb对重组蛋白进行可行性评价。二抗采用Goat Anti-Human IgM Alkaline phosphatase和Goat Anti-Human IgG Alkaline phosphatase(Invitrogen)。
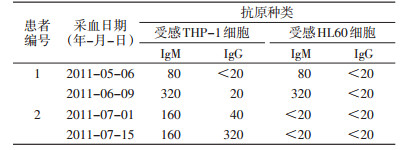
2 结果 2.1 不明发热症患者抗嗜吞噬细胞无形体抗体检测使用受感THP-1培养细胞作为抗原,采用IFA法对27例患者进行抗嗜吞噬细胞无形体抗体检测,发现2例阳性,见表 1。在确诊日本首例HGA患者时发现,作为IFA抗原的嗜吞噬细胞无形体受感THP-1和HL60细胞间的反应性完全不同。受感THP-1中,急性期和恢复期的血清IgM和IgG均显示较高的抗体效价,且恢复期血清的抗体效价有明显上升趋势。1号患者与受感THP-1和HL60细胞的反应性无明显差别;而2号患者与受感THP-1细胞的反应性较好,与受感HL60细胞未见反应性,受感THP-1细胞的反应性明显优于HL60细胞,差异明显。Wb结果与IFA结果完全吻合。
|
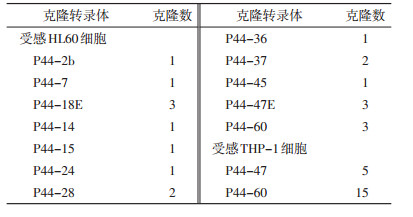
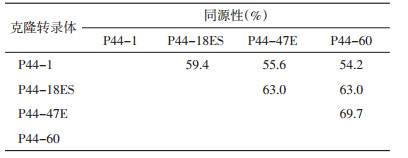
对受感HL60和THP-1培养细胞提取RNA进行RT-PCR扩增,通过TA克隆法分别获得20个p44克隆体序列。受感HL60细胞可表达多种p44 mRNA,而受感THP-1仅表达2种p44 mRNA(P44-47E和P44-60),见表 2。证明在不同组织培养细胞中,嗜吞噬细胞无形体菌体表面产生不同的P44外膜蛋白。将表达率较高的P44-47E、P44-60和P44-18E与使用中的重组P44-1蛋白的氨基酸序列进行比对发现,同源性相对较低,仅为54.2%~69.7%(表 3),推测以上抗原蛋白在血清学上存在交叉反应的可能性较低。
|
|
使用2例HGA阳性患者血清对3组重组蛋白(rP44-18ES、rP44-47E和rP44-60)进行评价发现,在IFA中与受感THP-1反应良好的血清,与rP44-47E和rP44-60(THP-1表达)也显现良好的反应性。同样,与受感HL60反应良好的血清,与rP44-18ES也显现较好的反应性(图 1)。因此,在无形体病的血清诊断中,3种rP44蛋白均可作为抗原进行有效地使用及推广。

|
| 注:r18ES. rP44-18ES(HL60);r47E. rP44-47E(THP-1);r60. rP44-60(THP-1)。 图 1 3种rP44重组蛋白与2例HGA患者血清的Wb结果 Figure 1 Reactivity of three different rP44 recombinant protein species with sera from two case-patients in Western-blot analysis |
| |
目前,HGA是国际关注度较高的一种新发人兽共患传染病。我国自2008年在安徽省发现首例HGA病例后,该病的病例数明显增加[7-9]。HGA无任何特异性临床症状,以实验室诊断为主,易产生抗原变异而加大诊断难度[10]。由于嗜吞噬细胞无形体的基因组中存在p44多基因家族的重复序列,相同性基因间容易产生交换,因此,机体内表达不同的P44外膜蛋白种类,从而引起抗原变异[4]。但在细胞培养中不存在机体免疫偏差,理论上不产生抗原变异。2007年对日本高知县2例PCR(p44/msp2)阳性患者使用受感HL60培养细胞作为抗原进行IFA检测,结果为阴性[6],该方法为美国普遍采用的HGA血清诊断法。最初认为该患者在感染后体内未产生抗体,但根据患者当时的发热状态及其临床表现,使用受感THP-1培养细胞再次进行IFA检测发现,根据在不同宿主细胞中的适应能力,嗜吞噬细胞无形体可选择适宜表达的P44外膜蛋白种类,并增殖为优势种。在不同组织细胞中嗜吞噬细胞无形体表达的P44外膜蛋白也不同,即菌体表面抗原蛋白存在差异,导致受感HL60和THP-1细胞中产生不同的抗原抗体反应性。
多次实验证明,在HGA的血清诊断中使用THP-1和HL60受感细胞作为抗原更易检测出抗体。另外,嗜吞噬细胞无形体感染的阳性血清、阴性血清及阳性对照兔血清,对重组抗原蛋白(rP44-18ES、rP44-47E和rP44-60)进行检测发现,与常规IFA结果相符,表明这些重组蛋白有较好的特异度和灵敏度,也说明3种重组蛋白易与患者血清中的抗体结合,可作为HGA的诊断用抗原。
| [1] | Chen SM, Dumler JS, Bakken JS, et al. Identification of a granulocytotropic Ehrlichia species as the etiologic agent of human disease[J]. J Clin Microbiol, 1994, 32(3) : 589–595 . |
| [2] | Zhang LJ, Liu Y, Ni DX, et al. Nosocomial transmission of human granulocytic anaplasmosis in China[J]. JAMA, 2008, 300(19) : 2263–2270 .DOI:10.1001/jama.2008.626. |
| [3] | Lin MQ, Kikuchi T, Brewer HM, et al. Global proteomic analysis of two tick-borne emerging zoonotic agents:Anaplasma phagocytophilum and Ehrlichia chaffeensis[J]. Front Microbiol, 2011: 24. |
| [4] | Dunning Hotopp JC, Lin MQ, Madupu R, et al. Comparative genomics of emerging human ehrlichiosis agents[J]. PLoS Genet, 2006, 2(2) : e21.DOI:10.1371/journal.pgen.0020021. |
| [5] | Lin Q, Rikihisa Y, Ohashi N, et al. Mechanisms of variable p44 expression by Anaplasma phagocytophilum[J]. Infect Immun, 2003, 71(10) : 5650–5661 .DOI:10.1128/IAI.71.10.5650-5661.2003. |
| [6] | Ohashi N, Gaowa, Wuritu, et al. Human granulocytic anaplasmosis, Japan[J]. Emerg Infect Dis, 2013, 19(2) : 289–292 .DOI:10.3201/eid1902.120855. |
| [7] | Jiao XY, Fan ZC, Li YZ, et al. Clinical and laboratory features parameters of human granulocytic anaplasmosis(HGA) in patients admitted to hospital in Guangdong province, China[J]. Trop Doct, 2015, 45(4) : 209–213 .DOI:10.1177/0049475515579772. |
| [8] | Wang Y, Chen CF, Zhang LJ. Molecular characterization of Msp2/P44 of Anaplasma phagocytophilum isolated from infected patients and Haemaphysalis longicornis in Laizhou Bay, Shandong province, China[J]. PLoS One, 2013, 8(10) : e78189.DOI:10.1371/journal.pone.0078189. |
| [9] | Hao Q, Geng Z, Hou XX, et al. Seroepidemiological investigation of lyme disease and human granulocytic anaplasmosis among people living in forest areas of eight provinces in China[J]. Biomed Environ Sci, 2013, 26(3) : 185–189 . |
| [10] | Rikihisa Y. Mechanisms of obligatory intracellular infection with Anaplasma phagocytophilum[J]. Clin Microbiol Rev, 2011, 24(3) : 469–489 .DOI:10.1128/CMR.00064-10. |
 2017, Vol. 28
2017, Vol. 28

