扩展功能
文章信息
- 段然, 梁俊容, 张婧, 陈妤煌, 郝慧静, 景怀琦, 王鑫
- DUAN Ran, LIANG Jun-rong, ZHANG Jing, CHEN Yu-huang, HAO Hui-jing, JING Huai-qi, WANG Xin
- 我国西南3省交界处静息鼠疫疫源地致病性耶尔森菌研究
- Research on pathogenic Yersinia within natural plague focus during rest periods on the border of three provinces in southwest of China
- 中国媒介生物学及控制杂志, 2017, 28(3): 241-243, 261
- Chin J Vector Biol & Control, 2017, 28(3): 241-243, 261
- 10.11853/j.issn.1003.8280.2017.03.011
-
文章历史
- 收稿日期: 2017-03-10
- 网络出版时间: 2017-04-11 16:05
鼠疫是由鼠疫耶尔森菌(鼠疫菌)引起的一种传播能力极强的烈性传染性疾病,其自然疫源性病原体在自然界如何保存、循环及复燃过程仍待研究[1]。位于我国西南部云贵高原和广西壮族自治区(广西)丘陵交界的南盘江流域,因兴建大型水库曾引发动物间和人间鼠疫的大规模暴发流行,后经常规监测发现,该疫源地于2003年进入静息期,除监测到个别F1抗体或抗原阳性动物外,未再出现动物间与人间鼠疫的暴发流行[2]。有学者认为3种致病性耶尔森菌(Yersinia),即鼠疫菌(Y. pestis)、假结核耶尔森菌(Y. pseudotuberculosis)、小肠结肠炎耶尔森菌(Y. enterocolitica)共同携带的毒力质粒(pYV,plasmid of Y. virulence)所编码的共同V抗原可引起交叉免疫。因此,在鼠疫自然疫源地的啮齿动物中通常无法分离到其他致病性耶尔森菌。本研究于2013- 2015年通过比较疫源地的啮齿动物、犬、家猪与非疫源地猪和犬中假结核耶尔森菌、小肠结肠炎耶尔森菌的分离情况,进一步佐证交叉免疫学说的正确性。
1 材料与方法 1.1 疫源地致病性耶尔森菌检测2013-2015年在贵州省兴义市、广西西林和隆林县、云南省罗平县开展啮齿动物及鼠疫指示动物犬的鼠疫菌病原学和血清学检测,逐一采集每只啮齿动物的血液、肝、脾、肠内容物及舌根部标本,仅采集指示动物的肛拭子和血液标本及家猪的咽拭子和肛拭子标本。
将啮齿动物的血液、肝、脾分别划线接种于培养基,用于分离鼠疫菌;对啮齿动物和指示动物的血液标本进行鼠疫菌特异性F1抗体检测[2]。对啮齿动物的肠内容物及舌根部标本、指示动物犬的肛拭子标本、家猪的咽拭子和肛拭子标本进行小肠结肠炎耶尔森菌及假结核耶尔森菌的增菌和分离[3]。
1.2 非疫源地致病性耶尔森菌检测在贵州省贵定县和广西灵川县采集家猪与犬相应的咽拭子和肛拭子标本,进行小肠结肠炎耶尔森菌和假结核耶尔森菌的增菌及分离。在广西南宁市≤5岁腹泻儿童中开展这两种致病性耶尔森菌的病原学检测,病例纳入标准参照文献[4]、菌株的分离鉴定及分子分型等方法参照文献[5]。
2 结果 2.1 疫源地内致病性耶尔森菌的检测结果 2.1.1 病原学检测2 261只啮齿动物的血液、肝、脾标本均未分离到鼠疫菌。4 522份啮齿动物标本、258份犬标本和1 002份家猪标本中共分离到小肠结肠炎耶尔森菌76株,啮齿动物、犬、家猪标本的阳性率分别为0.80%、1.55%和3.59%,各年度的分离情况见表 1。其中致病性小肠结肠炎耶尔森菌在啮齿动物、犬和家猪的总分离率分别为0、0.39%和3.19%。未分离到假结核耶尔森菌。

|
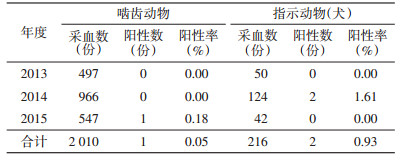
2013-2015年共采集啮齿动物血清2 010份,2015年由云南省罗平县黄胸鼠(Rattus tanezumi)中检测到阳性血清1份,总阳性率为0.05%;检测犬血清共216份,2014年由贵州省兴义县检测到阳性血清2份,总阳性率为0.93%,各年度阳性率见表 2。
|
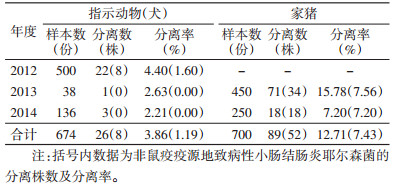
广西和贵州省非鼠疫自然疫源地共采集犬标本674份和家猪标本700份,共分离小肠结肠炎耶尔森菌115株,犬和家猪标本的分离率分别为3.86%和12.71%,其中致病性小肠结肠炎耶尔森菌的分离率分别为1.19%和7.43%。各年度犬、猪标本的分离率及菌株数见表 3。共分离到假结核耶尔森菌22株,犬和猪的分离率分别为2.37%(16/674)和0.86%(6/700)。
|
在1 880例≤5岁腹泻儿童患者中,分离到致病性小肠结肠炎耶尔森菌12份,感染率为0.64%,未分离到假结核耶尔森菌。对腹泻儿童、家猪、犬分离的致病性菌株进行PFGE带型聚类分析,腹泻儿童感染菌株分为6种PFGE型别,其中家猪、犬和腹泻儿童均感染型别为K6GN11C30012和K6GN11C30042的菌株,占腹泻儿童感染菌株总数的50.00%,其他腹泻儿童感染菌株带型未发现一致的动物带型。
3 讨论本研究监测地点为天生桥水库沿线,历史上从未有过确证的鼠疫流行报道,自2000年鼠疫疫情暴发后首次被归划为黄胸鼠鼠疫疫源地,而该疫源地在恢复静息后仅监测到个别动物F1抗体或抗原阳性,再未出现动物或人间鼠疫。本研究对该地暴发的鼠疫是否为外部输入,静息期鼠疫菌是否保存于疫源地进行了分析。疫情暴发前,1987年开始建设天生桥水库,修建10年间大批建筑工人进驻使得当地人口密度猛增,若鼠疫菌为外源性输入,在建造过程中可能暴发疫情,但10年间并未发现大量死鼠或动物间鼠疫发生。而在1997-2000年蓄水期,于1997年开始在库区发现死鼠,1998年库区沿岸村寨相继出现少量死鼠,1999年随蓄水量及淹没地区的增加,出现死鼠的村寨向上游不断蔓延,并呈现由库区沿岸向支流沿岸村寨扩散趋势。2000年居民家中发现大量啮齿动物死亡,当年7月暴发了人间鼠疫[2]。
人间鼠疫流行后,各疫点随即处于长期静息状态,常规监测很难发现动物间疫情,仅于2006年在贵州省兴义县检出1只IHA阳性黄胸鼠,2010年在广西西林县检出1只RIHA阳性自毙黄胸鼠[2]。常规监测每次捕获的活体啮齿动物数量相对较少,被发现的自毙鼠也较有限,很难发现静息期流行极低水平的动物间鼠疫疫情。故本研究在常规监测的基础上加强监测,于2014年在贵州省兴义县监测到2只F1抗体阳性犬,于2015年在云南省罗平县发现1只F1抗体阳性黄胸鼠。可见,该疫源地虽处于鼠疫流行间歇期,但仍保持鼠疫菌的循环。根据天生桥水电站疫情总结,生态环境改变(修建水电站)导致固有微循环于鼠疫疫源地的鼠疫菌聚集引起人间鼠疫,待疫源地恢复静息后,鼠疫菌重新进行微循环并保存于该疫源地。20世纪初美国暴发的人间鼠疫由其他大陆输入,而除太平洋口岸城市,其他地区的鼠疫菌均未固定,即鼠疫菌能否定植于某地,取决于当地是否具备疫源性,如生态植被、宿主动物和传播媒介等[6]。
前期研究发现,致病性耶尔森菌在鼠疫自然疫源地的分布呈“同心圆”现象,即同一疫源地内的动物感染鼠疫菌与感染小肠结肠炎耶尔森菌、假结核耶尔森菌呈此消彼长特征[7]。国外学者认为,3种致病性耶尔森菌均具有 pYV编码的V抗原,在感染某种致病性耶尔森菌后会获得保护性免疫。本研究同时对疫区和非疫区进行小肠结肠炎耶尔森菌与假结核耶尔森菌的检测发现,疫区啮齿动物中分离的小肠结肠炎耶尔森菌均不具有致病性,疫区家猪和犬致病性小肠结肠炎耶尔森菌的分离率低于非疫区;此外,假结核耶尔森菌仅分布于非疫区的家猪和犬,而未分布于疫区,再次验证了“同心圆”假说的正确性,且在更大范围再次佐证了致病性耶尔森菌的交叉免疫学说。除V抗原外,外膜蛋白A(outer membrance protein A,OmpA)是3种致病性耶尔森菌又一个重要共同抗原,其免疫原性较V抗原更稳定,动物免疫反应强烈[8-9]。
经病原学诊断,广西非疫区0.64%≤5岁腹泻儿童感染致病性小肠结肠炎耶尔森菌。通过PFGE聚类分析显示,家猪、犬携带的小肠结肠炎耶尔森菌与腹泻儿童感染菌株的型别存在较大重叠。可能因家犬活动范围广,与家畜、家禽、野生动物和人类均接触密切,而一旦携带有致病性耶尔森菌,极易造成人类和其他动物感染并导致疫情扩散[10]。
通过对天生桥水电站鼠疫暴发前的情况回溯、静息期内仍可检测到极少量F1抗体阳性宿主动物及指示动物,说明在静息期内宿主动物仍存在鼠疫菌的循环,证实了鼠疫菌在疫源地内在保存的正确性。通过比较长期静息的鼠疫疫源地与非疫源地家猪、犬对致病性耶尔森菌的携带情况,佐证了致病性耶尔森菌的交叉免疫学说。应加强犬携带耶尔森菌的病原学及血清学检测,对于掌握致病性耶尔森菌的流行动态与控制疾病传播具有重要意义。
| [1] | Viu L, Korenberg EI. Natural foci of diseases:the development of the concept at the close of the century[J]. Parazitologiia, 1999, 33(3) : 179–191 . |
| [2] | Wang X, Wei X, Song Z, et al. Mechanism study on a plague outbreak driven by the construction of a large reservoir in southwest china(surveillance from 2000-2015)[J]. PLoS Negl Trop Dis, 2017, 11(3) : e0005425.DOI:10.1371/journal.pntd.0005425. |
| [3] | Liang J, Duan R, Xia S, et al. Ecology and geographic distribution of Yersinia enterocolitica among livestock and wildlife in China[J]. Veter Microbiol, 2015, 178(1/2) : 125–131 . |
| [4] | Wang X, Wang J, Sun H, et al. Etiology of childhood infectious diarrhea in a developed region of China:compared to childhood diarrhea in a developing region and adult diarrhea in a developed region[J]. PLoS One, 2015, 10(11) : e0142136.DOI:10.1371/journal.pone.0142136. |
| [5] | Liang J, Wang X, Xiao Y, et al. Prevalence of Yersinia enterocolitica in pigs slaughtered in Chinese abattoirs[J]. Appl Environ Microbiol, 2012, 78(8) : 2949–2956 .DOI:10.1128/AEM.07893-11. |
| [6] | Kugeler KJ, Staples JE, Hinckley AF, et al. Epidemiology of human plague in the United States, 1900-2012[J]. Emerg Infect Dis, 2015, 21(1) : 16–22 .DOI:10.3201/eid2101.140564. |
| [7] | Wang X, Cui Z, Jin D, et al. Distribution of pathogenic Yersinia enterocolitica in China[J]. Eur J Clin Microbiol Infect Dis, 2009, 28(10) : 1237–1244 .DOI:10.1007/s10096-009-0773-x. |
| [8] | Chen Y, Duan R, Li X, et al. Homology analysis and cross-immunogenicity of OmpA from pathogenic Yersinia enterocolitica, Yersinia pseudotuberculosis and Yersinia pestis[J]. Mol Immun, 2015, 68(2) : 290–299 .DOI:10.1016/j.molimm.2015.09.016. |
| [9] | Gu W, Wang X, Qiu H, et al. Comparative antigenic proteins and proteomics of pathogenic Yersinia enterocolitica bio-serotypes 1B/O:8 and 2/O:9 cultured at 25℃ and 37℃[J]. Microbiol Immun, 2012, 56(9) : 583–594 .DOI:10.1111/mim.2012.56.issue-9. |
| [10] | Wang X, Liang J, Xi J, et al. Canis lupus familiaris involved in the transmission of pathogenic Yersinia spp. in China[J]. Veter Microbiol, 2014, 172(1/2) : 339–344 . |
 2017, Vol. 28
2017, Vol. 28


