扩展功能
文章信息
- 靳木子, 云华, 邰大鹏, 陈宇飞, 白潇
- JIN Mu-zi, YUN Hua, TAI Da-peng, CHEN Yu-fei, BAI Xiao
- 两种方法检测鼠疫耶尔森菌Pla片段的研究
- Detection of Pla Fragment in Yersinia pestis by two methods
- 中国媒介生物学及控制杂志, 2017, 28(3): 238-240
- Chin J Vector Biol & Control, 2017, 28(3): 238-240
- 10.11853/j.issn.1003.8280.2017.03.010
-
文章历史
- 收稿日期: 2017-02-21
- 网络出版时间: 2017-04-11 17:06
2 包头医学院, 内蒙古 包头 014040
2 Baotou Medical College
鼠疫耶尔森菌(Yersinia pestis,鼠疫菌)可引起自然疫源性烈性传染病,其发病急、传播快、病死率高,因此,鼠疫菌的快速检测和鉴定具有重要的意义[1]。目前,鼠疫菌的检测方法主要有经典的“四步检验法”、血清凝集法和PCR检测法,但每种方法均存在不足[2-6]。鼠疫菌的pla基因片段位于鼠疫菌的Pst质粒的遗传信息中,具有相当稳定及非常特异的分子生物学特征,无论典型或非典型的鼠疫菌均具有该特性。大多PCR检测方法将pla基因片段作为检测目标,但易导致假阳性和假阴性。Southern印记杂交(Southern blot)技术是分子生物学领域较经典的检测方法,其基本原理是具有一定同源性的两条核酸单链在一定的条件下,可按碱基互补的原则形成双链,该杂交过程具有高度特异性[7]。Southern印记杂交技术十分灵敏,在理想条件下,用放射性同位素标记的特异性探针和放射自显影技术,即便每条电泳带仅含2 ng DNA也可被清晰地检测出[8-10]。本研究通过Southern印记杂交技术检测鼠疫菌的pla基因片段,并与市售成品试剂盒的检测结果进行对比,验证Southern印记杂交技术在鼠疫菌pla基因片段检测中的有效性。
1 材料与方法 1.1 鼠疫菌pla基因片段鼠疫菌pla基因质粒由中国检验检疫科学研究院惠赠。
1.2 鼠疫菌pla基因质粒的验证参照《国境口岸鼠携带鼠疫杆菌和汉坦病毒快速检测方法》(SN/T 2616-2010)中鼠疫菌pla基因的引物片段设计引物。PCR反应体系:取质粒2 μl,上、下游引物各1 μl(10 μ mol/L),Taq DNA聚合酶(5 U/μ l)0.5 μ l,dNTPs 4 μl(2.5 mol/L),10×PCR缓冲液5 μl,灭菌双蒸水36.5 μl;反应体系:95 ℃预变性5 min,之后94 ℃ 30 s、56 ℃ 30 s、72 ℃ 30 s,共35个循环,最后72 ℃延伸10 min。采用1%琼脂糖凝胶电泳检测扩增产物,送至华大基因公司测序。
1.3 地高辛(DIG)标记探针及标记效率的检测通过美国国立生物技术信息中心(NCBI)查阅pla基因片段序列,设计引物通过PCR从鼠疫菌质粒上扩增病毒DNA序列的特异片段并做探针标记。PCR法标记探针:以pla质粒为PCR模板,具体过程参照PCR法DIG探针合成试剂盒(Roche Cat.#REF 11636090910,11340020)说明书,标记结束后取2 μl标记产物进行琼脂糖凝胶电泳,检测探针标记效率及产量。
1.4 基因组DNA电泳检测将鼠疫菌质粒5 μl进行0.8%琼脂糖凝胶电泳检测,凝胶大小为70~80 mm,电压30 V,电泳时间30 min,保持电泳槽低温状态。
1.5 真空转膜及固定对琼脂糖凝胶进行变性和中和处理,处理过程按DIG标记探针试剂盒说明书进行。转膜用785型真空转膜仪(Bio-Rad)进行,参照周长发等[5]方法。转膜结束后采用紫外交联(1200 J)固定膜上DNA。
1.6 杂交及信号检测杂交具体过程参照试剂盒说明书,杂交液用量5 ml,42 ℃预杂交1~3 h。探针使用量10 μl,杂交液用量5 ml,于40 ℃杂交18 h。杂交结束后进行洗膜处理,使用洗液Ⅱ(0.5×SSC,0.1% SDS)于64 ℃洗膜。封闭液孵育30 min,抗体工作液孵育1 h,其余过程与试剂盒说明书相同。最后于黑暗静置状态下进行显影操作,时间为30 min~ 12 h,显影结束后,尼龙膜照相留存。
1.7 鼠疫菌质粒核酸检测采用鼠疫菌核酸检测试剂盒(PCR-荧光探针法)(Cat.#DA-BN122,2016001,中山大学达安基因股份有限公司)进行检测。
2 结果 2.1 质粒片段的有效性通过PCR及基因测序对所得样本的有效性进行判断。所需目的条带大小符合实验目的,见图 1。对质粒的PCR产物进行测序,经Blast比对,与鼠疫菌1045 plasmid pPCP,complete sequence的序列一致性达99%,见图 2。

|
| 注:A. DNA Marker(1 000 bp);B. pla基因片段(525 bp)。 图 1 鼠疫菌Pla质粒电泳结果 Figure 1 The electrophoresis results of Y. pestis Pla plasmid |
| |

|
| 注:Yersinia pestis 1045 plasmid pPCP,complete sequence.鼠疫菌1045质粒完整序列;Sequence ID. qb|CP006797.1| Length:9610 Number of Matches:1.序列ID:qb|CP006797.1|,全长9610,匹配序号1;Range 1:3305 to 3781.范围1:3305~3781;Score.序列比对得分值;Expect.期望值;Identities.同源性;Gaps.差异度;Strand Plus/Minus.碱基链方向,正向/反向。 图 2 鼠疫菌Pla质粒测序结果 Figure 2 The sequence of Pla fragment in Y. pestis |
| |
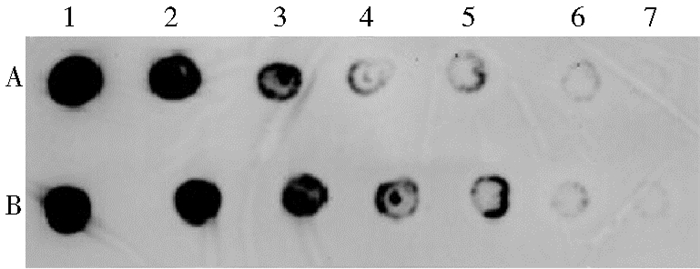
PCR法探针标记效率的结果如图 3所示,阳性对照DNA和PCR法均显示7个稀释点。经显色亮度比对,PCR法标记探针稀释浓度为0.3 pg/μl时,其显色强度与随机引物法标记的探针稀释浓度为3 pg/μl时一致。由此可见,PCR法标记探针的效率较好。
|
| 注:A.地高辛标记的对照DNA;B. PCR标记的探针。 图 3 标记探针的检测效率 Figure 3 The detection efficiency of labelled probe |
| |
PCR法标记的探针杂交背景浅,杂交条带清晰,可直观地观察pla基因拷贝数,杂交效率较高,见图 4。

|
| 注:A.空白质粒阴性对照;B~D. Pla片段。 图 4 Southern印记杂交技术检测结果 Figure 4 The detection of Pla fragmentof Y. pestis by Southern blot |
| |
该鼠疫菌质粒模板经实时荧光定量PCR(qRT-PCR)检测显示为阳性,见图 5。
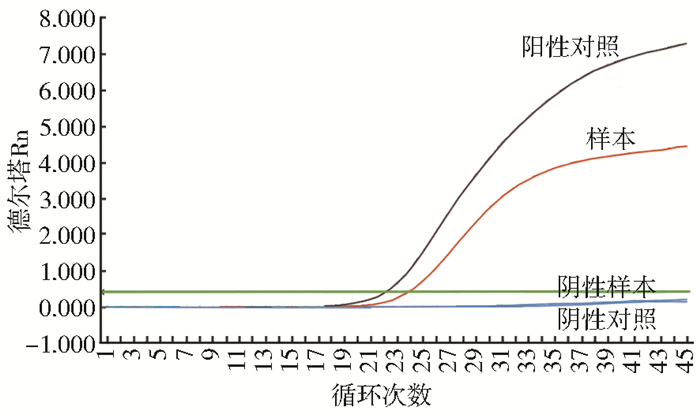
|
| 图 5 鼠疫菌质粒qRT-PCR检测结果 Figure 5 The qRT-PCR detection results of Y. pestis plasmid |
| |
自20世纪50年代开始,研究者采用经典方法——常规检测法检测鼠疫菌,检测过程主要有显微镜涂片检查、分离培养、鼠疫噬菌体裂解试验和动物实验,涂片后利用革兰染色、Wayson染色或免疫荧光法进行观察[11],分别从细菌形态鉴定及F1抗原检测及毒力判定等方面全方位地鉴定鼠疫菌,有利于对鼠疫疫源地及其流行强度的研究,但该方法耗时长、过程复杂、需研究者有较丰富的经验[12]。
近年来,随着分子生物学技术的发展,越来越多的生物技术应用于鼠疫菌的检测、诊断、鼠疫监测及相关科学研究中。本研究发现,采用Southern印记杂交技术与qRT-PCR成品试剂盒检测鼠疫菌结果相同,通过Southern印记杂交技术可明确地检测到pla基因,且该技术所需实验设备简单、相关费用较少,较适于口岸地区实验条件及经费有限的实验室开展工作;虽然Southern印记杂交技术较qRT-PCR法耗时相对较长,但其可有效地避免qRT-PCR出现假阳性或假阴性结果,是目前分子生物学检测技术的主流。
Southern印记杂交技术与鼠疫菌传统四步法比较,其检测时间短、生物安全性较高,不受实验室培养条件的限制,可有效地避免动物接种感染过程的风险,更适用于鼠疫菌的检测,对鼠疫菌引发的突发公共卫生事件有重要意义。
| [1] | 李建云, 张忠兵, 范蒙光, 等. 内蒙古2004年至2013年长爪沙鼠鼠疫疫源地鼠疫监测结果分析[J]. 内蒙古医学杂志, 2014, 46(9): 1082–1085. |
| [2] | 魏玉利, 邱芳蕾, 刘圣臣. 鼠疫菌检测方法的研究进展[J]. 生命科学仪器, 2007, 5(4): 32–34. |
| [3] | Hinnebusch J, Schwan TG. New method for plague surveillance using polymerase chain reaction to detect Yersinia pestis in fleas[J]. J Clin Microbiol, 1993, 31(6) : 1511–1514 . |
| [4] | Radnedge L, Gamez-Chin S, McCready PM, et al. Identification of nucleotide sequences for the specific and rapid detection of Yersinia pestis[J]. Appl Environ Microbiol, 2001, 67(8) : 3759–3762 .DOI:10.1128/AEM.67.8.3759-3762.2001. |
| [5] | 周长发, 张锐, 张晓, 等. 地高辛随机引物法标记探针的Southern杂交技术优化[J]. 中国农业科技导报, 2009, 11(4): 123–128. |
| [6] | 白林庆, 司晓艳, 涛波. 内蒙古主要鼠疫传播媒介蚤类的分布特征及其流行病学意义[J]. 实用预防医学, 2015, 22(5): 639–640. |
| [7] | Southern EM. Detection of specific sequences among DNA fragments separated by gel electrophoresis[J]. J Mol Biol, 1975, 98(3) : 503–517 .DOI:10.1016/S0022-2836(75)80083-0. |
| [8] | Höltke HJ, Ankenbauer W, Mühlegger K, et al. The digoxigenin (DIG) system for non-radioactive labelling and detection of nucleic acids-an overview[J]. Cell Mol Biol, 1995, 41(7) : 883–905 . |
| [9] | McCabe MS, Power JB, de Laat AMM, et al. Detection of single-copy genes in DNA from transgenic plants by nonradioactive Southern blot analysis[J]. Mol Biotechnol, 1997, 7(1) : 79–84 .DOI:10.1007/BF02821545. |
| [10] | Matthews JA, Kricka LJ. Analytical strategies for the use of DNA probes[J]. Anal Biochem, 1988, 169(1) : 1–25 .DOI:10.1016/0003-2697(88)90251-5. |
| [11] | 龚正达, 于心, 刘起勇, 等. 中国鼠疫自然疫源地分型研究Ⅵ.鼠疫媒介生物学特征[J]. 中华流行病学杂志, 2012, 33(8): 818–822. |
| [12] | 秦长育, 许磊, 张荣祖, 等. 中国鼠疫自然疫源地分型研究Ⅴ.鼠疫宿主生物学特征[J]. 中华流行病学杂志, 2012, 33(7): 692–697. |
 2017, Vol. 28
2017, Vol. 28

