扩展功能
文章信息
- 张少森, 周水森, 周正斌, 王学忠, 蒋伟康, 施文琦, 杨源和, 尹授钦, 李希尚, 王加志, 李胜国, 张仪, 周晓农
- ZHANG Shao-sen, ZHOU Shui-sen, ZHOU Zheng-bin, WANG Xue-zhong, JIANG Wei-kang, SHI Wen-qi, YANG Yuan-he, YIN Shou-qin, LI Xi-shang, WANG Jia-zhi, LI Sheng-guo, ZHANG Yi, ZHOU Xiao-nong
- 中国-缅甸边境地区微小按蚊种群密度及其生态习性调查
- Investigation on population density and bionomics of Anopheles minimus in China-Myanmar border
- 中国媒介生物学及控制杂志, 2017, 28(3): 216-219, 254
- Chin J Vector Biol & Control, 2017, 28(3): 216-219, 254
- 10.11853/j.issn.1003.8280.2017.03.005
-
文章历史
- 收稿日期: 2017-02-13
- 网络出版时间: 2017-04-11 16:16
2 云南省寄生虫病防治研究所, 云南 普洱 665000;
3 腾冲市疾病预防控制中心, 云南 腾冲 679100
2 Yunnan Provincial Institute of Parasitic Diseases;
3 Tengchong Center for Disease Control and Prevention
微小按蚊(Anopheles minimus)在我国南部和东南亚特别是湄公河流域国家广泛分布,是该地区疟疾流行的主要传播媒介[1-6],为国内外媒介生物学和疟疾防治研究的热点[7-8]。云南省作为我国疟疾的高流行区,多年来采取以传染源控制和媒介防制结合的疟疾防治策略,针对微小按蚊采取了有效的控制措施,疟疾发病率逐年下降[3, 9]。自2010年以来,随着我国消除疟疾项目的启动,该地区疟疾病例数从2010年的729例下降至2015年的21例[10-11]。在有效控制疟疾传播的同时,对输入性疟疾引起的继发传播风险逐渐被关注[12-14]。特别是中国-缅甸(中缅)边境地区,毗邻缅甸一侧疟疾流行严重,跨境人口流动频繁且存在高效传疟媒介,成为我国消除疟疾的重点和难点区域,也是进行疟疾传播风险评估研究的热点地区[15-22]。随着疟疾疫情不断减少,2010年消除疟疾项目启动后,该地区仍持续开展疟疾防治研究和监测,但关于主要传疟媒介(如微小按蚊)分布及其生态习性的调查较少。因此,通过对云南省中缅边境地区微小按蚊种群密度及其生态习性进行现场调查和实验室检测,为该地区疟疾传播风险评估和消除后疟疾监测提供科学依据。
1 材料与方法 1.1 研究现场选择位于云南省中缅边境地区的腾冲市(98°05′~98°45′E、24°38′~25°52′N),采用点面结合法在25° N以南,沿龙川江流域选择芒棒、五合、团田、蒲川和新华乡作为研究现场,每个乡选取2个自然村作为媒介调查点。
1.2 成蚊密度及其季节消长调查 1.2.1 标本采集于2015年5月下旬至12月下旬采用诱蚊灯诱捕法在每个自然村不同方位设置人房和牛房各3处作为调查点,日落前(约20:00)挂灯,次日日出(约06:00)收灯。将捕获的成蚊用氯仿麻醉后进行形态学鉴定和登记,并将标本用EP管单管收集,带回实验室进行分子生物学鉴定。每月上下旬各监测1次,连续监测7个月。
1.2.2 夜间叮人活动和叮人率调查以定人、定时、定点原则,在调查点所在的自然村每村布点3处(村内2处、村外1处),采用双帐人诱法监测。在人诱点附近50 m处选择开放式牛房1处同时进行观察。自日落(20:00)至次日日出(06:00)每小时捕蚊1次并计数。每月上下旬各监测1次。
1.2.3 嗜血习性调查在调查点所在的自然村内,于日出后(08:00-09:00)选择人房15间、牛房5间进行人工全捕,将捕获的饱血按蚊立即用氯仿处死后进行干燥,装入EP管,带回实验室,采用多重PCR方法进行胃血来源鉴定[23-26]。
1.3 蚊幼虫密度及孳生地调查采用定人、定时、定点的捕捞法,选择水源比较稳定的水体作为调查点,在孳生地边缘或有遮阴的缓流处捞取10~20勺,每勺捞取1 m宽水面蚊幼虫,以每勺捞取的蚊幼虫和蛹数作为蚊密度(条/勺)。对捕获的1~3龄蚊幼虫记录密度,4龄蚊幼虫进行形态学鉴定后记录密度。
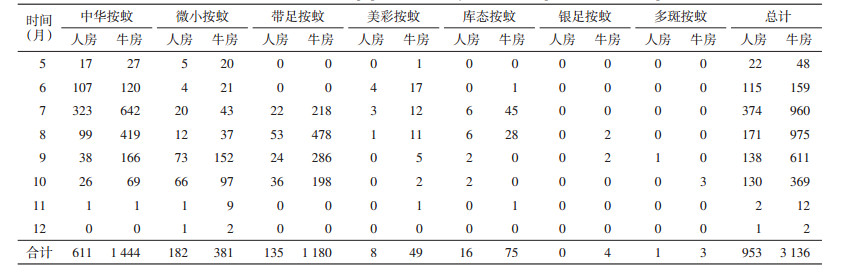
2 结果 2.1 成蚊种群构成及其密度共捕获按蚊4 089只,经形态学鉴定分别为中华按蚊(An. sinensis)、微小按蚊、带足按蚊(An. peditaeniatus)、库态按蚊(An. culicifacies)、美彩按蚊(An. splendidus)、银足按蚊(An. argyropus)和多斑按蚊(An. maculatus)共7种,以中华按蚊(2 055/4 089,50.26%)、带足按蚊(1 315/ 4 089,32.16%)和微小按蚊(563/4 089,13.77%)为优势种;在人房和牛房分别捕获微小按蚊182和381只,见表 1。微小按蚊密度高峰出现在9月,牛房和人房微小按蚊密度分别为32.70和12.20只/(灯·夜);牛房微小按蚊密度始终高于人房,见图 1。
|
|
| 图 1 腾冲市微小按蚊成蚊密度季节消长 Figure 1 Seasonality of An. minimus adult population density |
| |
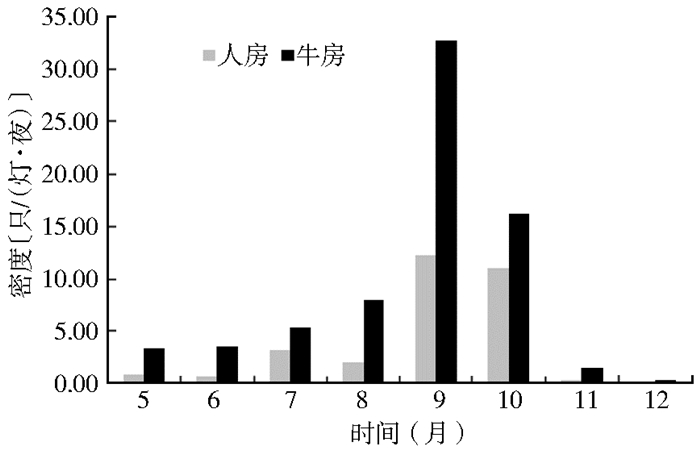
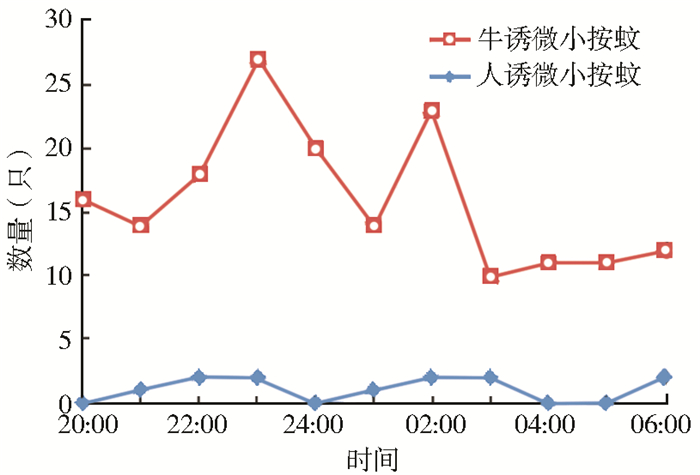
微小按蚊在日落后通宵均有吸血活动,以牛房为主,人房与牛房捕获吸血活动的微小按蚊比例为1:10。吸血活动出现2个高峰,分别在23:00和02:00,见图 2。微小按蚊叮人率以9月下旬最高,达2.0只/(人·夜),见图 3。
|
| 图 2 微小按蚊夜间吸血活动时间变化 Figure 2 Active time of An. minimus host seeking behavior |
| |

|
| 图 3 微小按蚊叮人率季节变化 Figure 3 Seasonal fluctuation of An. minimus human bite rate |
| |
检测微小按蚊胃血42份,其中猪源血22份,人畜(猪或牛)混合血液各6份,人源血和牛源血各4份,微小按蚊偏吸牲畜血液,人血指数为0.23(图 4)。

|
| 注:M.分子质量标准;1~10.蚊胃血;犬、猪、牛、人.血阳性对照;Mix.混合阳性对照。 图 4 微小按蚊胃血PCR检测结果 Figure 4 PCR results for blood meal sources in An. minimus |
| |
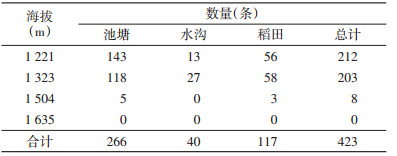
在孳生地共捕获微小按蚊幼虫423条,其中池塘、水沟和稻田分别为266、40和117条,见表 2。在海拔1 200~1 300 m附近地区微小按蚊幼虫密度较高,见表 2。
微小按蚊作为云南省的主要传疟媒介,是我国疟疾防治研究重点关注的蚊种之一[27]。新中国成立以来,我国学者对微小按蚊开展了深入详细的调查研究,关于其地理分布、生态习性及传疟作用等均有报道[1, 28-33],为制定有针对性的疟防措施提供了科学依据。随着我国疟疾流行的逐渐减弱,本地疟疾病例数持续大幅下降,传疟媒介相关研究也相应减少。同时,随着我国消除疟疾工作的不断深入推进,本地疟疾的流行区域进一步缩小[10, 34]。因此,疟疾监测和再传播风险评估成为重点工作。国内已开展的疟疾风险评估研究资料多采取定性或半定量方法[22, 35-37],以弥补媒介资料的缺失。
腾冲市位于我国云南省西部,是云南省与缅甸接壤的25个边境县之一,曾为疟疾高流行区,微小按蚊是该地区低海拔区域的主要传疟媒介[1, 38]。通过实施以媒介控制措施为主的疟疾防治策略[3],腾冲市疟疾流行得到有效控制,自2013年已连续3年无本地疟疾病例报告,但输入性疟疾病例报告数仍较多,以县为单位的报告病例数居全国前列[10, 12, 15]。
本调查发现,腾冲市微小按蚊种群密度和叮人率与文献比较有所下降[1, 39-41],且更偏吸牲畜血。同时,微小按蚊构成比也有所下降,仅为13.77%,曾有报道最高为61.68%[1, 38],该结果与同期媒介监测结果一致[42],可能是当地疟疾流行大幅下降的原因。本研究发现,在相对较静止的孳生环境(池塘),微小按蚊数量多于有流动水的孳生环境(水稻田和溪沟),与文献报道的微小按蚊孳生地多在有遮阴的缓流和水稻田有所不同[3, 39],可能与当地水田及森林面积减少,而种植烟草和经济类植物的旱地增加有关。需进一步开展土地利用和覆盖状况对微小按蚊生态习性影响的研究,为该地区微小按蚊的监测、防治及疟疾传播风险评估提供参考。
腾冲市微小按蚊偏吸牲畜血,说明当前人蚊接触的风险较低。随着当地经济的发展、耕作制度的改变及水牛等大型牲畜数量逐渐减少或地区生物屏障发生变化,可能导致微小按蚊叮人习性的改变,在今后的监测中也应加强关注。
| [1] | 董学书, 周红宁, 龚正达. 云南省蚊类志[M]. 昆明: 云南科技出版社, 2010: 85-93. |
| [2] | 陆宝麟. 中国动物志[M]. 北京: 科学出版社, 1997: 55-89. |
| [3] | 卫生部疾病预防控制局. 疟疾防治手册[M]. 3版. 北京: 人民卫生出版社, 2007: 47-78. |
| [4] | Hay SI, Sinka ME, Okara RM, et al. Developing global maps of the dominant Anopheles vectors of human malaria[J]. PLoS Med, 2010, 7(2) : e1000209.DOI:10.1371/journal.pmed.1000209. |
| [5] | Massey NC, Garrod G, Wiebe A, et al. A global bionomic database for the dominant vectors of human malaria[J]. Sci Data, 2016: 160014.DOI:10.1038/sdata.2016.14. |
| [6] | Manguin S, Garros C, Dusfour I, et al. Bionomics, taxonomy, and distribution of the major malaria vector taxa of Anopheles subgenus Cellia in Southeast Asia:an updated review[J]. Infect Genet Evol, 2008, 8(4) : 489–503 .DOI:10.1016/j.meegid.2007.11.004. |
| [7] | Gunasekaran K, Sahu SS, Jambulingam P. Estimation of vectorial capacity of Anopheles minimus Theobald & An. fluviatilis James (Diptera:Culicidae)in a malaria endemic area of Odisha State, India[J]. Indian J Med Res, 2014, 140(5) : 653–659 . |
| [8] | Garros C, Van Bortel W, Trung HD, et al. Review of the minimus complex of Anopheles, main malaria vector in Southeast Asia:from taxonomic issues to vector control strategies[J]. Trop Med Int Health, 2006, 11(1) : 102–114 .DOI:10.1111/tmi.2006.11.issue-1. |
| [9] | Xu JW, Li Y, Yang HL, et al. Malaria control along China-Myanmar border during 2007-2013:an integrated impact evaluation[J]. Infect Dis Poverty, 2016: 75.DOI:10.1186/s40249-016-0171-4. |
| [10] | 张丽, 周水森, 丰俊, 等. 2014年全国疟疾疫情分析[J]. 中国寄生虫学与寄生虫病杂志, 2015, 33(5): 319–326. |
| [11] | 周水森, 王漪, 李雨. 2010年全国疟疾疫情分析[J]. 中国寄生虫学与寄生虫病杂志, 2011, 29(6): 401–403. |
| [12] | Zhou S, Li ZJ, Cotter C, et al. Trends of imported malaria in China 2010-2014:analysis of surveillance data[J]. Malar J, 2016: 39.DOI:10.1186/s12936-016-1093-0. |
| [13] | 夏志贵, 杨曼尼, 张少森, 等. 2011年全国输入性疟疾病例流行病学分析[J]. 中华疾病控制杂志, 2014, 18(3): 226–230. |
| [14] | 杨成运, 钱丹, 陈伟奇, 等. 2012-2014年河南省境外输入性疟疾疫情分析[J]. 中国血吸虫病防治杂志, 2016, 28(4): 444–446. |
| [15] | Li SG, Yin SQ, Wang JZ, et al. Shifting from control to elimination:analysis of malaria epidemiological characteristics in Tengchong county around China-Myanmar border, 2005-2014[J]. Malar J, 2016: 45.DOI:10.1186/s12936-016-1089-9. |
| [16] | Xu JW, Liu H, Zhang Y, et al. Risk factors for border malaria in a malaria elimination setting:a retrospective case-control study in Yunnan, China[J]. Am J Trop Med Hyg, 2015, 92(3) : 546–551 .DOI:10.4269/ajtmh.14-0321. |
| [17] | Wang DQ, Li SG, Cheng ZB, et al. Transmission risk from imported Plasmodium vivax malaria in the China-Myanmar border region[J]. Emerg Infect Dis, 2015, 21(10) : 1861–1864 .DOI:10.3201/eid2110.150679. |
| [18] | Shi BY, Tan Q, Zhou XN, et al. Mining geographic variations of Plasmodium vivax for active surveillance:a case study in China[J]. Malar J, 2015: 216.DOI:10.1186/s12936-015-0719-y. |
| [19] | 钱颖骏, 王多全, 邓瑶, 等. 我国省县二级消除疟疾督导与评估指标框架的构建与应用[J]. 中国血吸虫病防治杂志, 2015, 27(3): 255–262. |
| [20] | 施文琦, 周晓俊, 张仪, 等. 中缅边境(西段)传疟媒介的初步调查[J]. 中国寄生虫学与寄生虫病杂志, 2011, 29(2): 134–137. |
| [21] | 陈国伟, 魏春, 李华宪, 等. 云南疟疾监测点2008年疟疾流行趋势与流行特征[J]. 中国寄生虫学与寄生虫病杂志, 2011, 29(1): 54–57. |
| [22] | 尹授钦, 夏尚, 周兴武, 等. 云南省边境地区疟疾传播风险评估[J]. 中国寄生虫学与寄生虫病杂志, 2016, 34(3): 255–260. |
| [23] | Kent RJ, Norris DE. Identification of mammalian blood meals in mosquitoes by a multiplexed polymerase chain reaction targeting cytochrome B[J]. Am J Trop Med Hyg, 2005, 73(2) : 336–342 . |
| [24] | 张井巍, 姜进勇, 王学忠, 等. 应用多重PCR法鉴定分析云南4县按蚊胃血源[J]. 中国寄生虫学与寄生虫病杂志, 2014, 32(1): 76–77. |
| [25] | 郭绍华, 周水森, 黄芳, 等. 应用多重PCR法分析西藏察隅疟疾流行区按蚊吸血习性[J]. 中国寄生虫学与寄生虫病杂志, 2012, 30(2): 122–126. |
| [26] | 杨曼尼, 马雅军. 应用多重PCR法鉴定蚊胃血血源的研究[J]. 中国病原生物学杂志, 2008, 3(11): 815–817,814. |
| [27] | 周祖杰. 中国疟疾的防治与研究[M]. 北京: 人民卫生出版社, 1991: 191-199. |
| [28] | 郑彬, 汤林华, 王学忠, 等. 云南省微小按蚊A、C种群密度高峰及嗜血习性的观察[J]. 国际医学寄生虫病杂志, 2006, 33(4): 171–173. |
| [29] | 王学忠, TownsonH. 微小按蚊种群成员分子变异与系统发育的关系[J]. 中国媒介生物学及控制杂志, 2001, 12(4): 252–256. |
| [30] | 郑彬, 汤林华, 马雅军, 等. 云南微小按蚊A和C栖性的比较研究[J]. 中国寄生虫学与寄生虫病杂志, 2005, 23(3): 146–149. |
| [31] | 范波, 黄正美, 李六九, 等. 玉溪哀牢山微小按蚊数量变化与疟疾流行的研究[J]. 中国热带医学, 2005, 5(1): 45–46. |
| [32] | 林荣幸, 杨灼宏, 潘波, 等. 微小按蚊分布区灭疟后期疟疾流行病学特点和监测方法研究[J]. 华南预防医学, 2003, 29(1): 17–19. |
| [33] | 王学忠, 李菊昇, 王丕玉. 微小按蚊种团酯酶同工酶比较研究[J]. 实用寄生虫病杂志, 2000, 8(1): 9–11. |
| [34] | Hu T, Liu YB, Zhang SS, et al. Shrinking the malaria map in China:measuring the progress of the National Malaria Elimination Programme[J]. Infect Dis Poverty, 2016: 52.DOI:10.1186/s40249-016-0146-5. |
| [35] | 周晓农, 张少森, 徐俊芳, 等. 我国消除疟疾风险评估分析[J]. 中国寄生虫学与寄生虫病杂志, 2014, 32(6): 414–418. |
| [36] | 王晓欢, 张山鹰, 杨发柱, 等. 福建省消除疟疾地区重新流行风险评价[J]. 预防医学论坛, 2016, 22(5): 358–361,365. |
| [37] | 周雪梅, 莫海亮, 梁启敏. 贵州省荔波县疟疾流行风险评估调查[J]. 中国寄生虫学与寄生虫病杂志, 2016, 34(3): 195–197. |
| [38] | 董学书. 云南省的传疟媒介及其有关的生态习性[J]. 中国寄生虫病防治杂志, 2000, 13(2): 144–145. |
| [39] | 王学忠, 杜尊伟, 卢勇荣, 等. 云南南部微小按蚊生态学及传疟作用研究[J]. 中国媒介生物学及控制杂志, 1999, 10(5): 343–346. |
| [40] | Liu MD, Wang XZ, Zhao TY, et al. Analysis of the relationship between density and dominance of Anopheles minimus(Diptera:Culicidae)with environmental parameters in southern Yunnan province, People's Republic of China[J]. J Med Entomol, 2008, 45(6) : 1007–1010 .DOI:10.1093/jmedent/45.6.1007. |
| [41] | 王学忠, 杜尊伟, 李菊昇, 等. 不同生境蚊类生态学研究[J]. 中国媒介生物学及控制杂志, 2005, 16(2): 98–100. |
| [42] | 李希尚, 李胜国, 王加志, 等. 云南省腾冲市2012-2013年蚊媒调查分析[J]. 中国媒介生物学及控制杂志, 2016, 27(4): 398–401. |
 2017, Vol. 28
2017, Vol. 28