扩展功能
文章信息
- 王艳华, 毛玲玲, 彭遥, 孙英伟, 王子江, 张家勇, 张稷博, 田疆
- WANG Yan-hua, MAO Ling-ling, PENG Yao, SUN Ying-wei, WANG Zi-jiang, ZHANG Jia-yong, ZHANG Ji-bo, TIAN Jiang
- 在辽宁省长角血蜱中检测出土拉弗朗西斯菌
- Francisella tularensis was detected in Haemaphysalis longicornis from Liaoning province
- 中国媒介生物学及控制杂志, 2016, 27(6): 529-532
- Chin J Vector Biol & Control, 2016, 27(6): 529-532
- 10.11853/j.issn.1003.8280.2016.06.001
-
文章历史
- 收稿日期: 2016-07-08
- 网络出版时间: 2016-08-11 13:00
2 辽宁省疾病预防控制中心, 沈阳 110005
2 Liaoning Center for Disease Control and Prevention
蜱的地理分布广,对环境适应性强,可以同时储存并传播多种病原体,包括包柔氏螺旋体属、立克次体属、弗朗西斯菌属、埃利希体属、无形体属、考德里体属和考克斯体属等[1]。蜱也可以携带一些互相依赖的共生体,如非致病性立克次体和沃尔巴克类细菌[2-3]。由于人类对于环境的开发利用,蜱的分布范围进一步扩大,使得人类接触蜱的概率增大,进而导致蜱传疾病的发病率增加[4-5]。因此,了解蜱传疾病的病原体在媒介生物中的携带情况,对于此类传染病的预防和控制尤为重要。目前,我国关于伯氏疏螺旋体、巴尔通体、无形体、立克次体和布尼亚病毒在蜱中的分布研究均有报道[6-11],但是对于弗朗西斯菌属在长角血蜱(Haemaphysalis longicornis)中的分布情况还未见报道。鉴于此,通过在辽宁省采集长角血蜱,进行弗朗西斯菌属的16S rRNA检测及系统进化研究。
1 材料与方法 1.1 蜱类标本2013年7月,在辽宁省抚顺市新宾县响水河乡大牛家沟、孟家沟、岗山和辽阳市河栏镇,采集游离蜱和羊、牛体表蜱。游离蜱采集地点为抚顺市新宾县岗山和辽阳市河栏镇附近,羊体表蜱的采集地点为大牛家沟,牛体表蜱的采集地点为孟家沟。
1.2 DNA提取及培养将所有蜱用75%乙醇浸泡(3 min)洗涤2次。再用无菌蒸馏水漂洗3次,最后加500 μl无菌生理盐水,用研磨棒研磨成匀浆。将每组蜱匀浆,取1/2接种到半胱氨酸心琼脂血(CHAB)培养基,置于37 ℃含5%CO2的培养箱中孵育;另外1/2用于提取DNA,按照QIAGEN组织提取试剂盒说明书操作步骤进行。
1.3 PCR扩增根据文献[12-13]中的弗朗西斯菌属16S rRNA引物进行优化,上游引物:Ft16S-F:5′ -TAC CAG TTG GAA ACG RCT GT-3′,下游引物:Ft16S-R:5′ -TGC GGG ACT TAA CCC AAC AT-3′,扩增片段长度为949 bp。反应体系总体积为20 μl,包括2×EasyTaq Supermix 10 μl,上、下游引物各0.6 μl,模板8.8 μl。反应条件:95 ℃ 5 min;95 ℃ 1 min,59 ℃ 1 min,72 ℃ 1 min,共30个循环;72 ℃ 10 min。以土拉弗朗西斯菌(土拉菌)疫苗株(LVS)核酸作为阳性对照,无菌去离子水作为阴性对照,进行16S rRNA的巢式PCR。用德国Sensoquest LabCycler PCR扩增仪,PCR产物用1.5%的琼脂糖凝胶,100 V电泳30 min,观察是否有目的基因片段。
1.4 测序及序列比对将有目的基因片段产物送北京天一辉远生物科技有限公司进行双向测序和拼接,得到完整的序列。将所有序列在NCBI网站(http://www.ncbi.nlm.nih.gov/BLAST)用Blast进行比对,以期获得同源性最高的微生物种类。
1.5 系统进化分析从GenBank下载39个弗朗西斯菌属和弗朗西斯菌属(类)内共生体的16S rRNA序列,和本研究测序得到的16S rRNA序列,利用Mega 6.06软件,采用1 000次引导替换的邻接法构建进化树。替换模型采用最大复合似然法,<50的引导值被剔除。
2 结果 2.1 蜱种鉴定采自辽宁省抚顺和辽阳市的蜱共357只,经形态学鉴定,均为长角血蜱。幼蜱以10只/组,成蜱以5只/组,共分为38组,进行细菌分离和核酸检测,编号见表 1。
将38组蜱1/2的匀浆接种到CHAB培养基上,置于37 ℃含5%CO2的培养箱中,孵育7 d后均有细菌生长。在接种牛和羊体表寄生蜱的培养基上,可见杂菌很多,连成一片,肉眼难以挑出类似于土拉菌的菌落。在接种游离蜱的培养基上,有一些疑为土拉菌的菌落,经分离培养和免疫学鉴定后均被排除。
2.3 蜱标本的PCR检测38组蜱经16S rRNA引物扩增后,25组有扩增条带,送北京天一辉远生物科技有限公司测序后,13组得到测序结果,见表 1。由表 1可见,有5组的16S rRNA与土拉菌T01的序列一致性最高,可以推测其中至少有5只蜱携带土拉菌。河栏镇共采集游离蜱236只,由此推算,对于土拉菌的最小携带率为2.12%(5/236)。
2.4 系统进化分析结果对13组测序结果与39个弗朗西斯菌属、弗朗西斯菌属(类)内共生体的16S rRNA序列,共52个序列经系统进化分析,构建进化树,见图 1。13组蜱的16S rRNA序列可分成两类,第1类与中国10株土拉菌、已公布测序的土拉菌4个亚种聚在一个分支上,包括he8、he11、he13、he15和he18;第2类单独聚在一个分支上,包括he1、he2、he5~7、he12、he17和he23。从主干分支来看,第2类是与17个弗朗西斯菌属(类)内共生体聚在一个大的分支上(除1个Ornithodorus porcinus symbiont和1个Dermacentor variabilis symbiont)。
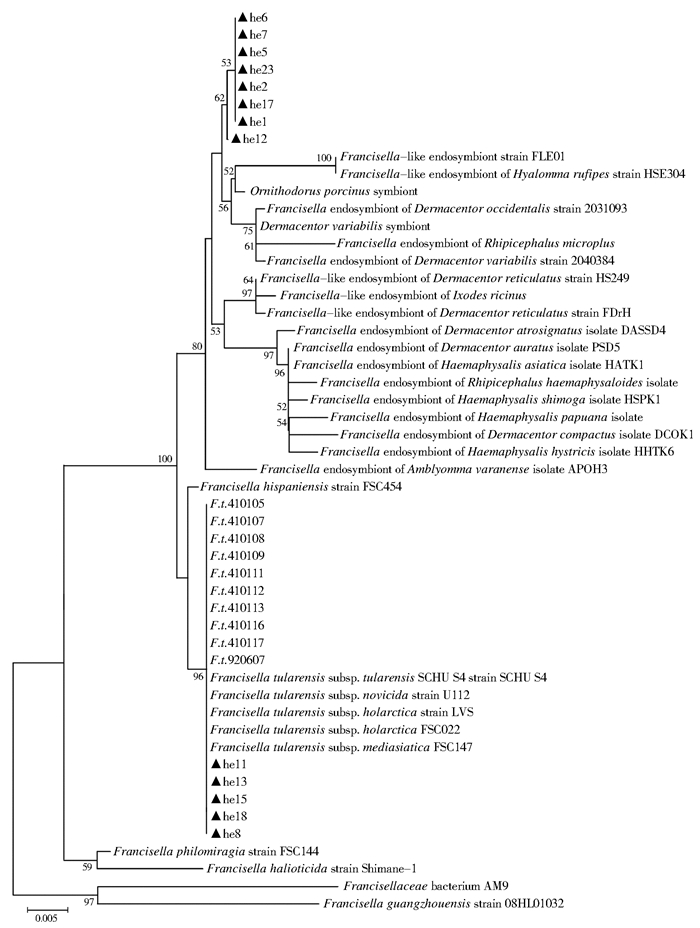
|
| 图 1 52个弗朗西斯菌属和弗朗西斯菌属(类)内共生体的16S rRNA序列进化树 Figure 1 The phylogenetic tree of 16S rRNA including 52 Francisella and Francisella-like endosymbiont |
| |
本研究中13组蜱的16S rRNA序列已提交到GenBank数据库,登录号为KX465115~KX465127。
3 讨论本研究将辽宁省抚顺市新宾县和辽阳市河栏镇采集的357只长角血蜱分成38组,进行弗朗西斯菌属和弗朗西斯菌属(类)内共生体的16S rRNA检测,推算出河栏镇长角血蜱对于土拉菌的最小携带率为2.12%。在目前已知的文献报道中,本研究为首次在长角血蜱中检测出土拉菌。
本研究中的13组蜱标本16S rRNA序列和39个弗朗西斯菌属、弗朗西斯菌属(类)内共生体的16S rRNA序列,经系统进化分析后构建的进化树显示,可将这13组序列分成两类。说明辽宁省的长角血蜱一部分携带土拉菌,另一部分携带弗朗西斯菌属(类)内共生体。在我国8个省份的一项调查研究中[14],从中国南方、中部和北方的10个地区采集蜱849只,进行8种病原体的检测,包括伯氏疏螺旋体、埃利希体属、立克次体、巴贝西虫属/泰来虫属、反刍兽埃利希体、贝氏柯克斯体和土拉菌。结果在长角血蜱中检测出Borrelia carolinensis和Borrelia bissettii,而未检出土拉菌。国外有研究硬蜱〔肩突硬蜱(Ixodes scapularis)、血红扇头蜱(Rhipicephalus sanguineus)和长角血蜱〕和软蜱〔毛白钝缘蜱(Ornithodoros moubata)〕中的共生体与蜱传细菌性传染病的关系。结果发现,长角血蜱共生体与血红扇头蜱共生体有较近的亲缘关系,但并未指出长角血蜱共生体和弗朗西斯菌属有何关系[15]。Nakao等[16]在对7个蜱种进行6种病原体检测时发现,在卵形硬蜱(I. ovatus)、全沟硬蜱(I. persulcatus)、蓖子硬蜱(I. ricinus)和钝眼龟形花蜱(Amblyomma testudinarium)中均检测出弗朗西斯菌属,而在长角血蜱、彩饰钝眼蜱(Amblyomma variegatum)和台湾血蜱(H. formosensis)中均未检测出弗朗西斯菌属[16]。由此可见,本研究为首次在辽宁省河栏镇长角血蜱中检测出土拉菌。
土拉菌是一种可以使人和多种动物(如野兔、鼠类,羊、牛、猪畜类等)发生土拉热的病原体,通常由媒介生物或动物宿主传播给人类,是潜在的生物战剂[17]。本研究采集的357只长角血蜱,检测出土拉菌和弗朗西斯菌属(类)内共生体。其中5组的16S rRNA序列和土拉菌T01有较高的一致性。T01于1962年分离自我国西藏自治区当雄县1例土拉热患者[18],说明辽宁省长角血蜱携带的土拉菌与中国本土的土拉菌有最近的亲缘关系。T01的动物毒力实验研究表明[18],在鼠类和豚鼠腹膜感染此菌,半数致死量<5 CFU。基因分型研究显示[18],该菌株属于一个中间型别,即介于土拉菌holarctica亚种日本型和世界其他holarctica亚种之间。另外8组和17个弗朗西斯菌属(类)内共生体聚在一个节点值为80的分支上,说明辽宁省长角血蜱携带的弗朗西斯菌属(类)内共生体与其他国家某些革蜱、血蜱和硬蜱携带的内共生体有较近的亲缘关系,但不包括长角血蜱。
近年来,我国报道的蜱传疾病逐渐增多,严重危害人类和动物的健康,引起社会的广泛关注。研究我国不同地域不同蜱种携带的病原体,有助于了解不同地域、不同蜱种可能传播的病原谱,为我国卫生部门制定相应的卫生策略和措施提供基础资料。本研究发现辽宁省长角血蜱携带土拉菌,提醒当地疾控部门及临床医师和兽医工作者应注意土拉热对人类的威胁,做到早期诊断和治疗,从而防止土拉热的流行。
| [1] | Sonenshine DE. Biology of ticks[M]. New York: Oxford University Press, 1993: 2. |
| [2] | Dasch GA, Weiss E. The prokaryotes[M]. New York: Springer-Verlag, 1992: 3. |
| [3] | Hayes SF, Burgdorfer W. Insect endocyobiosis:morphology, physiology, genetics, evolution[M]. Boca Raton, Fla: CRC Press, 1989: 235-251. |
| [4] | Parola P. Tick-borne rickettsial diseases:emerging risks in Europe[J]. Comp Immunol Microbiol Infect Dis, 2004, 27(5) : 297–304 .DOI:10.1016/j.cimid.2004.03.006. |
| [5] | Beugnet F, Marie JL. Emerging arthropod-borne diseases of companion animals in Europe[J]. Vet Parasitol, 2009, 163(4) : 298–305 .DOI:10.1016/j.vetpar.2009.03.028. |
| [6] | 侯学霞, 刘义, 郝琴, 等. 天津市蓟县地区莱姆病螺旋体主要生物媒介的调查研究[J]. 中国预防医学杂志, 2008, 9(5): 358–359. |
| [7] | 吴海霞, 李志芳, 刘起勇, 等. 首次在长角血蜱中检测到汉赛巴尔通体[J]. 中国媒介生物学及控制杂志, 2015, 26(1): 16–18. |
| [8] | 宋锋林, 王静, 张晓龙, 等. 蜱类携带粒细胞无形体的核酸检测及核酸序列分析[J]. 中国国境卫生检疫杂志, 2011, 34(5): 348–350. |
| [9] | 冯帅, 吴含, 张力文, 等. 河北省西部山区蜱传斑点热群立克次体分子流行病学研究[J]. 中国媒介生物学及控制杂志, 2013, 24(4): 308–312. |
| [10] | 张丽娟, 张景山, 付秀萍, 等. 我国南方媒介蜱中首次检出黑龙江立克次体[J]. 传染病信息, 2006, 19(2): 65–67. |
| [11] | 刘娜, 董雪, 李欣, 等. 沈阳地区蜱携带新型布尼亚病毒的检测[J]. 疾病监测, 2014, 29(5): 395–398. |
| [12] | Forsman M, Henningson EW, Larsson E, et al. Francisella tularensis does not manifest virulence in viable but nonculturable state[J]. FEMS Microbiol Ecol, 2000, 31(3) : 217–224 .DOI:10.1111/fem.2000.31.issue-3. |
| [13] | Dergousoff SJ, Chilton NB. Association of different genetic types of Francisella-like organisms with the rocky mountain wood tick (Dermacentor andersoni) and the American dog tick (Dermacentor variabilis) in localities near their northern distributional limits[J]. Appl Environ Microbiol, 2012, 78(4) : 965–971 .DOI:10.1128/AEM.05762-11. |
| [14] | Yu PF, Niu QL, Liu ZJ, et al. Molecular epidemiological surveillance to assess emergence and re-emergence of tick-borne infections in tick samples from China evaluated by nested PCRs[J]. Acta Trop, 2016: 181–188 .DOI:10.1016/j.actatropica.2016.02.027. |
| [15] | Noda H, Munderloh UG, Kurtti TJ. Endosymbionts of ticks and their relationship to Wolbachia spp. and tick-borne pathogens of humans and animals[J]. Appl Environ Microbiol, 1997, 63(10) : 3926–3932 . |
| [16] | Nakao R, Abe T, Nijhof AM, et al. A novel approach, based on BLSOMs (Batch Learning Self-Organizing Maps), to the microbiome analysis of ticks[J]. ISME J, 2013, 7(5) : 1003–1015 .DOI:10.1038/ismej.2012.171. |
| [17] | Keim P, Johansson A, Wagner DM. Molecular epidemiology, evolution, and ecology of Francisella[J]. Ann N Y Acad Sci, 2007: 30–66 .DOI:10.1196/annals.1409.011. |
| [18] | Song L, Yu Y, Feng L, et al. Draft genome sequence of Francisella tularensis strain 410108 from Tibet, China[J]. Genome Announc, 2015, 3(6) : 1–2 . |
 2016, Vol. 27
2016, Vol. 27


