扩展功能
文章信息
- 郭秀霞, 杨培培, 程鹏, 王海防, 刘丽娟, 张崇星, 王怀位, 公茂庆
- GUO Xiu-xia, YANG Pei-pei, CHENG Peng, WANG Hai-fang, LIU Li-juan, ZHANG Chong-xing, WANG Huai-wei, GONG Mao-qing
- 淡色库蚊氨肽酶N基因在不同龄期幼虫的表达谱分析
- Expression profile of aminopeptidase N in different instars of Culex pipiens pallens larvae
- 中国媒介生物学及控制杂志, 2016, 27(5): 450-453
- Chin J Vector Biol & Control, 2016, 27(5): 450-453
- 10.11853/j.issn.1003.8280.2016.05.007
-
文章历史
- 收稿日期: 2016-06-16
- 网络出版时间: 2016-08-11
淡色库蚊(Culex pipiens pallens)是我国北方入室吸血骚扰的主要蚊种,是引起班氏丝虫病和流行性乙型脑炎(乙脑)的重要媒介,严重危害人类健康[1-2]。生物防治是蚊虫防治的主要方法,具有无污染、成本低、效果好等优点,受到广泛关注。以苏云金杆菌(Bacillus thuringiensis,Bt)以色列变种和球形芽孢杆菌(Bacillus sphaericus,Bs)为主的细菌制剂,是全球范围内普遍应用的有效的生物防治手段。氨肽酶N(APN)是位于昆虫中肠刷状缘膜囊泡(BBMV)上Bt Cry毒素的特异性受体,在Bt毒素作用于靶标害虫中的作用非常重要。Bt Cry毒素的杀虫活性以及昆虫产生Bt抗性的能力取决于APN与Bt Cry毒素间的结合能力[3]。本研究通过提取淡色库蚊幼虫的RNA,利用实时荧光定量PCR(qRT-PCR)克隆淡色库蚊APN基因的cDNA全长序列,以β-actin作为内参,对淡色库蚊不同龄期幼虫的APN进行相对定量分析,了解该基因的相对表达情况,为Bt毒素作用机制及高效实施蚊虫生物防治提供科学依据。
1 材料与方法 1.1 蚊虫样本淡色库蚊(敏感种群)来自山东省疾病预防控制中心(CDC),在实验室连续饲养,经传90余代,未接触任何杀虫剂。饲养条件为温度26~28 ℃,相对湿度75%~85%,室内光照14 H/D,用小白鼠饲喂进行产卵传代。
1.2 试剂RNA提取试剂盒购自QIAGEN公司;RT-PCR试剂盒、pMD19-T Vector试剂盒、大肠埃希菌(Escherichia coli)感受态细胞E. coli JM109、DNA分子质量标准(DL-2000、1 000 bp Ladder )、T4 DNA连接酶均购自TaKaRa公司;质粒小提试剂盒和凝胶回收试剂盒购于Axygen公司;SYBR Green PCR Master Mix试剂盒为美国Ambion公司生产;其他试剂均为国产分析纯。
1.3 方法 1.3.1 总RNA提取及淡色库蚊APN基因的克隆取单只淡色库蚊3龄期幼虫中肠放入无RNase的匀浆器中加入液氮进行充分研磨,根据RNA提取试剂盒的操作步骤提取总RNA。以Oligo(dT)15为反转录引物,在反转录酶的作用下催化第一链cDNA的合成。根据GenBank中收录的致倦库蚊(Cx. pipiens quinquefasciatus)APN核苷酸序列(XM001862270.1)设计引物,上游引物:5′-ATG ATG AGA AAT GGT CTC GC-3′;下游引物:5′-TTA TAA ATC GTC CGG ATC GTA C-3′。以第一链cDNA为模板进行PCR,扩增目的基因片段。采用50 μl反应体系:ddH2O 38.5 μl、 10×LA PCR Buffer 5 μl、10 mmol/L dNTP 1 μl 、模板 1 μl、LA Taq DNA聚合酶0.5 μl、上下游引物各2 μl。反应条件:94 ℃ 3 min;94 ℃ 30 s,55 ℃ 45 s,72 ℃ 1 min,30个循环;72 ℃ 5 min;4 ℃保存。扩增产物进行1%琼脂糖凝胶电泳。
1.3.2 基因测序及系统进化树构建用DNA片段纯化/回收试剂盒对目的DNA片段进行纯化,将纯化后的基因片段连接到pMD-19T simple Vector上,然后转化至大肠埃希菌感受态细胞E. coli JM109,并将转化菌涂布到含有氨苄西林的LB固体培养平板上,37 ℃培养过夜,挑取单菌落进行菌体PCR鉴定,阳性克隆摇菌培养并送Invitrogen公司测序。将测序结果在NCBI上进行Blast比对(http://www.ncbi.nlm.gov/blast/),搜集GenBank中收录的致倦库蚊、斯氏按蚊(Anopheles sinensis)、冈比亚按蚊(An. gambiae)和埃及伊蚊(Aedes aegypti)等APN的氨基酸序列,运用DNAman 6.0、ClustalX 1.81和Mega 4.0软件进行序列比对,绘制生物进化树。
1.3.3 qRT-PCR以淡色库蚊不同龄期幼虫cDNA为模板,以β-actin(GenBank登录号:AY100005.1)为内参进行qRT-PCR。应用Primer primier 5.0软件,设计CpAPN和β-actin特异性引物,引物如下:CpAPN Real-F:5′-ACC TGG ATT CTG ACC CGC T-3′;CpAPN Real-R:5′-CGA CAT TGA AGT TCC GAG ATA GT-3′; β-actin F:5′-AGC GTG AAC TGA CGG CTC TTG-3′;β-actin R:5′-ACT CGT CGT ACT CCT GCT TGG-3′。反应采用SYBR Green PCR Master Mix试剂盒,反应体系为20 μl。反应在ABI 7300 Real-time PCR仪上进行,每个实验设3次重复,每次使用独立提取的RNA及反转录cDNA模板。
1.4 统计学处理实验结果以(x±n)表示,相对表达量的计算采用2-ΔΔCt法,根据数据做柱形图。采用SPSS 13.0软件进行方差分析,LSD进行多重比较检验。P<0.05为差异有统计学意义。
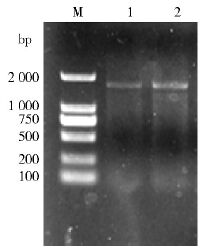
2 结果 2.1 淡色库蚊APN全长cDNA的克隆利用RNA提取试剂盒提取总RNA,采用两步法进行RT-PCR。在反转录酶的作用下将淡色库蚊RNA反转录为cDNA,然后以上述获得的cDNA为模板,利用设计合成的引物进行PCR,扩增淡色库蚊的APN基因。进行1%琼脂糖凝胶电泳观察PCR扩增情况。发现在2 000 bp下方有一条亮的DNA条带,与APN预期分子质量大小相符,见图 1。
|
| 注:M. DL2000 DNA Ladder Marker;1~2. 淡色库蚊APN PCR扩增产物。 图 1 PCR产物电泳结果 Figure 1 Electrophoretogram of PCR amplified CpAPN gene from Cx. pipiens pallens RNA |
| |
阳性克隆测序结果表明,淡色库蚊APN基因cDNA片段全长1 383 bp(含终止密码子),可编码的氨基酸为460个,预测蛋白质的分子质量为52.9×103,等电点为5.98。将测序结果与GenBank中收录的基因进行Blast同源序列比对,核苷酸序列与致倦库蚊(XM001862270.1)序列的同源性为100%。将获得的氨基酸序列与GenBank中收录的冈比亚按蚊(ACJ10211.1)、斯氏按蚊(KFB52687.1)、埃及伊蚊(AGT95897.1)和致倦库蚊(EDS31007.1、XP_001862305.1)等APN序列进行序列比对,绘制进化树并进行分析,发现这几类蚊种的APN属不同的分支,其中按蚊属为独立分支,与库蚊属、伊蚊属分支不同,淡色库蚊与致倦库蚊(XP_001862305.1)的同源性最高,与东方果实蝇(Bactrocera dorsalis,JAC39216.1)属同一分支,见图 2。

|
| 图 2 不同蚊种的APN生物进化分析 Figure 2 Phylogenetic analysis of APN from different mosquito species |
| |
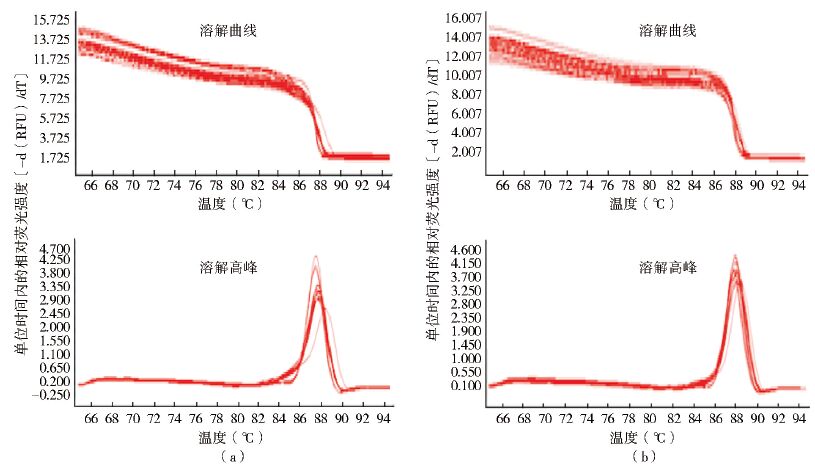
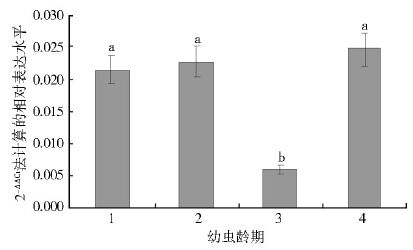
分别取淡色库蚊1~4龄期幼虫,利用RNA提取试剂盒提取总RNA,测定获得的RNA的A260/A280值和浓度。所提取的RNA质量较好,未被蛋白质或其他有机物污染,无明显降解,1.9<A260/A280<2.2,其浓度为280~1 400 ng/μl。对淡色库蚊幼虫在不同龄期的APN相对表达量进行qRT-PCR,发现目的基因和内参基因 β-actin的溶解曲线为单峰,反应状态良好(图 3)。利用2-ΔΔCt结果作图,显示该基因在各个龄期均有表达,其表达水平在不同龄期有所变化。4龄期的表达水平最高,其次为2龄和1龄期,3龄期的表达水平最低。1、2和4龄期表达量间差异无统计学意义(F=2.465,P=0.250),与3龄期间差异有统计学意义(F=49.191,P=0.000),表达量分别是3龄期幼虫的3.5、3.7和4.0倍,见图 4。
|
| 图 3 CpAPN基因(a)和 β-actin(b) qRT-PCR溶解曲线 Figure 3 Melting curves for qRT-PCR of CpAPN (a) and β-actin(b) |
| |
|
| 注: a. 淡色库蚊1、2、4龄期幼虫间比较,P>0.05; b. 与1、2、4龄期幼虫比较,P<0.05。 图 4 CpAPN基因在淡色库蚊不同龄期幼虫中的时空表达 Figure 4 Spatiotemporal expression of CpAPN gene in different instars of Cx. pipiens pallens larvae |
| |
Bt是目前应用较广泛的微生物杀虫剂,其作用机制主要是产生的毒素晶体蛋白与昆虫中肠的特异性受体相互作用,毒素渗入细胞膜,形成穿孔或离子通道而导致昆虫死亡[4]。位于昆虫中肠的Bt毒素受体有多种,包括APN、钙黏蛋白、糖脂类和碱性磷酸酶等,其中,APN是研究较多的Bt毒素受体[5],是一类锌离子依赖的水解蛋白酶,属于金属蛋白酶Ml家族中的gluzincins亚族,以同源二聚体的形式存在于细胞膜上,能从蛋白质多肽链的N末端降解中性或碱性氨基酸,从而激活体内一系列重要的生化反应过程。本实验以淡色库蚊为研究对象,对APN基因进行克隆鉴定,序列分析结果表明淡色库蚊APN基因编码序列全长约1 383 bp(含终止密码子),编码460个氨基酸。通过同源序列比对分析,核苷酸序列与致倦库蚊(XM001862270.1)序列的同源性为100%。几类蚊种的APN分属于不同的分支,其中按蚊属为独立分支,淡色库蚊与致倦库蚊的同源性最高,与东方果实蝇属于同一分支。许多昆虫包括不同种类蚊虫的APN已被克隆并登陆在GenBank中,根据昆虫APNs系统发育树可知APN同工酶分为多个类群[6-7],每类群的APN氨基酸序列均具有较高的同源性,不同物种的APNs可能具有更高的序列相似性,而同一物种的APNs可能具有较低的序列相似性[8]。目前对蚊虫APN基因功能的研究发现,不同的Cry毒素可结合到中肠刷状缘膜囊上不同的APN同工酶,且一种毒素并非只与一种APN结合。Chen等[9]通过实验成功分离了埃及伊蚊APN1,并确定了其与Cry11Aa具有高度的亲和性,而与Cry11Ba具有较低的亲和力。Rajagopal等[10]利用数据挖掘技术发现了3个糖基磷脂酰肌醇结合氨肽酶N(GPI-APN)亚型(APN2778、APN2783和 APN5808),为明确Cry4Ba 毒素受体,利用双链GPI-APN RNAs对埃及伊蚊幼虫进行基因敲除实验,结果表明这3种亚型可能均作为Cry4Ba受体发挥作用,其中APN2783的受体作用更强。Aroonkesorn等[11]进一步证明埃及伊蚊APN的2个亚型(AaeAPN2778和AaeAPN2783)为Cry4Ba 的功能受体。
为了解APN在淡色库蚊不同龄期幼虫中的表达情况,采用qRT-PCR技术对不同龄期幼虫中肠的APN进行检测,ΔΔCt法进行相对定量分析。通过RNA提取试剂盒提取蚊虫RNA,微量紫外分光光度仪检测其纯度并定量,显示1.9<A260/A280<2.2,RNA质量较好。采用SYBRGreenⅠ法qRT-PCR技术,对淡色库蚊不同龄期幼虫的APN表达情况进行分析,溶解曲线为单一峰图,为特异性扩增,通过对2-ΔΔCt结果分析发现,APN在淡色库蚊幼虫的不同龄期均有表达,2龄期幼虫的表达水平比1龄期略高,但龄期间的表达差异无统计学意义(F=0.467,P=0.514),3龄期幼虫的表达量最低,与1龄期和2龄期幼虫的差异有统计学意义(F=83.690,P=0.000),4龄期表达水平最高,为3龄期幼虫的4倍,差异有统计学意义(F=120.372,P=0.000),与1、2龄期幼虫间差异无统计学意义。APN是昆虫体内重要的消化食物的蛋白酶之一,也是Bt毒素特异性受体,有的昆虫在所有龄期均有较高的表达[12],有的在低龄期幼虫表达量较低,表达量随龄期的增长逐渐增加,到一定龄期后表达量有所下降[7],而淡色库蚊的表达方式与后者相符,说明不同龄期、不同昆虫APN基因的表达情况差异较大。由于APN是Bt毒素作用的特异性受体,了解APN在淡色库蚊不同龄期的表达水平,对有效实施蚊虫生物防治有重要意义。
| [1] | Gemperli A, Sogoba N, Fondjo E, et al. Mapping malaria transmission in West and Central Africa[J]. Trop Med Int Health, 2006, 1 (7) : 1032–1046 . |
| [2] | Onyango SA, Kitron U, Mungai P, et al. Monitoring malaria vector control interventions: effectiveness of five different adult mosquito sampling methods[J]. J Med Entomol, 2013, 50 (5) : 1140–1151 .DOI:10.1603/ME12206. |
| [3] | Bravo A, Likitvivatanavong S, Gill SS, et al. Bacillus thuringiensis: a story of a successful bioinsecticide[J]. Insect Biochem Mol Biol, 2011, 41 (7) : 423–431 .DOI:10.1016/j.ibmb.2011.02.006. |
| [4] | Vachon V, Laprade R, Schwartz JL. Current models of the mode of action of Bacillus thuringiensis insecticidal crystal proteins: a critical review[J]. J Invertebr Pathol, 2012, 111 (1) : 1–12 .DOI:10.1016/j.jip.2012.05.001. |
| [5] | Ren XL, Ma Y, Cui JJ, et al. RNA interference-mediated knockdown of three putative aminopeptidases N affects susceptibility of Spodoptera exigua larvae to Bacillus thuringiensis Cry1Ca[J]. J Insect Physiol, 2014 : 28–36 .DOI:10.1016/j.jinsphys.2014.06.002. |
| [6] | Pigott CR, Ellar DJ. Role of receptors in Bacillus thuringiensis Crystal toxin activity[J]. Microbiol Mol Biol Rev, 2007, 71 (2) : 255–281 .DOI:10.1128/MMBR.00034-06. |
| [7] | Crava CM, Bel Y, Lee SF, et al. Study of the aminopeptidase N gene family in the lepidopterans Ostrinia nubilalis (Hübner) and Bombyx mori (L.): sequences, mapping and expression[J]. Insect Biochem Mol Biol, 2010, 40 (7) : 506–515 .DOI:10.1016/j.ibmb.2010.04.010. |
| [8] | Denolf P, Hendrickx K, Van Damme J, et al. Cloning and characterization of Manduca sexta and Plutella xylostella midgut aminopeptidase N enzymes related to Bacillus thuringiensis toxin-binding proteins[J]. Eur J Biochem, 1997, 248 (3) : 748–761 .DOI:10.1111/ejb.1997.248.issue-3. |
| [9] | Chen JW, Aimanova KG, Pan SQ, et al. Identification and characterization of Aedes aegypti aminopeptidase N as a putative receptor of Bacillus thuringiensis Cry11A toxin[J]. Insect Biochem Mol Biol, 2009, 39 (10) : 688–696 .DOI:10.1016/j.ibmb.2009.08.003. |
| [10] | Rajagopal R, Agrawal N, Selvapandiyan A, et al. Recombinantly expressed isoenzymic aminopeptidases from Helicoverpa armigera (American cotton bollworm) midgut display differential interaction with closely related Bacillus thuringiensis insecticidal proteins[J]. Biochem J, 2003, 370 (3) : 971–978 .DOI:10.1042/bj20021741. |
| [11] | Aroonkesorn A, Pootanakit K, Katzenmeier G, et al. Two specific membrane-bound aminopeptidase N isoforms from Aedes aegypti larvae serve as functional receptors for the Bacillus thuringiensis Cry4Ba toxin implicating counterpart specificity[J]. Biochem Biophys Res Commun, 2015, 461 (2) : 300–306 .DOI:10.1016/j.bbrc.2015.04.026. |
| [12] | Angelucci C, Barrett-Wilt GA, Hunt DF, et al. Diversity of aminopeptidases, derived from four lepidopteran gene duplications, and polycalins expressed in the midgut of Helicoverpa armigera: identification of proteins binding the δ-endotoxin, Cry1Ac of Bacillus thuringiensis[J]. Insect Biochem Mol Biol, 2008, 38 (7) : 685–696 .DOI:10.1016/j.ibmb.2008.03.010. |
 2016, Vol. 27
2016, Vol. 27


