扩展功能
文章信息
- 魏亚梅, 韩占英, 张艳波, 韩旭, 蔡亚男, 许永刚, 齐顺祥, 李琦
- WEI Ya-mei, HAN Zhan-ying, ZHANG Yan-bo, HAN Xu, CAI Ya-nan, XU Yong-gang, QI Shun-xiang, LI Qi
- 河北省汉坦病毒的分离、复苏及分型
- The isolation, recovery and identification of Hantavirus in Hebei province
- 中国媒介生物学及控制杂志, 2016, 27(5): 447-449
- Chin J Vector Biol & Control, 2016, 27(5): 447-449
- 10.11853/j.issn.1003.8280.2016.05.006
-
文章历史
- 收稿日期: 2016-04-25
- 网络出版时间: 2016-08-11
肾综合征出血热(HFRS)呈世界性流行,目前已有30多个国家和地区发现HFRS病例,但主要分布于亚洲地区[1]。HFRS在我国分布于32个省(自治区、直辖市),年平均发病率为3/10万~4/10万,病死率为2%~3%,被国家列为重点防治传染病之一[2]。汉坦病毒(HV)包括30多种血清型/基因型,我国以汉城型(SEO)和汉滩型(HTN)为主。河北省为HFRS的高发地区,通过对疫区HV抗原阳性鼠肺标本进行病毒分离及分型鉴定,了解HV型别分布。
1 材料与方法 1.1 鼠肺标本及保存病毒株鼠肺标本由本室保存,经间接免疫荧光法(IFA)筛检HV抗原阳性标本。选取不同区域4份阳性标本(表 1),6株病毒由本室于1993年分离获得并保存于-80 ℃条件,见表 2。
异硫氰酸荧光素(FITC)标记的HV单克隆抗体,购自第四军医大学。MEM培养基、胎牛血清、L-谷氨酰胺、胰蛋白酶、二甲基亚砜(DMSO)均购自GIBCO公司;HFRS汉滩/汉城病毒核酸检测试剂盒(Real-time PCR)购自中山大学达安基因有限公司;GoTaq Colorless Master Mix试剂盒购自Promega公司;SuperScript Ⅲ Reverse Transcriptase cDNA合成试剂盒购自Invitrogen公司。
1.3 引物设计与合成引物序列来自2005年《全国肾综合征出血热监测方案》所颁布的序列,由上海生工生物工程股份有限公司合成。SEO-G2N1:5′-GTG GAC TCT TCT TCT CAT TAT T-3′;SEO-G2N2:5′-TGG GCA ATC TGG GGG GTT GCA TG-3′。
1.4 IFA检测利用IFA筛选阳性鼠肺标本。鼠肺标本经冷冻切片后,冷丙酮固定15 min;加入FITC标记的HV单克隆抗体,于37 ℃湿盒内温浴30 min;磷酸盐缓冲液(PBS)和蒸馏水冲洗后吹干,于荧光显微镜下筛选阳性鼠肺标本。与阴性对照相比,有明显亮绿色颗粒为阳性。该法用于病毒分离过程的病毒检测,接种阳性鼠肺悬液于Vero-E6细胞,在消化传代后制片。
1.5 病毒的分离与复苏阳性鼠肺标本经PBS漂洗3次后,制成10%的悬液。按每瓶(25 cm2方瓶)0.2 ml接种Vero-E6细胞,置37 ℃吸附1 h,加入维持液37 ℃培养;24 h后换液,然后按正常细胞培养的步骤培养;20~30 d后消化传代,同时IFA检查细胞感染程度。之后每隔2~3周传代1次,出现阳性后间隔1~2周传代1次,待感染细胞比例>75%时收获病毒,置-80 ℃冰箱保存。病毒的复苏按每瓶(25 cm2方瓶)0.8 ml病毒液接种Vero-E6细胞,其他步骤同病毒分离。
1.6 实时荧光PCR(Real-time PCR)扩增病毒感染>75%时,提取RNA。按照HFRS汉滩/汉城病毒核酸检测试剂盒(Real-time PCR法)扩增,具体反应条件按试剂盒说明书进行。
1.7 Real-time PCR扩增及序列分析按SuperScript Ⅲ Reverse Transcriptase cDNA试剂盒说明书合成cDNA第一链,反应体系为20 μl,然后按Promega公司的GoTaq Colorless Master Mix进行扩增。产物由上海生工生物工程股份有限公司进行序列测定。利用DNAStar软件对核苷酸序列进行分析。
2 结果 2.1 鼠肺标本检测以FITC标记的HV单克隆抗体检测鼠肺中的HV抗原。HV抗原阳性的鼠肺抗原片,在荧光显微镜下可见细胞质内黄绿色病毒特异性荧光颗粒均匀地分布于细胞核的周围,见图 1a。
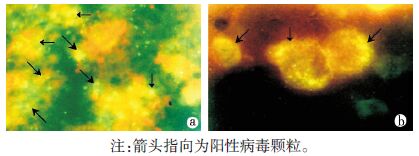
|
| 图 1 阳性鼠肺(a)及HV感染Vero-E6细胞(b)的IFA检测结果(×640) Figure 1 IFA results of HV positive rodents’ lung tissue(a) and Vero-E6 cells infected with HV(b)(×640) |
| |
阳性鼠肺标本的组织悬液接种至Vero-E6细胞3~4代后,IFA检测显示细胞内出现病毒特异性荧光颗粒,在感染的细胞中未引起致细胞病变效应(CPE),见图 1b。最终4份标本全部分离成功,分别命名为12HBB14、12HBB18、12HBC28和12HBC29,其中12HBB18来自东方田鼠,其他3株均来自褐家鼠,见表 3。
保存的病毒接种Vero-E6细胞1~2代后,经IFA检测细胞内出现较强的病毒特异性荧光颗粒,继续传代未发现在感染的细胞中引起CPE。最终6株病毒全部复苏成功。
2.4 HV的分型鉴定将10株病毒应用HFRS汉滩/汉城病毒核酸检测试剂盒(Real-time PCR法)进行分型鉴定,结果均属于SEOV。其中6株复苏毒株所获结果与李琦等[3]报道一致。
2.5 核苷酸序列分析将10株病毒株M片段进行测序并构建系统进化树,结果均为SEOV S3亚型,见图 2。

|
| 图 2 河北省HV病毒株核苷酸系统进化树 Figure 2 Phylogenetic trees for HV strains in Hebei province |
| |
以往的流行病学调查发现,华北地区HFRS疫区HV是以SEO型为主的混合型疫区。河北省HFRS疫区分布广泛,地形地貌复杂,生态环境多样,HFRS传播媒介主要是褐家鼠。曾有研究对分离自鼠肺的病毒株进行抗原分析,并对鼠肺和患者血清标本直接进行基因分型,均显示河北省HV以SEO型为主[4-6]。本研究通过对分离自不同疫区的HV进行分析,所有毒株均为SEO型,进一步说明河北省HV以SEO型为主,并广泛分布全省,为有针对性地采取预防和控制措施提供了科学依据。
病毒的分离鉴定对于病毒性传染性疾病的控制至关重要,全面系统地研究病毒株,可为研制疫苗提供方向。自1978年首次成功分离HV,多种细胞系和实验动物被用于HV的分离研究,其中Vero-E6细胞是目前分离和培养HV应用较多的一种细胞。HV分离较难,在感染细胞中不引起或引起轻微的CPE[7],尤其是SEOV,几乎不引起CPE,分离难度更大。本实验采用Vero-E6细胞分离河北省不同疫区的阳性鼠肺标本,最终4份标本全部分离成功,深入了解了河北省HV覆盖区域。同时也说明,方法得当并控制好条件,可提高SEOV的分离率。
本研究利用Vero-E6细胞成功地复苏了本室保存的6株病毒,其均为1993年分离获得并一直保存于-80 ℃冰箱,期间曾反复冻融(如冰箱停电或搬迁等原因),但未导致病毒失活。提示若条件得当HV毒株可在-80 ℃冰箱保存较长时间,但仍建议定期复苏为妥。
有研究认为HV与其原始宿主动物间存在共进化关系,即一个型别的HV往往只有一种原始宿主动物,为长期以来HV进化的主要模式,但同时也存在病毒与宿主动物不一致而产生“宿主溢出”现象[8-9]。本研究的病毒株为河北省东方田鼠中分离的SEOV,如按宿主动物和HV“一对一”的关系理论,推测我国田鼠亚科啮齿动物应同在欧洲和美洲携带肝肺综合征(hepatopulmonary syndrome,HPS)相关病毒,而本研究却发现其携带SEOV;本室曾发现野外黑线仓鼠也可携带SEOV[10]。国内也有报道仓鼠亚科宿主动物大仓鼠(Tscherskia triton)可携带HTNV[11],说明相同亚科的啮齿动物可携带不同型别HV,均充分证明了“宿主溢出”现象。但并不否认病毒与宿主动物共进化理论的主要地位。如能进一步对分离自东方田鼠的HV基因进行研究,从而可获得更多的病毒进化和遗传变异等信息,了解其更多的生物学特性。
| [1] | 张永振, 肖东楼, 王玉, 等. 中国肾综合征出血热流行趋势及其防制对策[J]. 中华流行病学杂志,2004,25 (6) :466–469. |
| [2] | Zhang YZ, Zou Y, Fu ZF, et al. Hantavirus infections in humans and animals,China[J]. Emerg Infect Dis, 2010, 16 (8) : 1195–1203 .DOI:10.3201/eid1608.090470. |
| [3] | 李琦, 张作儒, 赵鸿儒, 等. 河北省肾综合征出血热疫区血清学和分子生物学病原分型研究[J]. 中国人兽共患病杂志,1997,13 (6) :55–56. |
| [4] | 李琦, 魏亚梅, 韩占英, 等. 河北省人感染汉坦病毒G2片段基因分型及序列特征分析[J]. 中华实验和临床病毒学杂志,2008,22 (1) :15–17. |
| [5] | 黄晓霞, 李琦, 韩占英, 等. 河北省鼠携带汉坦病毒G2片段基因分型及序列特征分析[J]. 中华实验和临床病毒学杂志,2009,23 (3) :165–167. |
| [6] | 魏亚梅, 韩旭, 韩占英, 等. 河北省肾综合征出血热主要流行区鼠携带汉坦病毒基因序列分析[J]. 中国病毒病杂志,2013,3 (6) :435–438. |
| [7] | Lundkvist A, Cheng Y, Sjølander KB, et al. Cell culture adaptation of Puumala hantavirus changes the infectivity for its natural reservoir, Clethrionomys glareolus, and leads to accumulation of mutants with altered genomic RNA S segment[J]. J Virol, 1997, 71 (12) : 9515–9523 . |
| [8] | 靳铁治, 吴瑞, 陈海龙, 等. 西安市肾综合征出血热宿主动物调查及病原分析[J]. 中国媒介生物学及控制杂志,2015,26 (4) :379–382. |
| [9] | 刘师文, 徐刚, 龚甜, 等. 江西省鼠类携带汉坦病毒基因特征研究[J]. 中国媒介生物学及控制杂志,2015,26 (5) :475–479. |
| [10] | 李琦, 李伟, 张作儒, 等. 从黑线仓鼠肺中分离出流行性出血热家鼠型病毒[J]. 中国人兽共患病杂志,1995,11 (2) :59–60. |
| [11] | 张明霞, 张永振, 李琦, 等. 大仓鼠携带汉坦病毒全S、部分M核苷酸序列特征分析[J]. 苏州大学学报:医学版,2007,27 (3) :350–353. |
 2016, Vol. 27
2016, Vol. 27





