扩展功能
文章信息
- 王德全, 刘渠, 梁克峰, 周建明, 周俊立, 刘晓娜
- WANG De-quan, LIU Qu, LIANG Ke-feng, ZHOU Jian-ming, ZHOU Jun-li, LIU Xiao-na
- 新蚊媒病毒南定病毒的生物学特征研究
- Study on the biological characteristics of a new arbovirus: Nam Dinh virus
- 中国媒介生物学及控制杂志, 2016, 27(5): 443-446
- Chin J Vector Biol & Control, 2016, 27(5): 443-446
- 10.11853/j.issn.1003.8280.2016.05.005
-
文章历史
- 收稿日期: 2016-04-15
- 网络出版时间: 2016-08-11
2 深圳市龙岗区疾病预防控制中心, 广东 深圳 518172
2 Longgang District Center for Disease Control and Prevention of Shenzhen
自20世纪70年代以来,在全球范围内发现40余种新发传染病,如埃博拉出血热、尼帕病毒性脑炎、艾滋病、牛海绵状脑病、新型克雅氏病和严重急性呼吸综合征(SARS)等,严重威胁人类健康,成为全球重要的公共卫生问题[1]。未来国内外还可能出现和发现更多的新传染病,因其不确定性和难以预测而无法及时作出决策并采取特异性预防控制措施,严重影响社会稳定和经济发展。2013年在国内分离了1株新型蚊媒病毒——南定病毒(Nam Dinh virus,NDiV)[2],对NDiV的生物学特征、毒力和致病性情况进行了研究,现将结果报告如下。
1 材料与方法 1.1 病毒株、实验细胞和动物NDiV、呼吸道合胞病毒为本实验室保存,登革热病毒(DV1~4型)、流行性乙型脑炎(乙脑)病毒株由广州军区疾病预防控制中心(CDC)惠赠。白纹伊蚊(Aedes albopictus)卵细胞(C6/36)为本实验室保存。昆明小鼠(清洁级),4周孕龄,体重60~80 g,购自中山大学实验动物中心。
1.2 试剂和仪器5%~10%小牛血清MEM细胞培养基(4.7 g/L日本日水制药株式会社);High Pure Viral RNA Kit RNA提取试剂(Roche,德国);PrimeScript RT reagent Kit Perfect Real?time反转录试剂盒(TaKaRa,日本);SYBR Premix Ex TaqTMⅡKit实时荧光定量PCR试剂盒(TaKaRa,日本);琼脂糖凝胶电泳试剂(BIOWEST,西班牙);DNA Marker DL2000(TaKaRa);核酸染料GELVIEW(北京百泰克生物技术有限公司);DEPC处理水(TaKaRa)。
1.3 方法 1.3.1 毒力测定C6/36传代细胞长成单层,弃去培养液,加入NDiV原液吸附1 h后,弃去病毒液,用含有10%小牛血清的细胞生长液继续培养,与正常细胞对照,每日观察染毒细胞生长情况。待染毒细胞病变达“+++”时,将细胞培养上清液吸入离心管中,加入10%的小牛血清,调整NaHCO3的pH值为7.5,分装后-80 ℃保存。
病毒滴定采用C6/36细胞以1∶3比例传代,4 ml/孔接种6孔聚苯乙烯培养板,48 h左右待细胞长成致密单层后,以水解乳蛋白液∶牛血清∶NaHCO3=50∶1∶1的比例配制好病毒稀释液,以10倍梯度稀释病毒,即每管中加入病毒稀释液1.8 ml,吸取原液0.2 ml加入管中,弃吸管,换吸管轻轻吸打吹匀,吸取0.2 ml依次加入下一管。6孔培养板中加入10-3、10-4和10-5三个稀释度的病毒液,每稀释度加2孔、0.2 ml/孔,同时设空白对照孔。37 ℃、5%CO2细胞培养箱中吸附1 h,每隔20 min轻摇混匀。配好甲基纤维素覆盖物,以4 ml/孔加入6孔板中,37 ℃、5%CO2细胞培养箱中培养5 d。吸弃覆盖物,加入结晶紫染色液,染色30 min后流水冲净,观察并记录空斑数量。
将NDiV稀释成10-3、10-4和10-5浓度后,对3日龄小鼠进行脑内接种,每个稀释度接种10只小鼠,每只接种量为0.02 ml,以生理盐水注射小鼠为对照组,分别观察10 d,并逐日记录小鼠发病及死亡情况,接种3 d内死亡鼠为非特异死亡,计算半数致死量(LD50)。
1.3.2 免疫原性测定采用攻毒保护实验方法测定免疫原性,评价小鼠感染NDiV后病毒对机体的抗原性及机体对再感染的保护能力。参考预实验结果,NDiV的半数组织培养感染剂量(TCID50)效价为10-4,将活NDiV用PBS稀释成5×104 PFU/0.1ml,取10只3周龄雌性昆明小鼠,用0.1 ml活病毒稀释液一次性大腿肌肉注射,免疫4周后用NDiV进行攻毒保护实验,采用500×LD50病毒,0.1 ml/只,一次性注射于昆明小鼠腹腔,同时设PBS盐水注射组为对照。逐日测定和记录两组小鼠体重及状态,处死体重减轻>30%的小鼠,观察经免疫的小鼠攻毒后的发病和存活情况。
1.3.3 中和实验采用固定血清稀释病毒方法。用效价为1∶1 024的昆明小鼠灭活血清为中和抗体。C6/36细胞以1∶3比例在96孔板上传代,48 h左右待细胞长成致密单层后,加入NDiV的10-1、10-2、10-3和10-4浓度稀释液,每个稀释度分别接种4孔,100 μl/孔,同时将中和抗体进行1∶50稀释,100 μl/孔加入细胞板中,在37 ℃、5%CO2培养箱中孵育,使病毒与血清充分作用,1 h后弃去病毒液和血清,加入细胞维持液,培养7~9 d,逐日观察记录细胞病变情况。设牛血清对照组(10-1~10-4病毒稀释液+5%小牛血清培养基)及培养基对照组(10-1~10-4病毒稀释液+无血清培养基),在37 ℃、5%CO2孵箱中进行培养、观察,计算TCID50及中和指数。
1.3.4 病毒核酸检测采用实时荧光定量PCR方法检测C6/36细胞中NDiV核酸,验证培养细胞中NDiV存在情况及不同培养时间病毒拷贝量,所用引物和TaqMan-MGB 探针由上海基康生物技术有限公司合成[2]。
1.4 统计学分析采用SPSS 21.0软件对实验数据进行分析并利用Reed-Muench法计算LD50等指标。
2 结果 2.1 NDiV对细胞毒力的测定NDiV接种C6/36细胞后,第5天开始该细胞发生病变效应(CPE),第7天明显出现细胞固缩,单层细胞稀疏,第9天细胞与细胞之间空隙增大,偶有细胞空泡出现,细胞相互融合,部分细胞破裂,数量减少,随时间延后细胞逐渐脱落,空白对照生长正常,见图 1。病毒空斑滴定实验中,NDiV的10-3稀释液接种的细胞破坏明显,10-4稀释度存在明显空斑,病毒滴度为9.25×106 PFU/ml。

|
| 注:a、b、c. 实验组第5、7、9天;d、e、f. 对照组第5、7、9天。 图 1 不同培养时间实验细胞病变效应(红、黄滤光片观察,×40) Figure 1 The cytopathic effect of C6/36 cells in different cultured time(Red,yellow color filter ×40) |
| |
对3日龄乳鼠脑内接种10-3、10-4、10-5稀释度(每组10只)的病毒液,3 d后乳鼠分别死亡8、6和2只。NDiV的LD50为104.12/ml(95%CI=3.35~5.11)。 攻毒保护实验结果显示,未免疫的对照组10只小鼠在攻毒后第4天陆续出现精神沉郁、被毛凌乱和弓背等临床症状,体重开始明显下降,2只小鼠因在第7天体重减轻了30%,颈椎脱位处死。剩余8只小鼠分别在第8、9天因体重减轻了30%被处死,而免疫组小鼠攻毒后无发病症状出现。NDiV感染小鼠后,具有较强的免疫原性,且攻毒保护率较高。
小鼠经5×104 PFU/0.1 ml的NDiV免疫后,免疫组小鼠体重未明显下降,精神状态良好,存活率为100%,且无发病症状出现。而对照组10只小鼠在攻毒后第4天陆续出现精神沉郁、被毛凌乱、弓背,体重下降了30%以上。
细胞中和实验结果显示,空白对照的细胞均保持正常,实验组细胞受免疫血清保护,细胞生长基本正常,而无免疫血清保护的病毒对照组细胞均出现不同程度的病变。利用Reed-Muench方法计算,NDiV抗血清组的TCID50效价<10-1,对照组TCID50效价为10-3.5,中和指数>1 000(表 1),提示免疫血清对病毒具有较好的中和作用。

|
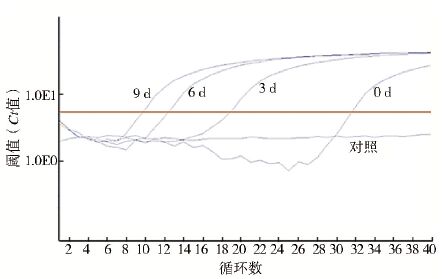
利用TaqMan-MGB Probe Real-time PCR对接种NDiV后0、3、6、9 d 的C6/36细胞培养瓶上清培养液进行病毒核酸检测。接种3 d后,病毒核酸呈明显阳性,随病毒接种后时间的增长,循环阈值(Ct)减少,4个阶段的Ct值结果均为0 d>3 d>6 d>9 d,见图 2。结合细胞病变情况,接种病毒第5天病毒拷贝量大大增加,细胞病变也十分明显,但接种病毒第9天后Ct值未明显减少,病毒增殖进入平稳期,见图 2。
|
| 图 2 不同接种时间NDiV核酸Ct值 Figure 2 Ct value of NDiV nucleic acid in different inoculation time |
| |
自20世纪以来,新发现的病原体超过50种,其中主要是病毒,大多为虫媒病毒,如西尼罗、沙拉热、裂谷热病毒[3],而我国新发传染病中发现近20余种,其中大多为虫媒传染病。2002年在越南南定省(Tinh Nam Dinh)急性病毒性脑炎综合征(DOC)患者脑脊液中首次分离到NDiV,可能是引起DOC的新型病原体之一[4]。2011年,Zirkel等[5]首次在科特迪瓦的原始森林、种植农场和居民区等多个地点采集多种库蚊(Culex)而发现该病毒。梁克峰等[2]于2013年首次从致倦库蚊(Cx. pipiens quinquefasciatus)中发现该病毒,用传代细胞培养和分离该病毒,并成功建立NDiV实时荧光定量PCR检测方法。
进化树分析结果显示NDiV为套式病毒目下的一个新成员,节肢动物套式病毒科病毒进化分支与冠状病毒科病毒进化分支同属一个共族节点,而该节点为罗尼病毒科下的进化分支,提示套式病毒间的遗传进化关系与病毒的基因组长度存在联系。鉴于多数套式病毒的宿主为哺乳类动物和有脊椎动物,特别是在DOC患者的脑脊液中分离到NDiV,提示该病毒可能感染人或哺乳类动物。传统的套式病毒主要感染哺乳动物、少数禽类及无脊椎动物(虾),但NDiV能否像新冠状病毒(SARS-CoV)引起人间疾病流行,值得重视和研究。
本研究结果表明,NDiV对C6/36传代细胞及小鼠具有一定致病性,接种第5天C6/36细胞即发生病变反应,第9天细胞数量减少并逐渐脱落。病毒在细胞中的增殖情况通过核酸检测得以验证,且病毒核酸量随病毒接种后时间的增长,Ct值依次减少,病毒拷贝量第5天明显增加,同时感染病毒的细胞也发生明显的CPE。动物实验表明,小鼠感染NDiV后,具有较强的免疫原性,机体产生的抗体对再感染的保护作用较强,免疫保护率较高。昆明小鼠腹腔注射NDiV后,所获得的免疫血清对NDiV具有较好的中和作用,中和指数>1 000,良好的免疫原性和中和作用十分利于将来NDiV疫苗的研究。
目前,国外关于NDiV的研究工作较少,主要是涉及病毒的分子结构,尚未有该病毒的致病性证据[6-8]。病毒的生物特性是其致病性和免疫原性的基础。NDiV免疫原性研究主要通过感染该病毒后,动物产生相关免疫物质及对再感染的抵抗力。该文研究了NDiV对白纹伊蚊卵细胞所致的CPE、小鼠的LD50,为探讨该病毒对人类可能的致病情况奠定了基础。
| [1] | Lindsey NP, Lehman JA, Staples JE, et al. West Nile virus and other arboviral diseases-United States,2013[J]. Morb Mortal Wkly Rep, 2014, 63 (24) : 521–526 . |
| [2] | 梁克峰, 刘渠, 王德全, 等. 实时荧光PCR检测Nam Dinh病毒方法的建立及初步应用[J]. 中国媒介生物学及控制杂志,2015,26 (5) :447–450. |
| [3] | Rosà R, Marini G, Bolzoni L, et al. Early warning of West Nile virus mosquito vector: climate and land use models successfully explain phenology and abundance of Culex pipiens mosquitoes in north-western Italy[J]. Parasit Vectors, 2014 : 269.DOI:10.1186/1756-3305-7-269. |
| [4] | Phan TN, Nguyen TT, Komichi M, et al. Emerging viruses associated with acute encephalitis syndrome in vietnam[C]//Scientific conference of the institut pasteur international network: emerging and re-emerging viral infections. Hanoi: National Institute of Hygiene and Epidemiology,2006. |
| [5] | Zirkel F, Kurth A, Quan PL, et al. An insect nidovirus emerging from a primary tropical rainforest[J]. MBio, 2011, 2 (3) : e00077–11 . |
| [6] | Thuy NT, Huy TQ, Nga PT, et al. A new nidovirus (Nam Dinh virus NDiV): its ultrastructural characterization in the C6/36 mosquito cell line[J]. Virology, 2013, 444 (1/2) : 337–342 . |
| [7] | Vasilakis N, Guzman H, Firth C, et al. Mesoniviruses are mosquito-specific viruses with extensive geographic distribution and host range[J]. Virol J, 2014 : 97.DOI:10.1186/1743-422X-11-97. |
| [8] | Zirkel F, Roth H, Kurth A, et al. Identification and characterization of genetically divergent members of the newly established family Mesoniviridae[J]. J Virol, 2013, 87 (11) : 6346–6358 .DOI:10.1128/JVI.00416-13. |
 2016, Vol. 27
2016, Vol. 27

