扩展功能
文章信息
- 张勤, 王晓梦, 岳巧云, 邱德义, 高洁, 张芳, 王凯
- ZHANG Qin, WANG Xiao-meng, YUE Qiao-yun, QIU De-yi, GAO Jie, ZHANG Fang, WANG Kai
- 河南口岸截获未知蝇种细胞色素C氧化酶亚基Ⅰ基因分析
- Analysis of cytochrome C oxidase subunitⅠgene of unknown and damaged fly species captured at Henan port
- 中国媒介生物学及控制杂志, 2016, 27(4): 354-357
- Chin J Vector Biol & Control, 2016, 27(4): 354-357
- 10.11853/j.issn.1003.8280.2016.04.010
-
文章历史
- 收稿日期: 2016-04-11
- 网络出版时间: 2016-06-03 12:09
2 中山出入境检验检疫局, 广东 中山 528403
2 Zhongshan Entry-Exit Inspection and Quarantine Bureau
蝇类在昆虫系统分类上隶属于双翅目(Diptera),共有几十个科,种类极其丰富,可携带上百种细菌、30多种原虫、20多种病毒及蠕虫和螨等,并传播多种疾病,如痢疾、伤寒、霍乱、脊髓灰质炎、结核和寄生虫病等,因此,蝇类是国境口岸监测的重要医学媒介生物。随着国际贸易往来的增加,蝇类及其携带的病原体随交通工具、货物和行李等传入我国的风险也在增加,准确鉴定和检测病原体是疾病预防和控制的核心。目前,对蝇类物种鉴定仍以形态学鉴定为主,但口岸截获的蝇类常肢体残缺,缺少重要的鉴别特征,对该类样本进行形态学鉴定十分困难。形态学鉴定的局限性使得分子鉴定开始受关注。
2003年加拿大生物学家Hebert等[1]提出以线粒体细胞色素C氧化酶亚基Ⅰ(COⅠ)基因为标准基因的DNA条形码技术(DNA barcoding),随后世界各地开展有关DNA条形码的研究,已成功应用于多个生物类群[2-5]。COⅠ基因较其他线粒体基因有更多的系统发育信号,其密码子第3位核苷酸表现出较高的碱基置换率,使得COⅠ基因在分子进化速率方面超出12S rDNA和16S rDNA 2倍之多[6-7]。
本研究以河南口岸截获的1只肢体残缺蝇类样本为对象,应用DNA条形码技术对其进行鉴定,再次证实DNA条形码技术作为传统形态学鉴定的有力补充,在口岸媒介生物鉴定中有广阔的应用前景。
1 材料与方法 1.1 样本2015年2月4日在郑州东站口岸截获的1只形态残缺蝇,对其拍照留档,见图 1。

|
| 图 1 河南口岸截获的形态残缺蝇 Figure 1 The damaged fly species captured at Henan port |
| |
DNA提取试剂盒购自Qiagen公司;PCR试剂盒、Premix TaqTM聚合酶、DNA Marker、琼脂糖和Gold View核酸染料、琼脂糖凝胶DNA回收试剂盒和pMD18-T载体均购自TaKaRa公司;其他试剂均为国产或进口分析纯。
1.3 方法 1.3.1 引物蝇类COⅠ基因扩增引物CO-Ⅰf:5′-GGT CAA CAA ATC ATA AAG ATA TTG G-3′和CO-Ⅰr:5′-TAA ACT TCA GGG TGA CCA AAA AAT CA-3′,由Invitrogen公司合成,目的片段为658 bp。
1.3.2 基因组DNA制备取蝇后足,按照Qiagen公司DNA提取试剂盒说明书提取基因组DNA,-20℃保存备用。
1.3.3 目的基因扩增按照PCR试剂说明书中推荐的引物浓度作为初始扩增条件,PCR反应体系(25μl):DNA模板2μl,10μmol/L CO-Ⅰf和CO-Ⅰr各1μl,Premix TaqTM聚合酶12.5μl,ddH2O 8.5μl,混匀后进行PCR反应。PCR反应条件:94℃3 min;94℃1 min,45℃1 min,72℃1.5 min,30个循环;72℃10min;1.5%琼脂糖凝胶电泳检测PCR产物后4℃保存。
1.3.4 序列测定和分析采用琼脂糖凝胶回收试剂盒将PCR产物进行纯化后连接pMD18-T载体,由Invitrogen公司进行序列测定。将截获样本的序列在BOLD Systems v3中进行比对,根据比对结果选取参考序列,使用Mega 6.0软件进行系统发育分析。
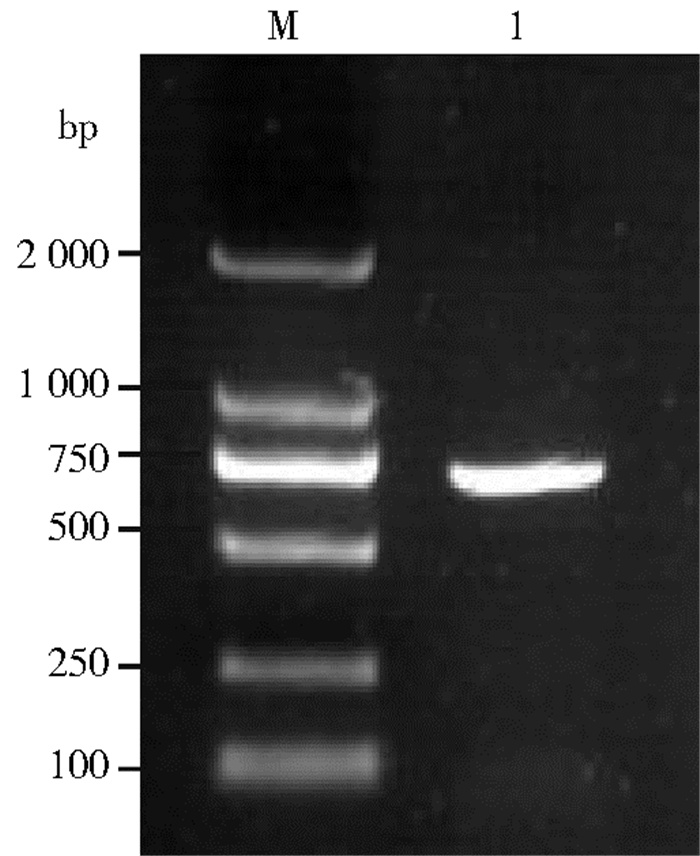
2 结果 2.1 COⅠ基因的扩增截获的1只形态残缺蝇经PCR扩增后凝胶电泳检测,可扩增出与目的基因大小一致的片段,见图 2,将扩增产物纯化回收后,连接至pMD18-T载体。
|
| 图 2 截获蝇样本COⅠ片段PCR扩增结果 Figure 2 PCR amplification of COⅠfragments of the captured fly species |
| |
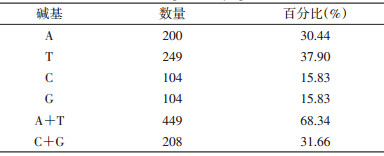
目的片段去除引物序列后大小为658 bp,将其上传至GenBank(登录号:KR296713)。使用DNAStar软件分析该序列的碱基,其碱基组成见表 1,(A+T)比例为68.34%,(C+G)比例为31.66%,与昆虫COⅠ碱基组成中(A+T)比例高于(C+G)的研究结果一致。
将截获样本COⅠ658 bp的片段在BOLD Systems v3中进行比对,结果显示该样本与BOLD Systems v3中绯颜裸金蝇(Chrysomya rufifacies)的同源性高达100%,故鉴定结果为绯颜裸金蝇。
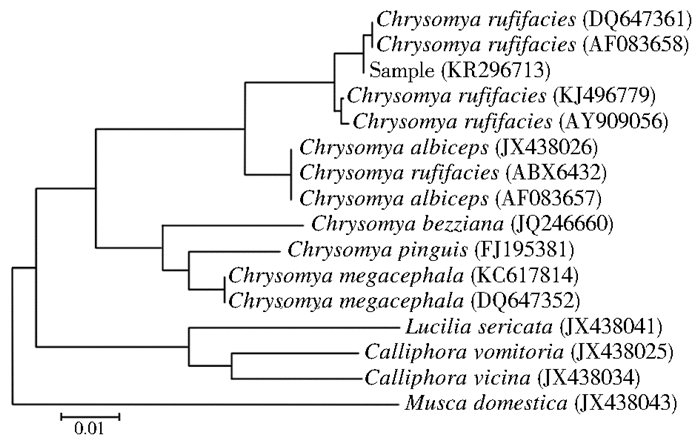
2.4 系统发育分析在GenBank中选取与样本COⅠ片段重叠的绯颜裸金蝇、金蝇属(Chrysomya)、绿蝇属(Luciliin)、丽蝇属(Calliphora)和家蝇属(Musca)的15条序列作为参考序列(表 2),对16条COⅠ片段658 bp的重叠区域以Kimura 2-parameter模式构建邻接法系统发育树(图 3),本研究检测的蝇样本与绯颜裸金蝇聚在同一分支,与DNA条形码比对结果一致。同属的白头裸金蝇(C. albiceps)与绯颜裸金蝇聚在同一分支中,表明两者亲缘关系较近。
|
| 图 3 基于COⅠ序列658 bp重叠片段构建的NJ系统发育树 Figure 3 Phylogenetic analysis of the captured fly species and reference fly species based on the sequences of COⅠ |
| |
DNA条形码技术的根本目的是准确快速地鉴定单个物种,因此只有进化速度适宜的DNA序列才可作为物种鉴定的条形码。线粒体基因的种内遗传距离通常<1%,极少数>2%,但种间差异最小为2%,最高达11.3%[8]。经大量研究结果证实COⅠ基因一段长为648 bp的区域可作为动物分类和鉴别的理想DNA条形码。
近几年来,COⅠ作为DNA条形码的标准基因已成功应用于鱼类、鸟类和昆虫等动物的分类鉴定,在我国国境口岸医学媒介生物鉴定中,DNA条形码技术也成为形态学鉴定的有效补充[9-17]。刘德星等[18]运用DNA条形码技术对入境截获的未知双翅目昆虫蛹进行了鉴定,证实其为大头金蝇;赵锋等[19]应用DNA条形码技术对常见的4科10属14种卫生蝇类进行鉴定,结果表明DNA条形码鉴定与形态学鉴定结果相一致;胡佳等[20]建立了适合螨、蚤、蜱、蝇的微量组织DNA条形码扩增技术;吴荣泉等[21]通过对福建省蝇类DNA条形码的分析,证实COⅠ基因可用于丽蝇科蝇种的鉴定,但铜绿蝇(L. cuprina)和丝光绿蝇在进化树上无法完全分开。DNA条形码技术克服了传统形态学鉴定要求形态完整和鉴定人员水平的局限,有效地缩短了医学媒介生物的鉴定时间,但DNA条形码技术仍处在发展阶段,在近缘种的分类鉴定上仍存在局限性,将DNA条形码鉴定和形态学鉴定结合的综合分类法(integrated taxonomy)可有效地提高鉴定效率和准确性[22]。
本研究中截获的蝇样本无法通过形态准确鉴定,采用DNA条形码技术扩增出样本COⅠ基因,经BOLD Systems v3比对证实该蝇样本为绯颜裸金蝇。绯颜裸金蝇隶属丽蝇科,金蝇属,外表具有蓝绿色金属光泽,法国昆虫学家Macquart于1842年首次对该蝇种进行命名。绯颜裸金蝇最初来源于澳大利亚,现在广泛分布于世界各地,可引起人和动物的蝇蛆病,为重要的法医昆虫,对于确定死亡时间有重要的指示作用。该蝇种具有温度依赖性,蝇卵在15℃时孵化成幼虫,40℃以上可成蛹,成虫长6~12 mm[23]。成蝇进行飞行活动的最低温度是13℃。绯颜裸金蝇生命周期较短,为190~598 h。目前绯颜裸金蝇已成功应用于骨髓炎的治疗[24]。绯颜裸金蝇与大头金蝇可通过前胸气门的颜色进行鉴别,绯颜裸金蝇前气门呈白色,大头金蝇则呈深棕色或深橘色。本研究构建的系统发育树中绯颜裸金蝇与白头裸金蝇聚在同一分支,表明两者亲缘关系较近。绯颜裸金蝇与白头裸金蝇有相似的形态特征和构造,但部分白头裸金蝇有翅痣,而绯颜裸金蝇没有。此外,两者的幼虫难以辨别,因此,一些分类学家认为绯颜裸金蝇与白头裸金蝇为同一蝇种,但目前关于两者是否为同一蝇种尚无定论。
| [1] | Hebert PDN, Cywinska A, Ball SL, et al. Biological identifications through DNA barcodes[J]. Proc R Soc Lond B Biol Sci, 2003, 270 (1512) : 313–321 .DOI:10.1098/rspb.2002.2218. |
| [2] | Savolainen V, Cowan RS, Vogler AP, et al. Towards writing the encyclopaedia of life:an introduction to DNA barcoding[J]. Philos Trans R Soc Lond B Biol Sci, 2005, 360 (1462) : 1805–1811 .DOI:10.1098/rstb.2005.1730. |
| [3] | Ward RD, Zemlak TS, Innes BH, et al. DNA barcoding Australia's fish species[J]. Philos Trans R Soc Lond B Biol Sci, 2005, 360 (1462) : 1847–1857 .DOI:10.1098/rstb.2005.1716. |
| [4] | Smith MA, Fisher BL, Hebert PDN. DNA barcoding for effective biodiversity assessment of a hyperdiverse arthropod group:the ants of Madagascar[J]. Philos Trans R Soc Lond B Biol Sci, 2005, 360 (1462) : 1825–1834 .DOI:10.1098/rstb.2005.1714. |
| [5] | Hebert PDN, Stoeckle MY, Zemlak TS, et al. Identification of birds through DNA barcodes[J]. PLoS Biol, 2004, 2 (10) : e312.DOI:10.1371/journal.pbio.0020312. |
| [6] | Frézal L, Leblois R. Four years of DNA barcoding:current advances and prospects[J]. Infect Genet Evol, 2008, 8 (5) : 727–736 .DOI:10.1016/j.meegid.2008.05.005. |
| [7] | Pereira HM, Leadley PW, Proença V, et al. Scenarios for global biodiversity in the 21st century[J]. Science, 2010, 330 (6010) : 1496–1501 .DOI:10.1126/science.1196624. |
| [8] | Hebert PDN, Ratnasingham S, de Waard JR. Barcoding animal life:cytochrome c oxidase subunitⅠdivergences among closely related species[J]. Proc R Soc Lond B Biol Sci, 2003, 270 (Suppl 1) : S96–S99 . |
| [9] | 吴薇. DNA条码技术在医学媒介生物鉴定中的应用前景展望[J]. 畜牧与饲料科学,2012,33 (1) :22–24. |
| [10] | 岳巧云, 邱德义, 胡佳, 等. DNA条形码:医学媒介生物快速准确鉴定的利器[J]. 检验检疫学刊,2013,23 (5) :60–63. |
| [11] | 王颖, 方绍庆, 刘明杰, 等. DNA条形码技术在媒介蝇类分子鉴定中的应用[J]. 口岸卫生控制,2013,18 (3) :55–58. |
| [12] | 陈春生, 张晓龙, 张雪莲, 等. 基于COⅠ基因序列的DNA条形码在中尼边境鼠类物种鉴定中的应用[J]. 西南国防医药,2012,22 (1) :22–24. |
| [13] | 谭玲, 何建伟, 王志杰, 等. DNA条形码在国境卫生检疫中的应用[J]. 中国国境卫生检疫杂志,2009,32 (5) :425–431. |
| [14] | 方义亮, 张建庆, 肖武, 等. DNA条形码技术在麻蝇亚科鉴定中的应用[J]. 中国人兽共患病学报,2015,31 (6) :569–573. |
| [15] | Yue QY, Wu KL, Qiu DY, et al. A formal re-description of the cockroach Hebardina concinna anchored on DNA barcodes confirms wing polymorphism and identifies morphological characters for field identification[J]. PLoS One, 2014, 9 (9) : e106789.DOI:10.1371/journal.pone.0106789. |
| [16] | 岳巧云, 邱德义, 黄艺文, 等. DNA条形码技术在未知昆虫幼虫种类鉴定中的应用[J]. 中国卫生检验杂志,2011,21 (3) :615–617. |
| [17] | 魏晓雅, 邱德义, 岳巧云, 等. 应用DNA条形码技术鉴定口岸截获的国内未见分布蚊种[J]. 检验检疫学刊,2014,24 (6) :46–49. |
| [18] | 刘德星, 聂维忠, 邱德义, 等. 应用DNA条形码技术快速鉴定入境船舶上截获的昆虫蛹[J]. 检验检疫学刊,2014,24 (5) :53–57. |
| [19] | 赵锋, 谭玲, 陈海, 等. 成都机场口岸常见媒介蝇类的分子鉴定[J]. 旅行医学科学,2011,17 (3) :51–55. |
| [20] | 胡佳, 岳巧云, 邱德义, 等. 医学媒介生物微量组织直接扩增DNA条形码序列方法的研究[J]. 中国媒介生物学及控制杂志,2014,25 (4) :297–300. |
| [21] | 吴荣泉, 张建庆, 方义亮, 等. DNA条形码技术在福建省蝇类鉴定中的应用[J]. 中国媒介生物学及控制杂志,2014,25 (6) :514–517. |
| [22] | Bergsten J, Brilmyer G, Crampton-Platt A, et al. Sympatry and colour variation disguised well-differentiated sister species: Suphrodytes revised with integrative taxonomy including 5 kbp of housekeeping genes(Coleoptera:Dytiscidae)[J]. DNA Bar, 2012 : 1–18 .DOI:10.2478/dna-2012-0001. |
| [23] | Whitworth T. Keys to the genera and species of blow flies (Diptera:Calliphoridae)of America North of Mexico[J]. Proc Entomol Soc Wash, 2006, 108 (3) : 689–725 . |
| [24] | Bram RA, George JE. Introduction of nonindigenous arthropod pests of animals[J]. J Med Entomol, 2000, 37 (1) : 1–8 .DOI:10.1603/0022-2585-37.1.1. |
 2016, Vol. 27
2016, Vol. 27