扩展功能
文章信息
- 王月, 陈红, 李沛丽, 刘英, 马青, 周敬祝, 余春, 黄艳, 唐光鹏, 王定明, 李世军
- WANG Yue, CHEN Hong, LI Pei-li, LIU Ying, MA Qing, ZHOU Jing-zhu, YU Chun, HUANG Yan, TANG Guang-peng, WANG Ding-ming, LI Shi-jun
- 贵州省一起人间布鲁氏菌病疫情高危人群调查及分离菌遗传特征分析
- Investigation and genetic characteristic analysis of Brucella strain isolated from high-risk population in a human Brucellosis epidemic in Guizhou province
- 中国媒介生物学及控制杂志, 2016, 27(4): 345-349
- Chin J Vector Biol & Control, 2016, 27(4): 345-349
- 10.11853/j.issn.1003.8280.2016.04.008
-
文章历史
- 收稿日期: 2016-02-25
- 网络出版时间: 2016-06-03 12:09
2 贵阳市动物疫病预防控制中心, 贵阳 550081
2 Guiyang Center for Animal Disease Control and Prevention
布鲁氏菌病(布病)是由布鲁氏菌属(Brucella)细菌侵入机体引起世界性、多宿主感染的人兽共患病[1],其历史悠久,分布广泛。贵州省于2010和2011年分别首次从山羊和患者中分离出羊种布鲁氏菌,证实了布病存在于人、畜[2-3],随后贵州省布病报告病例迅速上升,2014年报告新发病例61例,防控形势非常严峻。本研究对贵州省威宁县一起人间布病疫情进行分子流行病学调查研究,为确定疫情及疫情的防控提供科学依据。
1 材料与方法 1.1 实验试剂布病虎红平板和试管凝集试验试剂由中国疾病预防控制中心(CDC)传染病预防控制所提供,双相血培养瓶购自贝瑞特公司,进口布鲁氏菌肉汤(BD公司,货号:211088)和布鲁氏菌琼脂(BD公司,货号:211086)成品培养基按照说明书配制。冻干布鲁氏菌阳性血清、冻干布鲁氏菌单项特异性血清(A、M和R)、布鲁氏菌特异噬菌体均由中国CDC传染病预防控制所提供。PCR引物由宝生物工程(大连)有限公司合成,实验菌株为分离自一起疫情中布鲁氏菌抗体阳性患者血液的布鲁氏菌疑似菌株(BR2014007),阳性对照菌株为实验室保存的布鲁氏菌菌株,PCR检测对照菌株为疫苗株A19(牛种)、M5(羊种)和S2(猪种),购自兰州生物制品研究所。PCR引物由北京天一辉远生物科技有限公司合成,PCR相关试剂购自宝生物工程(大连)有限公司。
1.2 疫情资料1例患者,来自贵州省威宁县草海镇吕家河村九林组,于2014年2月19日开始出现发热、多汗、胸闷症状,在当地卫生室进行治疗未见好转,3月30日至威宁县人民医院以急性支气管肺炎住院治疗仍未好转,4月6日转至六盘水市人民医院以双肺结核住院治疗18 d,仍低热不退,无明显好转,4月25日转入云南省第一人民医院住院治疗,分别于4月28日、5月4日两次血培养,结果为马尔他布鲁氏菌(B. melitensis)阳性,5月4日转入感染科,以头孢西丁钠、左氧氟沙星、四环素、吲哚美辛等药物治疗,5月5日体温开始下降,至5月8日体温正常,5月9日出院,患者出院后按照医嘱连续服药6周。2014年5月5日贵州省CDC接到疫情报告后与威宁县CDC组织人员前往昆明市及患者所在地进行现场流行病学调查及处置,并对患者居住地的43名高危人群采集血液进行布病抗体检测,对阳性患者进行布鲁氏菌分离鉴定。
1.3 抗体检测采集43名高危人群血液并分离血清,采用虎红平板和试管凝集试验进行抗体检测[4],同时采用虎红平板试验检测来自于该村养羊住户的302只羊血液的布鲁氏菌抗体水平[4]。
1.4 细菌分离培养无菌抽取患者及抗体阳性全血接种于双相血培养瓶,置5% CO2培养箱37℃培养,期间每隔12 h观察有无菌落生长并将培养瓶倾斜一次使液相培养基与固相培养基充分接触后继续培养观察[4]。
1.5 传统方法鉴定布鲁氏菌种/型观察菌落生长时间、特征、菌体染色形态、CO2需要、H2S产生、硫堇、碱性复红染料抑菌试验、单相特异性血清(A、M和R)凝集试验、布鲁氏菌噬菌体裂解试验(Tb、BK2和Wb)鉴定布鲁氏菌种/型[4]。
1.6 DNA提取挑取布鲁氏菌可疑菌落接种于布鲁氏菌琼脂平板培养48 h后采用水煮法提取细菌核酸。
1.7 PCR检测采用布鲁氏菌属特异性基因BCSP31作为定属基因,按照文献[2-3]提供的B4和B5引物序列和参数进行扩增,应用文献[3, 5]提供的以布鲁氏菌属IS711插入序列为基础建立的AMOS-PCR鉴别布鲁氏菌种/型,扩增过程按文献[3, 5]的操作程序进行。
1.8 多位点可变数目串联重复序列分析(MLVA-16)采用文献[6]提供的以布鲁氏菌16个重复序列位点引物及PCR扩展参数进行扩增,委托北京天一辉远生物科技有限公司进行纯化和双向序列测定,将所测序列利用DNAStar软件进行拼接得到完整序列,在完整序列上标记出上下游引物序列(PCR和测序为相同引物序列),去除引物两端多余序列得到该位点的序列长度,根据文献[6-8]报道的布鲁氏菌MLVA-16各位点重复单元长度和重复数目换算表计算出重复序列的重复数目。从Brucella MLVA数据库(http://mlva.u-psud.fr)下载布鲁氏菌各种型菌株MLVA-16数据,采用NTsys 2.10e软件将本次所测菌株GZZA的MLVA-16各位点数据与数据库下载的各种型菌株的MLVA-16数据进行聚类分析。
1.9 多位点序列分型(MLST)分析按照文献[9-10]提供的7个管家基因、1个外膜蛋白基因及1个基因间区序列及PCR扩展参数进行扩增,委托北京天一辉远生物科技有限公司进行纯化和双向序列测定,将所测序列采用DNAStar软件进行拼接得到完整序列,将测定序列分别与文献[9-10]提供的布鲁氏菌相应基因的等位基因型序列进行比较获得各等位基因号,如为新的序列则定义新的等位基因号,将9个位点组成的等位基因号组合与文献提供的数据进行比较获得ST型,如有新的组合则定义为一个新的ST型。
2 结果 2.1 抗体检测情况43名高危人群中有6名血液(编号为ZXC、ZXJ、SQQ、HHP、HDK、HXC)经虎红平板凝集试验检测结果为阳性,进一步试管凝集试验显示6名布鲁氏菌抗体阳性,效价为1:100~1:800,见表 1。该村养羊住户的302份羊血液通过虎红平板试验检测,阳性64份,阳性率为21.19%。
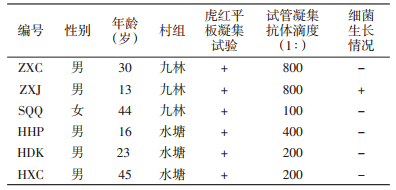
|
6份布鲁氏菌抗体阳性中编号为ZXJ的培养瓶,在48 h后长出可疑菌落(表 1)。菌落大小约0.5 mm、圆形、边缘整齐、呈露滴状、折光明亮,表面光滑湿润、稍隆起样菌落。转接布鲁氏菌琼脂平板,对菌落进行革兰染色镜检,结果为革兰阴性短小杆菌,多为单个,少数双或链状排列。
2.3 常规方法鉴定布鲁氏菌采用布鲁氏菌单相特异性血清A、M和R与可疑菌落进行凝集试验,均与A和M血清凝集,不产生H2S,硫堇和碱性复红染料培养基中均能生长,不被噬菌体Tb、Wb裂解,可被噬菌体BK2裂解,见表 2。
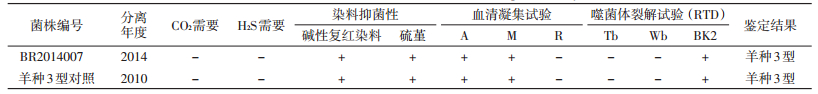
|
利用煮沸法提取疑似菌株核酸,用羊种3型布鲁氏菌作阳性对照,无菌水作阴性对照,利用BCSP31-PCR扩增,产物经1.5%琼脂糖凝胶电泳检测,发现分离菌及阳性对照均出现分子质量为223 bp的特异性条带,而阴性及空白对照均无条带出现,见图 1。

|
| 注:M.标准分子质量;1.菌株BR2014007;2~3.阳性对照1、2;4~6.阴性对照;7~9.疫苗株A19、M5、S2;10.空白对照。 图 1 布鲁氏菌BR2014007株BCSP31-PCR结果 Figure 1 The BCSP31-PCR results of Brucella BR2014007 |
| |
AMOS-PCR对疑似菌株和阳性菌株核酸进行扩增,产物经1.0%琼脂糖凝胶电泳检测,结果显示本次分离菌株及阳性对照均出现分子质量为731 bp的特异性条带,而阴性及空白对照均无条带出现,见图 2。
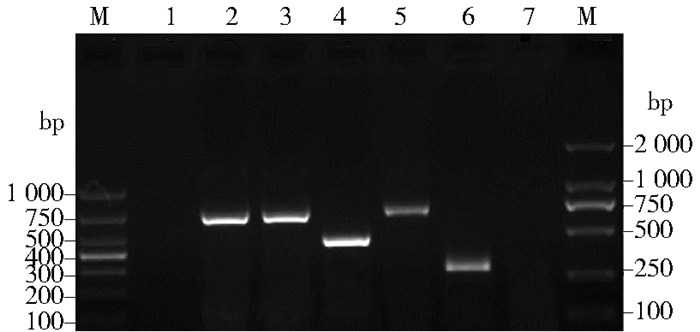
|
| 图 2 分离自布鲁氏菌抗体阳性患者的菌株AMOS-PCR结果 Figure 2 The AMOS-PCR results of Brucella isolated from antibody positive patients |
| |
采用MLVA-16的16个重复序列位点引物序列对疑似菌株BR2014007核酸进行PCR扩增后,采用2.0%琼脂糖凝胶电泳均出现清晰条带(图 3),将扩增产物经测序拼接后标记引物序列位置并去除多余序列后获得各位点的序列长度,根据重复单元长度计算bruce06、08、11、12、42、43、45、55、04、07、09、16、18、19、21和30位点的重复数目依次为1、5、3、13、3、2、3、2、6、4、8、4、4、23、8和6(图 4),将各位点重复序列重复数与MLVA数据库(http://mlva.u-psud.fr)收录的布鲁氏菌各种型菌株MLVA-16数据采用NTsys 2.10e软件进行聚类分析,获得疑似菌株和数据库收录菌株MLVA聚类图,显示本次分离菌株与羊种生物3型布鲁氏菌聚类关系最近,但在bruce04、07、09、16、19和30位点存在重复数目差异(图 4)。

|
| 注:M.标准分子质量;1~16. bruce06、08、11、12、42、43、45、55、04、07、09、16、18、19、21、30位点。 图 3 来源于布鲁氏菌抗体阳性患者菌株MLVA-16各重复位点PCR检测结果 Figure 3 The MLVA-16 results of Brucella antibody positive patients |
| |
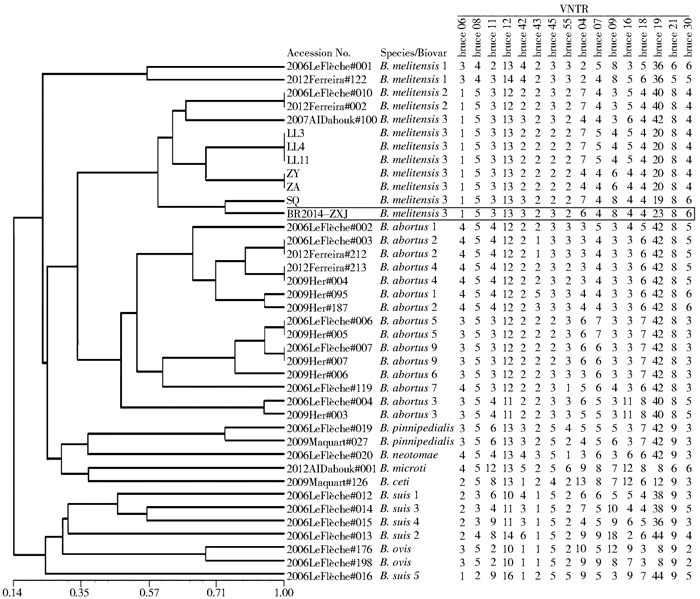
|
| 图 4 布鲁氏菌抗体阳性患者来源菌株与布鲁氏菌各种型菌株MLVA-16聚类分析 Figure 4 Analysis of Brucella isolates from Brucella antibody positive patients and various biotypes by MLVA-16 clustering |
| |
MLST分析显示,2株布鲁氏菌dnaK、gyrB、trpE、aroA、cobQ、gap、glk、omp25及int?hyp位点的等位基因序列号分别为3、2、3、2、1、5、3、8和2,菌株等位基因位点序列型别与文献[9-10]报道的ST8型各等位基因型相同。
3 讨论布病严重危害人类健康,阻碍畜牧业及相关产业健康发展。2014年底,贵州省疫情已覆盖贵阳、黔南、黔东南、铜仁、遵义、黔西南、六盘水、安顺和毕节9个市及贵安新区。
布鲁氏菌产生多种生物型可能与病原菌为适应不同宿主而发生遗传变异有关。因此,了解病原体的遗传特征对有效控制布病至关重要。通过MLVA-16分析显示,本次分离的布鲁氏菌与MLVA数据库(http://mlva.u-psud.fr)收录的羊种生物3型布鲁氏菌聚类关系较近,其中与2011年分离自贵州省石阡县患者的羊种3型菌株SQ的聚类关系最近,但在bruce04、07、09、16、19和30位点存在重复数目差异(图 4),提示分离菌株的遗传特征符合羊种生物3型布鲁氏菌,但是其遗传特征与数据库收录菌株有差异,MLVA-16所揭示的菌株间部分位点存在重复数目差异可能因不同地域来源菌株之间存在的遗传变异所致。MLST分析结果显示该菌株为ST8型,与周海艳等[10]报道的ST8型为我国布鲁氏菌较为普遍的ST型相同,提示本次疫情病原菌型与全国疫情基本一致。
本次疫情的高危人群无布病临床症状,6名抗体阳性,1例分离出布鲁氏菌,根据《布鲁氏菌病诊断标准》[11]判定6名为布鲁氏菌隐性感染者,抑或是感染者通过感染获得免疫力而无临床症状。当地疾病预防控制部门已对感染者采取相应的预防措施,并联合畜牧部门对抗体阳性羊只进行捕杀及相应处置。通过调查及时发现感染者及布病疫畜,避免了转为慢性患者的可能,及时控制了传染源。此外,布病患者辗转就医,提示当地卫生及医生对布病了解较少,因此,在布病新发地应加强临床医生的培训及居民的健康教育,提高布病防控意识以保证患者及时确诊,减轻患者负担和防止疫情扩散。
本次采用描述性流行病学调查方法对疫情进行调查,该起疫情中患者曾协助给羊只治疗,高危人群所在村组有5户自2013年入冬以来所饲养羊有过流产及发病状况,主要为发热、腹胀、伸腰,从未开展过牲畜检疫和畜间疫苗预防接种。高危人群中1户为羊只贩卖户,2013年曾从山东省贩回羊只进行贩卖,截至疫情发生时家中饲养羊37只,采样27只进行血液检测,阳性25只,提示可能为该疫情的输入传染源。部分村民从本县其他乡镇购买羊只,羊种有本地山羊、波尔山羊,也有外地人员贩卖,具体来源地不详,该组饲养的羊只未贩卖至外乡(镇),均为放养和圈养相结合,混放时间较多,配种均为自家羊群自然配种。综合判定该起疫情为与羊只接触而被感染。故引进外地牲畜时应加强检验检疫。当地畜牧兽医部门应加强监测,及时控制疫情,淘汰疫畜,防止疫情扩散,保护当地居民健康及畜牧业发展。
志谢: 威宁市CDC协助进行现场流行病学调查及标本采集,特此志谢| [1] | 尚德秋. 布鲁氏菌病再度肆虐及其原因[J]. 中国地方病防治杂志,2001,16 (1) :29–34. |
| [2] | 李世军, 王月, 陈红, 等. 贵州省首次从山羊分离到布鲁氏菌及其种型鉴定[J]. 中国人兽共患病学报,2011,27 (6) :515–518. |
| [3] | 李世军, 王月, 王定明, 等. 贵州省首例人间布鲁氏菌病病例的病原学诊断与分析[J]. 中国地方病学杂志,2012,31 (5) :69–71. |
| [4] | 卫生部疾病预防控制局. 布鲁氏菌病防治手册[M]. 北京: 人民出版社, 2008 : 17 -29. |
| [5] | 姜海, 崔步云, 赵鸿雁. AMOS-PCR对布鲁氏菌种型鉴定的应用[J]. 中国人兽共患病学报,2009,25 (2) :107–109. |
| [6] | Jiang H, Fan MY, Chen JD, et al. MLVA genotyping of Chinese human Brucella melitensis biovar 1, 2 and 3 isolates[J]. BMC Microbiol, 2011 : 256.DOI:10.1186/1471-2180-11-256. |
| [7] | 邓艳琴, 王加熊, 林代华. 福建省布鲁氏菌分离株的分子生物学鉴定[J]. 中国人兽共患病学报,2009,25 (7) :636–639. |
| [8] | 李世军, 王月, 王定明, 等. 贵州省一起人间布鲁氏菌病疫情的菌株鉴定及遗传特征研究[J]. 中华流行病学杂志,2013,34 (7) :717–720. |
| [9] | Whatmore AM, Perrett LL, MacMillan AP. Characterisation of the genetic diversity of Brucella by multilocus sequencing[J]. BMC Microbio, 2007 : 34.DOI:10.1186/1471-2180-7-34. |
| [10] | 周海艳, 陈燕芬, 崔步云, 等. 我国羊种3型布鲁氏菌的多位点序列分型研究[J]. 中国人兽共患病学报,2011,27 (5) :371–375. |
| [11] | 中华人民共和国卫生部. WS 269-2007布鲁氏菌病诊断标准[S].北京:人民卫生出版社, 2007. |
 2016, Vol. 27
2016, Vol. 27


