扩展功能
文章信息
- 许磊, 李贵昌, 司晓艳, 方喜业, 刘起勇
- XU Lei, LI Gui-chang, SI Xiao-yan, FANG Xi-ye, LIU Qi-yong
- 长爪沙鼠鼠疫自然疫源地气候对鼠疫流行影响的非线性效应
- Nonlinear effects of climate driven plague in Meriones unguiculatus natural foci in Inner Mongolia
- 中国媒介生物学及控制杂志, 2016, 27(4): 321-325
- Chin J Vector Biol & Control, 2016, 27(4): 321-325
- 10.11853/j.issn.1003.8280.2016.04.002
-
文章历史
- 收稿日期: 2016-05-05
- 网络出版时间: 2016-06-03 12:10
2 内蒙古地方病防治研究中心, 呼和浩特 010020;
3 中国医学科学院实验动物研究所, 协和医学院比较医学研究中心, 北京 100021
2 Inner Mongolia Center for Endemic Disease Control and Research;
3 Institute of Laboratory Animal Sciences of Chinese Academy of Medical Sciences, Compared Medical Research Center of Peking Union Medical College
目前已有大量关于不同鼠疫自然疫源地气候因子对鼠疫时空动态的研究[1-5]。Parmenter等[6]为描述气候对鼠疫的影响效应曾提出“营养级模型”,认为冬春的降雨引起当地植被增加,从而为鼠类宿主提供食物和隐蔽地点,调节鼠类种群密度增加与人接触的概率,引起鼠疫流行。随后,Collinge等[7]采用数理统计方法检测“营养级模型”在当地主要鼠类宿主黑尾土拨鼠(Cynomys ludovicianus)鼠疫疫源地内的鼠疫时空动态,进一步验证了“营养级模型”。本研究采取非线性统计模型方法,通过分析长爪沙鼠(Meriones unguiculatus)鼠疫自然疫源地的主要宿主密度、媒介指数及鼠疫阳性率,分析生物因子和非生物因子在鼠疫自然疫源地内的时空动态及交互效应,现将结果报告如下。
1 材料与方法 1.1 资料来源鼠疫监测数据来源于内蒙古疾病预防控制中心,覆盖1980-2006年15个地点的监测数据。长爪沙鼠鼠疫自然疫源地位于内蒙古中西部,主要传播媒介为同型客蚤指名亚种(Xenopsylla conformis conformis)、秃病蚤蒙冀亚种(Nosopsyllus laeviceps kuzenkovi)和近代新蚤东方亚种(Neopsylla pleskei orientalis)。长爪沙鼠种群季节性呈春秋双峰型,故每年春秋(4-6月、10-11月)2次监测长爪沙鼠密度、体蚤指数和蚤阳性率。由于历史数据缺失和各监测点的差异,仅利用年平均值建立模型和分析。长爪沙鼠密度采用弓形夹法调查[8],体蚤指数为每只鼠平均体蚤数[9]。以细菌培养方法计算鼠疫阳性率,并进行统计学分析。年平均降雨量、气温数据均来自于中国气象数据共享服务网(http://cdc.cma.gov.cn/home.do)。采用距离鼠疫监测点最近的气象台站数据进行匹配[4-5]。当地植被采用归一化植被指数(normalized difference vegetation index,NDVI),来自中国西部环境与生态科学数据中心(http://westdc.westgis.ac.cn),内蒙古地区NDVI绘图见图 1。
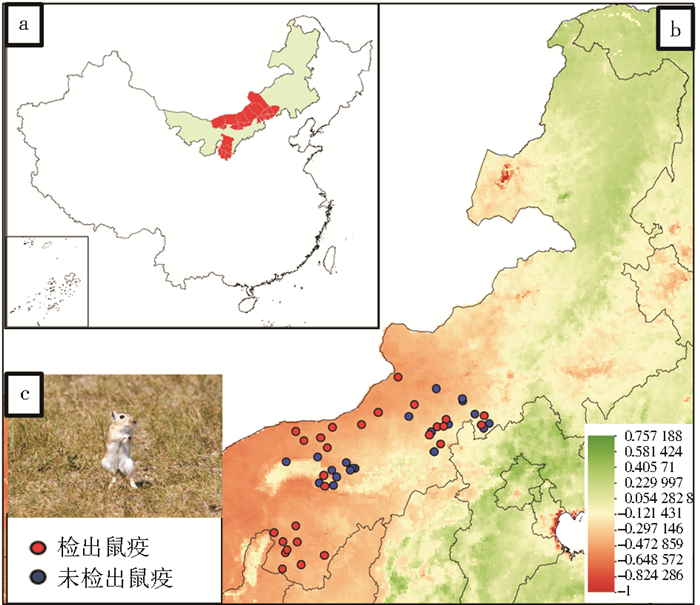
|
| 注:a.长爪沙鼠鼠疫自然疫源地位于中国北方,内蒙古自治区中西部;b.长爪沙鼠鼠疫自然疫源地处于半干旱地区,颜色表示NDVI。红色点表示在1980-2006年曾检出鼠疫的监测点,蓝色点表示未检出鼠疫的监测点;c.长爪沙鼠 图 1 内蒙古自治区长爪沙鼠鼠疫自然疫源地概况 Figure 1 Meriones unguiculatus natural plague foci located in the Inner Mongolia in North China |
| |
采用广义可加模型(generalized additive models,Gam)作为数理统计分析方法[10]。Gam是一种非线性统计模型,可以发现生物因子间,或生物因子和非生物因子间的复杂非线性关系。分别建立以鼠类种群动态、体蚤指数和鼠疫阳性率为相应变量的3个级联模型,分别分析3个因子和当地气温、降雨的非线性关系。利用R软件,“mgcv”软件包(V1.7-6)[10],使用交互验证的方法筛选模型,以广义交互验证指数(generalized cross validation,GCV)和无偏估计量(un-biased risk estimator,UBRE)作为筛选参数[10-11]。同时,分别对筛选后的模型进行残差分析,通过检验时间和空间上残差的自相关性作为判定模型优劣的重要标准[4]。模型方程如下:
模型1:
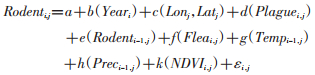
|
模型2:
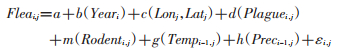
|
模型3:
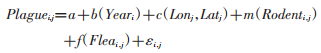
|
模型中变量Rodenti, j是i年监测点的平均鼠类种群密度;a是模型截距;b(Yeari)是监测点时间趋势(cubic regression spline function)。c(Lonj,Latj)是二维平滑空间趋势(thin-plate regression spline);d(Plaguei,j)是二分变量,表示j监测点鼠疫检验阳性与否;e(Rodenti-1,j)是j监测点上一年鼠类种群密度自回归变量(cubic regression spline function);f(Fleai,j)是j监测点i年体蚤指数平均值;knot设置为3;g(Tempi-1,j)和h(Preci-1,j)分别表示j监测点i-1年气温与降雨量;k(NDVIi,j)表示NDVI代表的植被指数,监测点i年NDVI;m(Rodenti,j)表示j监测点i年鼠类种群密度。
2 结果 2.1 长爪沙鼠鼠疫自然疫源地内生物因子宿主密度、媒介指数和鼠疫病原体阳性间的关系Gam结果表明,鼠类种群密度、体蚤密度和鼠疫感染率均有显著的时间趋势(图 2a、图 3a、图 4a)。鼠类种群存在显著的正向自我调节效应(F2.78,45.21=5.13,P<0.01;图 2b)。模型1中,体蚤对鼠类种群存在负效应,媒介对宿主起寄生作用(F2.84,45.21=6.19,P<0.01;图 2c)。模型2中,体蚤对鼠类种群存在显著负效应(F1,25.31=8.17,P<0.01;图 3b)。模型3中,鼠疫流行风险与鼠类种群存在显著正效应(χ21.96,25.66=29.87,P<0.01;图 4b)。鼠疫阳性与鼠类种群密度(0.75±0.13,t=5.71,P<0.05)和蚤指数关联显著(0.40±0.16,t=2.54,P<0.05)。
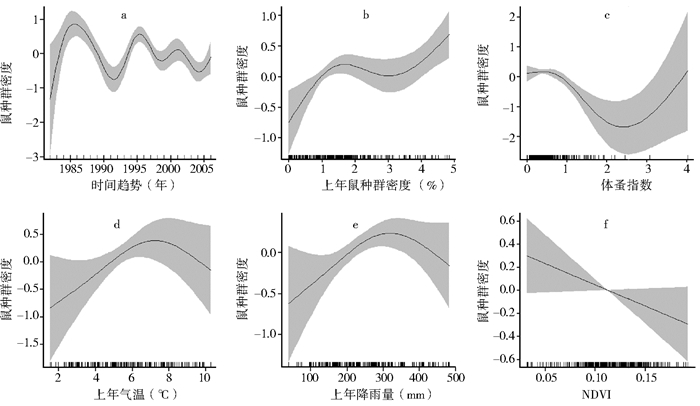
|
| 注:a.时间趋势;b.鼠类种群自相关效应;c.体蚤指数对鼠类种群(鼠密度)的影响效应;d.气温对鼠类种群的影响效应;e.降雨量对鼠类种群的影响效应;f.植被(NDVI)对鼠类种群的影响效应。 图 2 广义可加模型对模型1的分析结果 Figure 2 Partial effects were estimated from the rodent model by correcting for effects of other variables |
| |
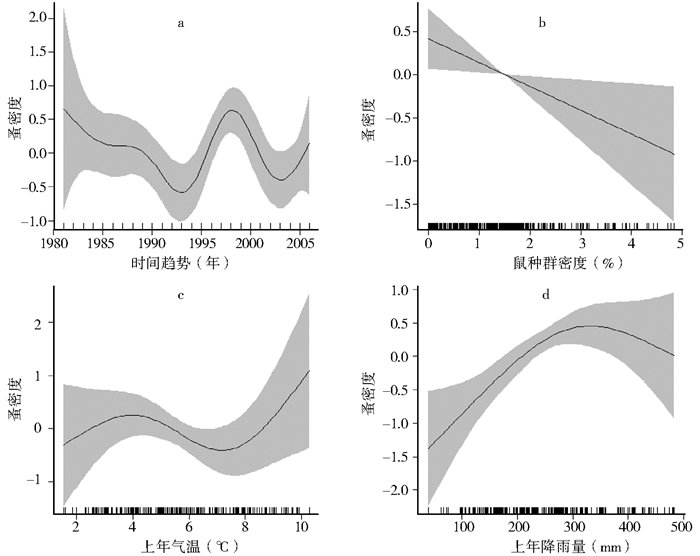
|
| 注:a.时间趋势;b.鼠类种群密度对体蚤指数的影响效应;c.上年气温对体蚤指数的影响效应;d.上年降雨量对体蚤指数的影响效应。 图 3 广义可加模型对模型2的分析结果 Figure 3 Partial effects were estimated from the flea model by correcting for effects of other variables |
| |
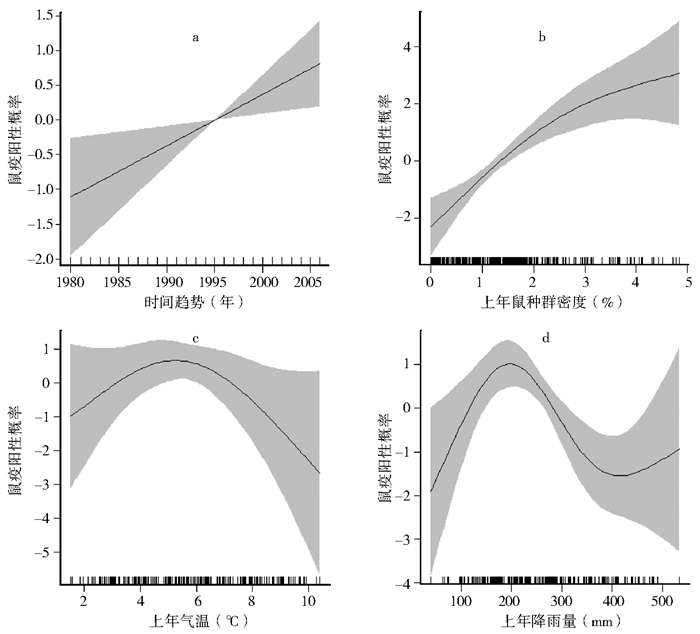
|
| 注:a.时间趋势;b.鼠类种群密度对鼠疫流行的影响效应;c.上年气温对鼠疫流行的影响效应;d.上年降雨量对鼠疫流行的影响效应。 图 4 广义可加模型对模型3的分析结果 Figure 4 Partial effects were estimated from the plague appearance model by correcting for effects of other variables |
| |
在3个Gam模型中,气候因子对宿主、媒介和鼠疫病原体有显著效应。上年气温显著影响模型1中鼠类种群密度(F2.35,45.21=3.52,P<0.05;图 2d)和模型2中的体蚤指数(F2.93,25.31=3.96,P<0.01;图 3c)。模型3中,鼠疫流行与气温间接近显著相关(F2.47,25.66=6.05,P<0.1;图 4c)。此外,模型1中,降雨量对鼠类种群密度间有接近显著的非线性效应(F2.09,45.21=2.24,P<0.1;图 2e)。模型2中,降雨量对体蚤指数存在显著相关(F2.28,25.31=8.73,P<0.01;图 3d)。模型3中,鼠疫的流行与当地降雨量关联显著(F3,25.66=16.22,P<0.01;图 4d)。上年的植被与鼠类种群呈接近显著的负向关联(F1,45.21=3.1,P<0.1;图 2f)。
3 讨论基于15个位于长爪沙鼠鼠疫自然疫源地内的监测点26年的鼠疫监测数据,采用非线性回归模型,分析鼠疫自然疫源地内生物因子、非生物因子之间的复杂交互关系。模型结果表明鼠疫宿主、媒介和病原体间存在显著的非线性关系,气温、降雨量及植被对鼠疫宿主种群、鼠疫媒介密度有调节作用,从而影响鼠疫的流行和暴发。
气候对长爪沙鼠鼠疫自然疫源地的影响效应与在哈萨克斯坦大沙鼠(Rhombomys opimus)鼠疫自然疫源地[2, 12]及美国西部鼠疫自然疫源地[13-14]的研究结果一致,为拓展美国白尾土拨鼠(Cynomys leucurus)鼠疫疫源地提出的“营养级模型”提供了研究证据[6-7, 15]。但“营养级模型”的结论与越南鼠疫自然疫源地内的研究结果并不完全相符,根据1997-2002年的人间鼠疫数据发现,63%的人间病例出现在2-4月的旱季[16]。而更早的研究也指出,1962-1966年当地的腺型鼠疫多发生在低温低湿的季节[1]。该种空间异质性与全国人间鼠疫与旱涝指数的相关关系相符[4],从而揭示出气候对鼠疫的影响具有明显的生态学复杂性和异质性。
长爪沙鼠鼠疫自然疫源地内的气候因子对宿主-媒介-病原体的影响支持了美国西部鼠疫疫源地的生态学理论模型“营养级模型”[6, 15]。但该种非线性的生态学效应,揭示出生态系统内的复杂生态学信号通路,支持采用结构方程(SEM)数学方法探测到的生态学信号结构[17]。本研究证明长爪沙鼠鼠疫疫源地内,鼠疫流行与长爪沙鼠密度存在显著正相关关系,降雨量和气温对长爪沙鼠密度的影响呈钟型效应,非线性效应可能与长爪沙鼠鼠疫自然疫源地的自然生态地理类型有关。长爪沙鼠鼠疫自然疫源地处于半干旱沙漠地带,非线性效应部分与处于半干旱地带的美国亚利桑那州Chihuahuan沙漠的研究一致[18]。尽管水是半干旱地带的主要生态限制因子,但大量的降雨并不利于鼠类种群的增长,反而会对鼠类种群出现负效应,如大量降雨可能淹没鼠类洞群,杀死鼠类[18]。在美国蒙大拿州的北美鹿鼠(Peromyscus maniculatus)种群动态研究中,气候因子对鼠类种群的调节也同样存在类似的复杂性,北美鹿鼠也是一种重要的汉坦病毒肺综合征(Hantavirus pulmonary syndrome,HPS)宿主动物,气候对该鼠传疾病也表现出非线性效应[19]。
鼠疫在长爪沙鼠鼠疫自然疫源地内较为活跃,可能与当地自然环境受气候变化的影响较为明显有关,在1955-2005年的50年间,后20年与前30年相比,升温和干旱的趋势更加明显[20],在未来较长的时间内,该地区鼠疫仍可能较为活跃,生态学关联可为当地制定鼠疫防控策略提供参考。
本研究对象仅为中国12种类型鼠疫自然疫源地中的1型[21-26],统计模型中各协变量之间存在明显的相关效应可能会干扰模型结果,因而覆盖空间范围的生态学研究更具有生态学意义和实践价值,同时有更大的研究空间和必要性。
| [1] | Cavanaugh DC, Marshall JD Jr. The influence of climate on the seasonal prevalence of plague in the Republic of Vietnam[J]. J Wildl Dis, 1972, 8 (1) : 85–94 .DOI:10.7589/0090-3558-8.1.85. |
| [2] | Stenseth NC, Samia NI, Viljugrein H, et al. Plague dynamics are driven by climate variation[J]. Proc Natl Acad Sci USA, 2006, 103 (35) : 13110–13115 .DOI:10.1073/pnas.0602447103. |
| [3] | Snäll T, O'Hara RB, Ray C, et al. Climate-driven spatial dynamics of plague among prairie dog colonies[J]. Am Nat, 2008, 171 (2) : 238–248 .DOI:10.1086/525051. |
| [4] | Xu L, Liu QY, Stige LC, et al. Nonlinear effect of climate on plague during the third pandemic in China[J]. Proc Natl Acad Sci USA, 2011, 108 (25) : 10214–10219 .DOI:10.1073/pnas.1019486108. |
| [5] | Xu L, Stige LC, Kausrud KL, et al. Wet climate and transportation routes accelerate spread of human plague[J]. Proc Roy Soc B Biol Sci, 2014, 281 (1780) : 20133159.DOI:10.1098/rspb.2013.3159. |
| [6] | Parmenter RR, Yadav EP, Parmenter CA, et al. Incidence of plague associated with increased winter-spring precipitation in New Mexico[J]. Am J Trop Med Hyg, 1999, 61 (5) : 814–821 . |
| [7] | Collinge SK, Johnson WC, Ray C, et al. Testing the generality of a trophic-cascade model for plague[J]. Eco Health, 2005, 2 (2) : 102–112 . |
| [8] | Jiang GS, Liu J, Xu L, et al. Climate warming increases biodiversity of small rodents by favoring rare or less abundant species in a grassland ecosystem[J]. Integr Zool, 2013, 8 (2) : 162–174 .DOI:10.1111/inz.2013.8.issue-2. |
| [9] | Smith CR, Tucker JR, Wilson BA, et al. Plague studies in California:a review of long-term disease activity, flea-host relationships and plague ecology in the coniferous forests of the Southern Cascades and Northern Sierra Nevada mountains[J]. J Vector Ecol, 2010, 35 (1) : 1–12 .DOI:10.1111/j.1948-7134.2010.00051.x. |
| [10] | Wood SN. Generalized additive models: an introduction with R[M]. Boca Raton, FL: Chapman & Hall/CRC, 2006 : 100 -202. |
| [11] | Stige LC, Ottersen G, Brander K, et al. Cod and climate:effect of the North Atlantic Oscillation on recruitment in the North Atlantic[J]. Mar Ecol Prog Ser, 2006 : 227–241 .DOI:10.3354/meps325227. |
| [12] | Kausrud KL, Viljugrein H, Frigessi A, et al. Climatically driven synchrony of gerbil populations allows large-scale plague outbreaks[J]. Proc Roy Soc B Biol Sci, 2007, 274 (1621) : 1963–1969 .DOI:10.1098/rspb.2007.0568. |
| [13] | Ben Ari T, Gershunov A, Tristan R, et al. Interannual variability of human plague occurrence in the Western United States explained by tropical and North Pacific Ocean climate variability[J]. Am J Trop Med Hyg, 2010, 83 (3) : 624–632 .DOI:10.4269/ajtmh.2010.09-0775. |
| [14] | Ben Ari T, Gershunov A, Gage KL, et al. Human plague in the USA:the importance of regional and local climate[J]. Biol Lett, 2008, 4 (6) : 737–740 .DOI:10.1098/rsbl.2008.0363. |
| [15] | Enscore RE, Biggerstaff BJ, Brown TL, et al. Modeling relationships between climate and the frequency of human plague cases in the southwestern United States, 1960-1997[J]. Am J Trop Med Hyg, 2002, 66 (2) : 186–196 . |
| [16] | Pham HV, Dang DT, Minh NNT, et al. Correlates of environmental factors and human plague:an ecological study in Vietnam[J]. Int J Epidemiol, 2009, 38 (6) : 1634–1641 .DOI:10.1093/ije/dyp244. |
| [17] | Xu L, Schmid BV, Liu J, et al. The trophic responses of two different rodent-vector-plague systems to climate change[J]. Proc Roy Soc B Biol Sci, 2015, 282 (1800) : 20141846. |
| [18] | Brown JH, Ernest SKM. Rain and rodents:complex dynamics of desert consumers[J]. Bioscience, 2002, 52 (11) : 979–987 .DOI:10.1641/0006-3568(2002)052[0979:RARCDO]2.0.CO;2. |
| [19] | Luis AD, Douglass RJ, Mills JN, et al. The effect of seasonality, density and climate on the population dynamics of Montana deer mice, important reservoir hosts for Sin Nombre hantavirus[J]. J Anim Ecol, 2010, 79 (2) : 462–470 .DOI:10.1111/jae.2010.79.issue-2. |
| [20] | Lu N, Wilske B, Ni J, et al. Climate change in Inner Mongolia from 1955 to 2005-trends at regional, biome and local scales[J]. Environ Res Lett, 2009, 4 (4) : 045006.DOI:10.1088/1748-9326/4/4/045006. |
| [21] | 方喜业, 许磊, 刘起勇, 等. 中国鼠疫自然疫源地分型研究Ⅰ.生态地理景观特征[J]. 中华流行病学杂志,2011,32 (12) :1232–1236. |
| [22] | 方喜业, 杨瑞馥, 刘起勇, 等. 中国鼠疫自然疫源地分型研究Ⅱ.鼠疫自然疫源地分型方法研究[J]. 中华流行病学杂志,2012,33 (2) :234–238. |
| [23] | 方喜业, 周冬生, 崔玉军, 等. 中国鼠疫自然疫源地分型研究Ⅳ.鼠疫耶尔森菌生物型生物学特征的探讨[J]. 中华流行病学杂志,2012,33 (6) :626–629. |
| [24] | 方喜业, 周冬生, 崔玉军, 等. 中国鼠疫自然疫源地分型研究Ⅲ.鼠疫耶尔森菌DFR/MLVA主要基因组型生物学特征[J]. 中华流行病学杂志,2012,33 (5) :536–539. |
| [25] | 龚正达, 于心, 刘起勇, 等. 中国鼠疫自然疫源地分型研究Ⅵ.鼠疫媒介生物学特征[J]. 中华流行病学杂志,2012,33 (8) :818–822. |
| [26] | 秦长育, 许磊, 张荣祖, 等. 中国鼠疫自然疫源地分型研究Ⅴ.鼠疫宿主生物学特征[J]. 中华流行病学杂志,2012,33 (7) :692–697. |
 2016, Vol. 27
2016, Vol. 27


