扩展功能
文章信息
- 张勤, 王晓梦, 岳巧云, 高洁, 邱德义
- ZHANG Qin, WANG Xiao-meng, YUE Qiao-yun, GAO Jie, QIU De-yi
- 河南口岸截获鼠类DNA条形码鉴定
- Identification of intercepted Rattus nitidus by DNA barcoding at Henan port
- 中国媒介生物学及控制杂志, 2016, 27(3): 280-282
- Chin J Vector Biol & Control, 2016, 27(3): 280-282
- 10.11853/j.issn.1003.8280.2016.03.016
-
文章历史
- 收稿日期: 2015-12-17
- 网络出版时间: 2016-04-14 12:00
2 中山出入境检验检疫局, 广东 中山 528403
2 Zhongshan Entry-Exit Inspection and Quarantine Bureau
国境口岸对外来医学媒介生物的鉴定主要以形态差异作为物种分类和鉴别的标准,要求检验人员有较好的鉴定技能及样本完好,对不同发育阶段的样本以及形态相似的近缘物种仅依靠形态学较难得到明确的鉴定结果。DNA条形码技术首先由Hebert等[1]提出,是以细胞色素C氧化酶亚基Ⅰ(COⅠ)基因为主要标准基因的物种鉴定方法。近几年DNA条形码技术以其快速准确、操作简便等优势,在国境口岸医学媒介生物鉴定中得到广泛应用[2-7]。目前该技术已成功应用于多个生物类群中[8-11]。
1 材料与方法 1.1 材料以河南郑州机场口岸截获的1只鼠样本为研究对象,取其肝脏冻存,并制作标本,测量并记录外部形态和头骨相关数据。
DNA提取试剂盒购自Qiagen公司;PCR试剂盒、Premix TaqTM酶、DNA Marker、琼脂糖、Gold View核酸染料、琼脂糖凝胶DNA回收试剂盒和pMD18-T载体均购自TaKaRa公司;其他试剂均为国产或进口分析纯。
1.2 方法 1.2.1 基因组DNA的提取取肝脏约25 mg,按照DNA提取试剂盒说明书提取基因组DNA。
1.2.2 COⅠ基因的扩增通用引物BatL5310:5′-CCT ACT CRG CCA TTT TAC CTA TG -3′和R6036R:5′-ACT TCT GGG TGT CCA AAG AAT CA-3′[12],由Invitrogen公司合成。PCR反应体系(25 μl):DNA模板2 μl,10 μmol/L BatL5310和R6036R各1 μl,Premix TaqTM 12.5 μl,ddH2O 8.9 μl;反应条件:94 ℃ 5 min;94 ℃ 30 s,54 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 10 min。反应以水作空白对照,反应结束后以1.5%琼脂糖凝胶电泳检测PCR产物。
1.2.3 COⅠ基因序列分析PCR产物由Invitrogen公司进行序列测定。将截获样本的序列在GenBank和BOLD Systems v3中进行比对,根据比对结果选取参考序列,使用Mega 4.1软件构建系统发育树。
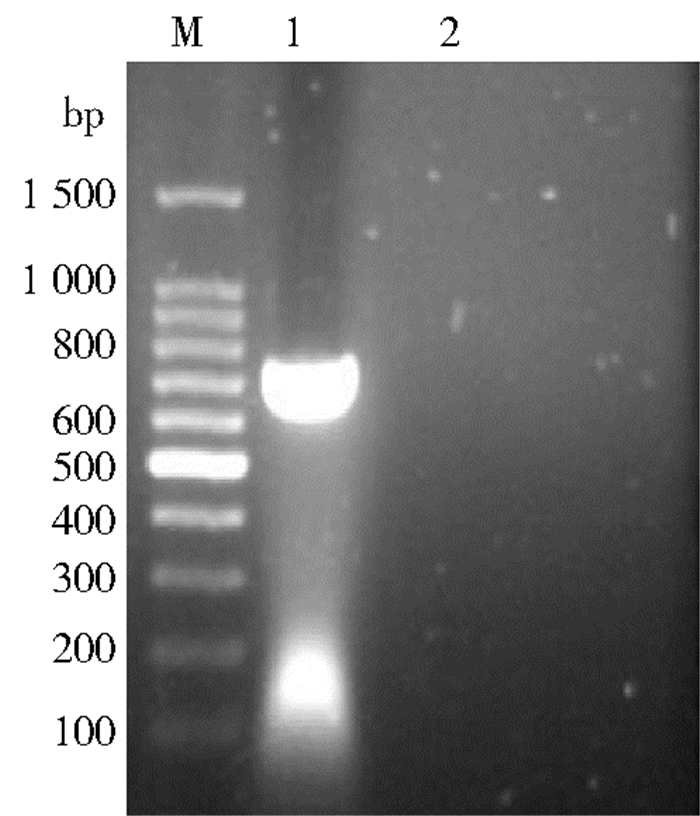
2 结 果 2.1 COⅠ基因片段扩增该样本经通用引物扩增出1条长度约750 bp的片段,见图 1,与目的片段大小一致,经纯化回收后送上海立菲生物技术有限公司进行测序。
|
| M. 100 bp DNA Marker; 1. 样本扩增结果; 2. 空白对照。 图 1 截获鼠样本COⅠ基因片段PCR扩增结果 Figure 1 PCR amplification of COⅠ fragments of the captured rat species |
| |
目的片段去除引物后大小为702 bp,使用DNAStar软件对该序列的碱基进行分析,其碱基组成如表 1所示。将该样本COⅠ片段在GenBank和BOLD Systems v3中进行比对,与样本COⅠ基因片段同源性最高的鼠种为大足鼠(Rattus nitidus),同源性为99.43%。
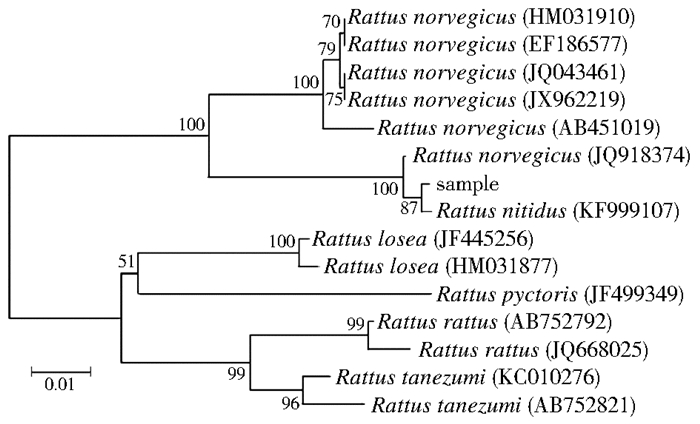
在GenBank中选取大足鼠及其同属的褐家鼠(R. norvegicus)、黄胸鼠(R. tanezumi)、黄毛鼠(R. losea)、拟家鼠(R. pyctoris)、黑家鼠(R. rattus)等14条序列作为参考序列(表 2),对15条COⅠ片段620 bp的重叠区域以Kimura-2-parameter模式构建邻接法系统发育树。结果显示同一鼠种不同个体均形成单系,种间分支明显。样本与大足鼠聚在同一分支,其中褐家鼠、大足鼠又聚在一个大分支中,见图 2。
|
| 图 2 基于鼠COⅠ序列620 bp重叠片段构建的系统发育树 Figure 2 Phylogenetic analysis based on 620 bp overlapped COⅠ gene of the captured and reference rat species |
| |
大足鼠最早报道于尼泊尔,广泛分布于尼泊尔、印度、缅甸和泰国等地,我国主要见于长江以南广大地区[13]。大足鼠隶属于鼠亚科(Murinae),家鼠属(Rattus);中型鼠类,体型壮,成鼠体重180~200 g,体长150~190 mm,尾细长,略短于体长,尾环不明显,成鼠后足>30 mm;耳大而薄,前拉可达眼部。背毛棕褐色,自吻部至尾基部毛色基本一致。腹毛灰白色,自颏下至肛门处,毛色基本一致。前后足背面均为棕色。尾背面为棕褐色,腹面为灰白色。头骨较狭长,棱嵴较发达,鼻骨较长,颞嵴在顶骨处向外扩展成弧形与黄胸鼠相似,门齿孔较窄长,其后缘接近第一臼齿的连接线。听泡较大。上颌第1臼齿较大,第3臼齿最小,第1臼齿约等于第3臼齿的2倍。第1臼齿第l横嵴外侧齿突退化,中齿突正常,内齿突向下弯曲。第2横嵴3个齿突发育正常。第3横嵴内齿突消失,外齿突较小,中齿突最大。第2臼齿第1横嵴消失,仅余l内齿突。第2横嵴发育正常,第3横嵴内外齿突皆退化,仅余l中齿突。第3臼齿第l横嵴亦仅留l内齿突,第2、3横嵴连成环状。大足鼠对水稻危害很大,并且是肾综合征出血热、钩端螺旋体病、鼠疫[14]等多种疾病的传染源。由于大足鼠与褐家鼠、黄胸鼠形态相似,仅通过形态学难以进行准确鉴定,故本研究采用DNA条形码技术对该样本进行鉴定。
DNA条形码技术的根本目的是快速准确地鉴定单个物种,因此只有进化速度适宜的DNA序列才可作为物种鉴定的条形码。线粒体基因的种内遗传距离通常<1%,极少数>2%,但种间差异最小为2%,最高可达11.30%[15]。近年来,DNA条形码技术有效完善了我国国境口岸媒介鼠类鉴定工作。陈春生等[16]对中尼边境17个鼠类标本DNA条形码进行分子进化分析,结果显示17个标本种内遗传距离平均值为0.035,种间遗传距离为种内遗传距离10以上,表明COⅠ基因序列能够对鼠类进行有效地物种鉴定;闫东等[17]对河北省鼠疫疫源地87份样本进行DNA条形码分析,结果表明85份样本与形态学鉴定结果一致,其余2份经反复鉴定头骨及形态学标本证实DNA条形码鉴定结果正确。在鼠类物种鉴定工作中,DNA条形码技术可作为传统形态学鉴定的有效补充,将两者结合起来以便纠正传统形态学鉴定中的错误,快速准确的进行鼠种鉴别。
| [1] | Hebert PDN, Cywinska A, Ball SL, et al. Biological identifications through DNA barcodes[J]. Proc R Soc Lond B Biol Sci, 2003, 270 (1512) : 313–321 . |
| [2] | 吴薇. DNA条形码技术在医学媒介生物鉴定中的应用前景展望[J]. 畜牧与饲料科学,2012,33 (1) :22–24. |
| [3] | 王颖, 方绍庆, 刘明杰, 等. DNA条形码技术在媒介蝇类分子鉴定中的应用[J]. 口岸卫生控制,2013,18 (3) :55–58. |
| [4] | 方义亮, 张建庆, 肖武, 等. DNA条形码技术在麻蝇亚科鉴定中的应用[J]. 中国人兽共患病学报,2015,31 (6) :569–573. |
| [5] | 刘德星, 岳巧云, 廖俊蕾, 等. 国内未见分布蝇种:澳洲麻蝇的形态和DNA条形码鉴定[J]. 中国媒介生物学及控制杂志,2015,26 (3) :282–285. |
| [6] | Yue QY, Wu KL, Qiu DY, et al. A formal re-description of the Cockroach Hebardina concinna anchored on DNA barcodes confirms wing polymorphism and identifies morphological characters for field identification[J]. PLoS One, 2014, 9 (9) : e106789. |
| [7] | 刘德星, 聂维忠, 邱德义, 等. 应用DNA条形码技术快速鉴定入境船舶上截获的昆虫蛹[J]. 检验检疫学刊,2014,24 (5) :53–57. |
| [8] | Savolainen V, Cowan RS, Vogler AP, et al. Towards writing the encyclopaedia of life: an introduction to DNA barcoding[J]. Philos Trans R Soc Lond B Biol Sci, 2005, 360 (1462) : 1805–1811 . |
| [9] | Ward RD, Zemlak TS, Innes BH, et al. DNA barcoding Australia's fish species[J]. Philos Trans R Soc Lond B Biol Sci, 2005, 360 (1462) : 1847–1857 . |
| [10] | Smith MA, Fisher BL, Hebert PDN. DNA barcoding for effective biodiversity assessment of a hyperdiverse arthropod group: the ants of Madagascar[J]. Philos Trans R Soc Lond B Biol Sci, 2005, 360 (1462) : 1825–1834 . |
| [11] | Hebert PDN, Stoeckle MY, Zemlak TS, et al. Identification of birds through DNA barcodes[J]. PLoS Biol, 2004, 2 (10) : e312. |
| [12] | Robins J, Hingston M, Matisoo-Smith E, et al. Identification Rattus species using mitochondrial DNA[J]. Mol Ecol Notes, 2007, 7 (5) : 717–729 . |
| [13] | 张际文. 中国国境口岸医学媒介生物鉴定图谱[M]. 天津: 天津科学技术出版社, 2015 : 63 . |
| [14] | 杨光荣, 王应祥. 云南省啮齿动物名录及与疾病的关系[J]. 中国鼠类防制杂志,1989,5 (4) :222–229. |
| [15] | Hebert PDN, Ratnasingham S, deWaard JR. Barcoding animal life: cytochrome c oxidase subunit 1 divergences among closely related species[J]. Proc Biol Sci, 2003, 270 (Suppl 1) : S96–99 . |
| [16] | 陈春生, 张晓龙, 张雪莲, 等. 基于COⅠ基因序列的DNA条形码在中尼边境鼠类物种鉴定中的应用[J]. 西南国防医药,2012,22 (1) :22–24. |
| [17] | 闫东, 鲁亮, 金圣浩, 等. DNA条形码技术在河北省鼠疫疫源地鼠种鉴定中的应用[J]. 中国媒介生物学及控制杂志,2014,25 (1) :21–23. |
 2016, Vol. 27
2016, Vol. 27