扩展功能
文章信息
- 陈生林, 朱耐伟, 朱勇喆, 徐庆强, 彭浩然, 戚中田
- CHEN Sheng-lin, ZHU Nai-wei, ZHU Yong-zhe, XU Qing-qiang, PENG Hao-ran, QI Zhong-tian
- 细胞膜胆固醇在流行性乙型脑炎病毒及肠道病毒71型感染人神经细胞中的作用
- The role of cell membrane cholesterol in Japanese encephalitis virus and enterovirus 71 infection of human neuronal cells
- 中国媒介生物学及控制杂志, 2016, 27(3): 253-256
- Chin J Vector Biol & Control, 2016, 27(3): 253-256
- 10.11853/j.issn.1003.8280.2016.03.010
-
文章历史
- 收稿日期: 2016-02-19
- 网络出版时间: 2016-04-14 12:00
流行性乙型脑炎病毒(JEV)和肠道病毒71型(EV71)均具有神经亲嗜性。JEV经蚊媒传播,导致流行性乙型脑炎(乙脑),为人畜共患病。JEV感染脑部或脑膜引发脑炎或脑膜炎,比例分别为60%~75%和5%~10%。乙脑患者的病死率为20%~30%,存活患者大多存在永久性神经损伤,有麻痹症和智力障碍等后遗症[1]。EV71是引起婴幼儿手足口病的主要病原体之一。临床表现为发热和手、足、口腔等部位出现皮疹、溃疡等,严重者表现为无菌性脑炎、脑膜脑炎、脑干脑炎、脊髓灰质炎样麻痹、心肌炎和肺水肿等神经系统疾病[2]。胆固醇是细胞膜的重要成分,嵌在细胞膜的磷脂双层之间,使细胞膜结构富有流动性,为蛋白质的相互作用提供平台,在跨膜信号转导、跨膜运输分选和细胞骨架重建等过程中发挥重要作用。细胞膜胆固醇还在多种病毒的感染过程中扮演重要角色。有研究表明,细胞膜胆固醇在登革热病毒[3]、西尼罗病毒[4]以及丙型肝炎病毒[5]等黄病毒的复制周期中起关键作用。许多肠道病毒,如脊髓灰质炎病毒[6]、柯萨奇病毒[7]以及埃可病毒[8]等,在感染靶细胞的过程中均依赖于完整的细胞膜胆固醇结构。不同病毒利用胆固醇感染的机制不尽相同[9]。由于尚未阐明嗜神经性病毒JEV和EV71的致病机制,本研究利用神经组织来源的人神经母细胞瘤SH-SY5Y细胞,通过胆固醇删除剂探讨JEV和EV71感染神经细胞的机制,为临床抗病毒治疗提供新的靶点和思路。
1 材料与方法 1.1 材料人神经母细胞瘤SH-SY5Y细胞由本室保存。JEV病毒株SA14由俞永新教授惠赠,EV71病毒株FJ08089分离自一8岁的手足口病患者,由福建省疾病预防控制中心惠赠。DMEM培养基、细胞培养用青链霉素及胎牛血清为Gibco生产。胆固醇删除剂甲基-β-环糊精(MβCD)购自Sigma公司。RNA抽提试剂TRIzol、反转录试剂盒(PrimeScrip RT reagent Kit)购自TaRaKa公司。引物由Invitrogen公司合成。
1.2 细胞培养SH-SY5Y细胞在含有10%胎牛血清、1%青链霉素的DMEM完全培养基中培养,5% CO2、37 ℃孵箱中进行细胞常规传代培养。
1.3 细胞增殖活性的测定采用CCK-8方法检测使用MβCD后对细胞增殖的影响。收集对数生长期细胞,每孔3 000个细胞接种于96孔板。待细胞过夜贴壁后,添加不同浓度(1.0、2.5、5.0、7.5和10.0 mmol/L)的MβCD,培养48 h后检测细胞增殖情况。弃去原有培养基,每孔加入含10 μl CCK-8的新鲜培养基110 μl,培养3 h后用多功能酶标仪在450 nm波长检测各孔吸光度值(A)。实验独立重复3次,计算平均值。计算不同药物浓度下肿瘤细胞生长抑制率,应用GraphPad Prism5软件计算药物半数抑制浓度(IC50)。
肿瘤细胞生长抑制率(%)=(1-加药组A值/对照组A值)×100
1.4 实时荧光定量PCR(qRT-PCR)检测MβCD对病毒mRNA表达水平的影响 1.4.1 MβCD预处理神经细胞实验共分4组,即一般感染组和3个药物干扰组〔MβCD(1.0、2.5和5.0 mmol/L)〕。每组每个浓度均3个孔,并重复3次。将SH-SY5Y细胞接种于96孔板中,37 ℃孵育至过夜。待细胞融合度达80%时,吸出培养上清,用PBS缓冲液润洗2次,分别加入不同浓度的MβCD,于37 ℃孵育1 h;弃去培养基,加入JEV或EV71〔感染复数(MOI)=0.5〕,37 ℃孵育1 h后弃去病毒液,PBS缓冲液润洗3次,加入含10%胎牛血清的DMEM培养基继续培养。在感染后24 h通过qRT-PCR检测SH-SY5Y细胞中JEV或EV71 mRNA的表达。
1.4.2 病毒不同感染阶段MβCD的作用为明确药物影响病毒感染的作用阶段,将实验分为4组:一般感染组、1组将5 mmol/L MβCD在JEV或EV71(MOI=0.5)感染前1 h加入SH-SY5Y细胞中,另2组分别在JEV或EV71(MOI=0.5)感染后0、60 min加入MβCD,比较不同实验组之间的JEV或EV71 mRNA表达水平。
1.4.3 TRIzol提取对照组及处理组细胞的总RNA靶细胞处理后去培养上清,在细胞中加入1 ml TRIzol,充分混合室温裂解细胞3~5 min。加入1/5体积的氯仿,手动剧烈混合15 s。于4 ℃、13 800×g离心15 min。取上层水相并转移到新的EP管中,加入等体积异丙醇,充分混合,室温沉淀10 min。于4 ℃、13 800×g离心10 min。弃上清,加入1 ml预冷的75%乙醇。于4 ℃、13 800×g离心5 min,弃上清,室温晾干RNA沉淀,加入焦碳酸二乙酯(DEPC)处理水溶解沉淀,得总RNA。
1.4.4 引物序列JEV Forward Primer: 5′-CCC TCA GAA CCG TCT CGG AA-3′;JEV Revers Primer:5′- CTA TTC CCA GGT GTC AAT ATG CTG T-3′;EV71 Forward Primer:5′-GCA GCC CAA AAC AAC TTC AC-3′;EV71 Revers Primer:5′-ATT TCA GCA GCT TGG AGT GC-3′;GAPDH Forward Primer:5′-TGG GCT ACA CTG AGC ACC AG-3′;GAPDH Revers Primer:5′-AAG TGG TCG TTG AGG GCA AT-3′。
1.4.5获取对照组及干扰组细胞的cDNA 利用TaKaRa反转录试剂盒获取对照组及干扰组细胞的cDNA,反应体系如下:5×PrimeScript Buffer 2 μl,PrimeScript RT Enzyme Mix 0.5 μl,Random 6 mers 0.5 μl,总 RNA 500 ng,Rnase Free dH2O加至10 μl。轻柔混合混匀,置于37 ℃反应15 min,然后置于 85 ℃加热5 s灭活反转录酶。
1.4.6qRT-PCR 利用TaKaRa的SYBR Premix Ex Taq试剂盒进行反应,反应体系如下:SYBR Premix Ex Taq 10 μl,Forward Primer 0.4 μl,Revers Primer 0.4 μl,cDNA模板 2 μl,dH2O 7.2 μl。利用Rotor Gene 3000A仪器进行两步法扩增,95 ℃预变性2 min,进行40个PCR循环,95 ℃ 5 s,60 ℃ 30 s。同时增设内参组,GAPDH的上下游引物各0.4 μl,其他条件与实验组完全相同,和实验组同时进行。应用分析软件首先消除内参,然后比较实验结果,设定最高组为1,输出相关的实验数据,并做统计学分析。
1.5 统计学处理采用SPSS 16.0 软件对数据进行统计学分析。数据用x±s表示,两组间统计学分析比较采用Student’s t检验;多组间比较采用方差分析ANOVA。P<0.05表示差异有统计学意义。
2 结 果 2.1 SH-SY5Y细胞感染JEV和EV71情况病毒组qRT-PCR结果显示,JEV和EV71均能高效感染SH-SY5Y细胞(P<0.001),见图 1。
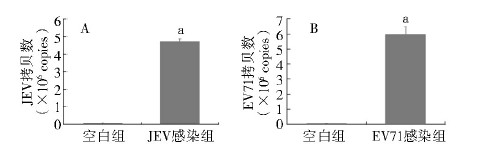
|
| 图 1 qRT-PCR检测JEV(A)、EV71(B)感染SH-SY5Y细胞 Figure 1 Detection of expression levels of JEV (A) and EV71 (B) viral RNA in SH⁃SY5Y cells by qRT⁃PCR |
| |
高浓度的MβCD抑制SH-SY5Y细胞的增殖。与对照组比较,7.5、10.0 mmol/L的MβCD对SH-SY5Y细胞生长有明显的抑制作用,且差异有统计学意义(P<0.01,P<0.001),见图 2。根据检测结果,确定MβCD的最高工作浓度为5.0 mmol/L。
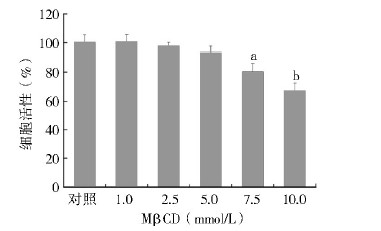
|
| 注:细胞活性为对照组的67.00%。a. 与对照组比较,P<0.01; b. 与对照组比较,P<0.001。 图 2 不同浓度MβCD对SH⁃SY5Y细胞增殖活性的影响 Figure 2 The effect of various concentrations of MβCD treatment on the proliferate activity of SH-SY5Y cells |
| |
mRNA表达水平的影响 qRT-PCR结果显示,不同浓度的MβCD作用于人神经母细胞瘤SH-SY5Y细胞,24 h后发现细胞内JEV mRNA和EV71 mRNA表达水平均下降。随着MβCD浓度的增加,胞内JEV核酸表达呈剂量依赖性的减少,1.0 mmol/L组(3.14±0.65)、2.5 mmol/L组(1.71±0.13)、5.0 mmol/L组(0.54±0.16)均低于对照组(4.51±0.43),且差异有统计学意义(P<0.05,P<0.001,P<0.001),5.0 mmol/L的MβCD使细胞内JEV基因拷贝数下降约10倍(图 3)。同样MβCD对细胞内EV71核酸表达的抑制也呈浓度依赖性,1.0 mmol/L组(3.96±0.15)、2.5 mmol/L组(2.44±0.34)和5.0 mmol/L组(1.28±0.37)均低于对照组(6.03±0.40),差异有统计学意义(均P<0.001),见图 3。提示MβCD通过破坏胆固醇抑制JEV和EV71感染SH-SY5Y细胞,且呈剂量依赖性。
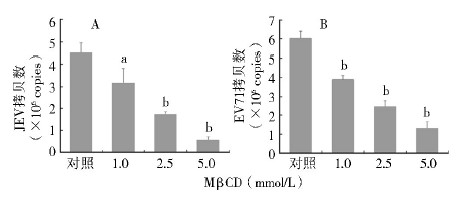
|
| 注:a. 与对照组比较,P<0.05;b. 与对照组比较,P<0.001。 图 3 不同浓度MβCD对JEV(A)、EV71(B)感染的影响 Figure 3 The effect of various concentrations of MβCD treatment on JEV (A) and EV71(B) infectivity |
| |
qRT-PCR结果显示,5.0 mmol/L的MβCD在病毒感染的不同时间点作用于SH-SY5Y细胞,24 h后发现细胞内JEV mRNA和EV71 mRNA表达水平下降量不同。MβCD在JEV感染前、感染时和感染后加入SH-SY5Y细胞,均抑制胞内JEV核酸表达,分别是感染前60 min组(0.56±0.37,P<0.001)、感染0 min组(1.07±0.16,P<0.001)和感染后60 min组(1.72±0.57,P<0.01)均低于对照组。而MβCD在EV71感染前和感染时加入SH-SY5Y细胞,均能抑制胞内JEV核酸表达,感染前60 min组(1.74±0.22)、感染0 min组(2.79±0.63)低于对照组,差异有统计学意义(均P<0.001);但在EV71感染后加入MβCD未对EV71 mRNA表达水平产生影响,感染后60 min组(5.83±0.54)与对照组(6.26±0.29)比较差异无统计学意义(P>0.05)(图 4)。提示MβCD仅在EV71入侵SH-SY5Y细胞的早期阶段抑制病毒感染,而MβCD可在JEV入侵SH-SY5Y细胞后仍抑制病毒感染。
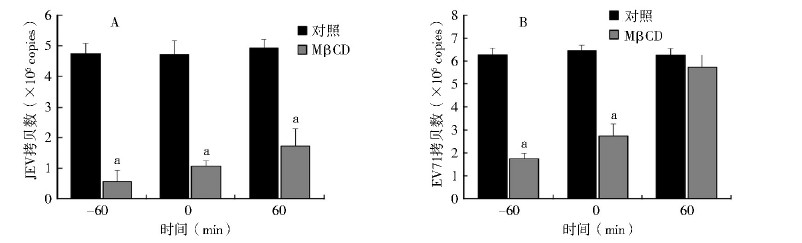
|
| 注:a. 与对照组比较,P<0.001。 图 4 MβCD对JEV(A)、EV71(B)不同感染阶段的影响 Figure 4 The effect of MβCD treatment on the different stages of JEV (A) and EV71 (B) infection |
| |
细胞膜是病毒感染靶细胞的首道屏障。胆固醇作为细胞膜重要成分,是许多病毒感染宿主细胞的起始位点[10]。国内外对细胞膜胆固醇在病毒感染过程的作用机制研究较多,尤其是具有神经亲嗜性的单纯疱疹病毒[11]和狂犬病病毒[12]等。然而,细胞膜胆固醇参与病毒感染过程存在细胞特异性,同一种病毒感染不同的细胞时对胆固醇的利用率不同,甚至同种病毒的不同亚型感染同一靶细胞时对胆固醇的依赖程度也不尽相同[13]。因此,深入探讨细胞膜胆固醇在JEV和EV71感染神经系统损伤的发病机制,有助于了解病毒对神经系统的致病机制。
研究细胞膜胆固醇常见的方法是利用药物干扰其完整结构,观察干扰后对病毒感染性的影响。MβCD特异性地删除或驱散细胞膜上的胆固醇,为最常见的干扰细胞膜胆固醇的药物。前期研究表明,MβCD删除胆固醇后,可显著降低西尼罗病毒对神经细胞的易感性[14],也可抑制脊髓灰质炎病毒侵染神经细胞[15]。本研究将不同浓度的MβCD预处理靶细胞,观察其对JEV和EV71感染人神经母细胞瘤SH-SY5Y细胞的作用效果。结果显示,MβCD使JEV和EV71在SH-SY5Y细胞中的表达水平显著下降,并呈剂量依赖性。有助于进一步了解嗜神经性病毒与宿主细胞的相互作用机制,对有效预防和治疗病毒感染疾病有重要意义。
大量研究表明,细胞膜胆固醇是许多包膜病毒感染靶细胞优先选择的位点,在非包膜病毒的感染过程中发挥重要作用[16]。本研究将MβCD在病毒感染的不同时间点作用于SH-SY5Y细胞,观察药物影响病毒感染的作用阶段。结果显示,MβCD在JEV感染神经细胞之前、同时和之后均能抑制病毒感染,仅能在EV71感染靶细胞的早期阶段抑制病毒感染。可能是因为EV71并无包膜蛋白,而JEV有包膜病毒。JEV感染靶细胞时需将自身的包膜和宿主细胞的内体膜融合,释放出病毒基因组,从而完成入侵过程,该过程需依赖胆固醇[17]。而EV71并无包膜,感染靶细胞时与其定位在膜胆固醇上的受体结合后即可启动病毒内吞[18]。说明胆固醇在嗜神经病毒感染靶细胞中的作用不同,其调节病毒与宿主细胞相互作用的精确分子机制需进一步研究。
本实验利用胆固醇删除剂,在神经嗜性病毒JEV和EV71感染前后的不同时间点作用于SH-SY5Y细胞,观察干扰细胞膜胆固醇对病毒感染神经细胞的影响,探讨了不同病毒利用胆固醇完成细胞入侵的区别与联系,为抗病毒治疗提供了新靶点。
| [1] | Misra UK, Kalita J. Overview: Japanese encephalitis[J]. Prog Neurobiol, 2010, 91 (2) : 108–120 . |
| [2] | Nolan MA, Craig ME, Lahra MM, et al. Survival after pulmonary edema due to enterovirus 71 encephalitis[J]. Neurology, 2003, 60 (10) : 1651–1656 . |
| [3] | Rothwell C, Lebreton A, Young Ng C, et al. Cholesterol biosynthesis modulation regulates dengue viral replication[J]. Virology, 2009, 389 (1/2) : 8–19 . |
| [4] | Mackenzie JM, Khromykh AA, Parton RG. Cholesterol manipulation by West Nile virus perturbs the cellular immune response[J]. Cell Host Microbe, 2007, 2 (4) : 229–239 . |
| [5] | Kapadia SB, Barth H, Baumert T, et al. Initiation of hepatitis C virus infection is dependent on cholesterol and cooperativity between CD81 and scavenger receptor B typeⅠ[J]. J Virol, 2007, 81 (1) : 374–383 . |
| [6] | Danthi P, Chow M. Cholesterol removal by methyl-beta-cyclodextrin inhibits poliovirus entry[J]. J Virol, 2004, 78 (1) : 33–41 . |
| [7] | Coyne CB, Bergelson JM. Virus-induced Abl and Fyn kinase signals permit coxsackievirus entry through epithelial tight junctions[J]. Cell, 2006, 124 (1) : 119–131 . |
| [8] | Marjomäki V, Pietiäinen V, Matilainen H, et al. Internalization of echovirus 1 in caveolae[J]. J Virol, 2002, 76 (4) : 1856–1865 . |
| [9] | Chazal N, Gerlier D. Virus entry, assembly, budding, and membrane rafts[J]. Microbiol Mol Biol Rev, 2003, 67 (2) : 226–237 . |
| [10] | Chung CS, Huang CY, Chang W. Vaccinia virus penetration requires cholesterol and results in specific viral envelope proteins associated with lipid rafts[J]. J Virol, 2005, 79 (3) : 1623–1634 . |
| [11] | Zheng K, Xiang YF, Wang X, et al. Epidermal growth factor receptor-PI3K signaling controls cofilin activity to facilitate herpes simplex virus 1 entry into neuronal cells[J]. mBio, 2014, 5 (1) : e00958–13 . |
| [12] | Hotta K, Bazartseren B, Kaku Y, et al. Effect of cellular cholesterol depletion on Rabies virus infection[J]. Virus Res, 2009, 139 (1) : 85–90 . |
| [13] | Acosta EG, Castilla V, Damonte EB. Alternative infectious entry pathways for Dengue virus serotypes into mammalian cells[J]. Cell Microbiol, 2009, 11 (10) : 1533–1549 . |
| [14] | Durrant DM, Daniels BP, Pasieka T, et al. CCR5 limits cortical viral loads during West Nile virus infection of the central nervous system[J]. J Neuroinflammat, 2015 : 233. |
| [15] | Coyne CB, Kim KS, Bergelson JM. Poliovirus entry into human brain microvascular cells requires receptor-induced activation of SHP-2[J]. EMBO J, 2007, 26 (17) : 4016–4028 . |
| [16] | Mañes S, del Real G, Martínez AC. Pathogens:raft hijackers[J]. Nat Rev Immunol, 2003, 3 (7) : 557–568 . |
| [17] | Zhu YZ, Cao MM, Wang WB, et al. Association of heat-shock protein 70 with lipid rafts is required for Japanese encephalitis virus infection in Huh7 cells[J]. J Gen Virol, 2012, 93 (Pt 1) : 61–71 . |
| [18] | Zhu YZ, Wu DG, Ren H, et al. The role of lipid rafts in the early stage of Enterovirus 71 infection[J]. Cell Physiol Biochem, 2015, 35 (4) : 1347–1359 . |
 2016, Vol. 27
2016, Vol. 27


