扩展功能
文章信息
- 王影姣, 沈娟, 方霞, 陈至里, 金小宝
- WANG Ying-jiao, SHEN Juan, FANG Xia, CHEN Zhi-li, JIN Xiao-bao
- 美洲大蠊肠道内生戈登放线菌的分离与鉴定
- Isolation and identification of Gordonia actinobacteria from the gut of Periplaneta americana
- 中国媒介生物学及控制杂志, 2016, 27(2): 172-175
- Chin J Vector Biol & Control, 2016, 27(2): 172-175
- 10.11853/j.issn.1003.8280.2016.02.020
-
文章历史
- 收稿日期: 2015-09-30
目前已被发现的蜚蠊约有5 000多种[1]。其中,美洲大蠊(Periplaneta americana)为室内的优势种群。蜚蠊主要生活在高温、潮湿[2]、病原菌较多的环境中,其之所以能在极其恶劣的环境中生存下来,主要在于其体内存在大量的内生菌[3],与其互利共生,共同抵御外界的恶劣环境。戈登菌(Gordonia)是一种好气生长、不游动、轻度抗酸的革兰阳性放线菌[4]。戈登菌主要用于降解环境中的生物大分子物质[5]、芳香烃化合物[6]等方面。戈登菌主要分离于柏油和苯酚污染的土壤[7]、地中海海岸线以及深海沉积物[8]等。从昆虫体内分离戈登菌的报道较少,仅中华蜜蜂(Apis cerana cerana)体内发现戈登菌[9]。目前,还未见从美洲大蠊中分离戈登菌的报道。鉴于此,本研究尝试将野生美洲大蠊作为实验对象,从其肠道内分离戈登菌,对这些菌株进行分子生物学鉴定以及系统发育学分析,并对戈登菌在美洲大蠊肠道内的作用进行初步探讨,为美洲大蠊肠道内生菌的深入研究和环境治理提供指导。
1 材料与方法 1.1 样品采集室外徒手捕捉野生美洲大蠊成虫。成虫体长29~35 mm,呈红褐色,翅长于腹部末端。触角很长,前胸背板中间有较大的蝶形褐色斑纹,斑纹的后缘有完整的黄色带纹,与文献报道的美洲大蠊成虫特征相符,鉴定为美洲大蠊。
1.2 仪器及试剂PCR仪、电泳仪、琼脂糖凝胶电泳成像系统均为美国Bio-Rad 公司产品;Ezup柱式细菌 DNA 提取试剂盒购于上海生工生物工程技术服务有限公司;Taq PCR Master mix(2×,blue dye) 购自加拿大生物技术公司,细菌通用引物[10](27f:AGA GTT TGA TCC TGG CTC AG;1492r:TAC GGC TAC CTT GTT ACG ACT T)由上海英潍捷基公司合成,RNase购于广州围谷润仪器有限公司。其他试剂为国产分析纯。
1.3 内生戈登菌的分离取室外捕捉的美洲大蠊样品,用流水冲洗,75%乙醇浸泡3 min,3.5%次氯酸钠液浸泡1 min,75%乙醇浸泡1 min,最后用无菌水洗涤3次。剪去触角、腿部以及翅。用无菌滤纸将美洲大蠊样品擦干。从侧面将美洲大蠊的腹部切开,取出肠道,放入匀浆器中,加入无菌水研磨,将研磨液稀释至所需浓度(10、0.005、0.002 5 μg/ml),用无菌枪吸取悬浮液 0.1 ml,在含有75 μg/ml的重铬酸钾的高氏一号培养基平板上培养,每个浓度3 个平行实验,采用涂布法均匀涂布。每组均倒置于培养箱中,28 ℃培养至少1周。待平板上长出可见菌落后,根据戈登菌的形态特征(菌落红橙色,较小,边缘圆整,橘红或浅粉色,产橘红色色素,表面稍微湿润),挑出所需菌株,接种于高氏一号培养基平板上。
1.4 纯化及保存待平板长出可见菌落,挑出,选择不含重铬酸钾的高氏一号培养基平板上进行纯化,每个菌落至少纯化5次以上以得到纯的菌株。纯化后的菌株转接到高氏斜面活化培养,于40%甘油中,-80 ℃保存。
1.5 培养特征观察经过纯化活化后的菌株,采用插片法观察菌株形态。插片法:菌株用高氏合成一号培养基培养,然后把灭菌后的盖玻片倾斜45°插于培养基上,使菌丝沿着培养基表面与盖玻片交界处生长附着于盖玻片上,待长好后光镜观察并记录菌落生长形态、可溶性色素颜色、菌丝生长情况等。
1.6 细菌基因组DNA的提取,16SrDNA 基因扩增检测、测序与 DNA 对比 按照Ezup柱式细菌基因组DNA抽提试剂盒步骤,提取戈登菌DNA。扩增16S rDNA 基因,引物为通用保守引物 27f 和1492r。50 μl反应体系为 Master mix 25 μl,ddH2O 20 μl,上、下游引物各2 μl,模板1 μl,反应条件为94 ℃ 4 min;94 ℃ 30 s,72 ℃ 30 s,共35个循环;72 ℃ 5 min。设立阴性对照。PCR 产物用 1% 琼脂糖凝胶电泳检测。PCR 产物测序由上海英潍捷基公司完成。将16S rDNA 基因序列与 GenBank 数据库中的已知序列进行 Blast比对。
1.7 分离菌株的系统发育分析将比对结果利用 Mega 5.1软件,采用最大似然值法,构建系统发育树进行分析。
2 结 果 2.1 内生戈登菌的分离结果从美洲大蠊肠道匀浆样品的平板中分离并鉴定后获得内生戈登菌6 株,暂命名为:①WA1-1AG;②WA2-5AG;③WA2-19AG;④WA4-31AG;⑤WA4-43AG;⑥WA8-44AG。同时分离出其他放线菌菌株,如链霉菌、诺卡氏菌、小单胞菌等。
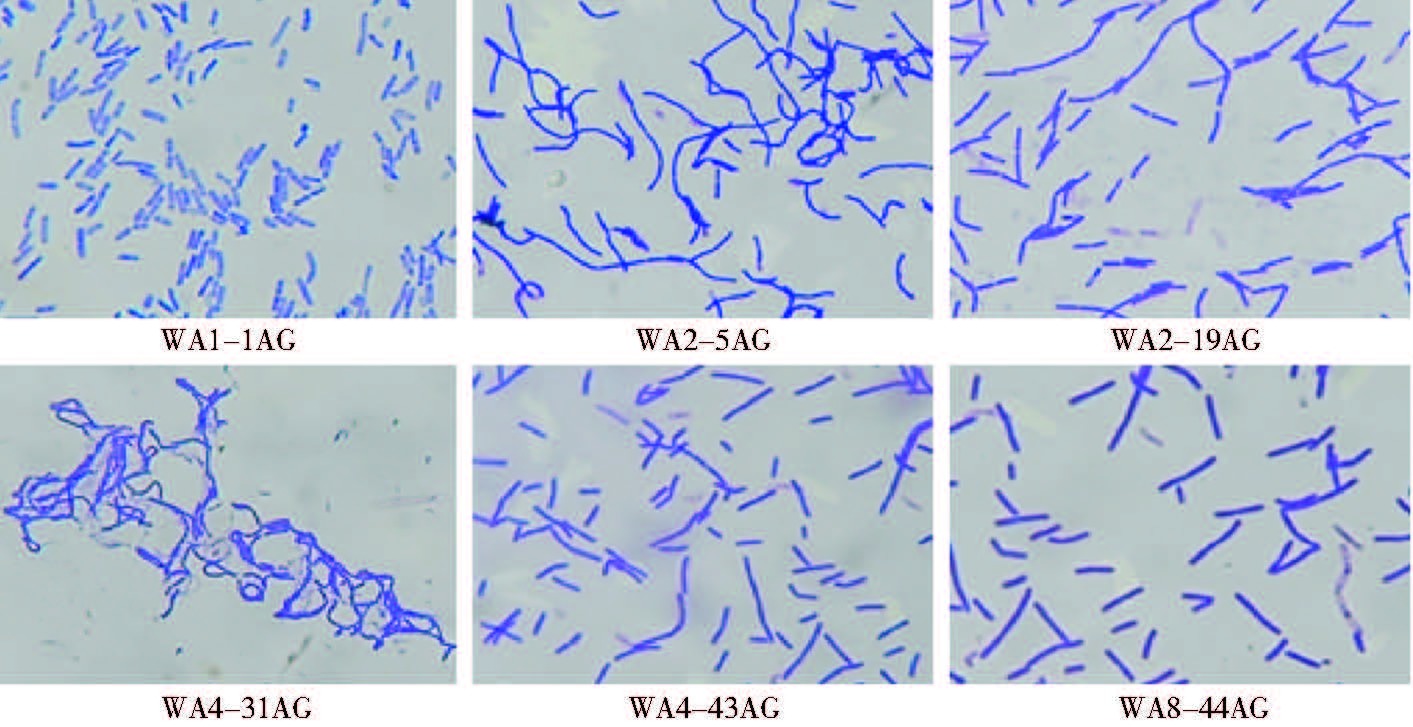
2.2 分离菌株的形态特征分离菌株在高氏合成一号培养基上28 ℃恒温培养7 d 后观察形态特征。革兰染色呈阳性,菌落较小,呈颗粒状,橘红或浅粉色,产橘红色色素,表面稍微湿润。菌体呈短棒状,菌丝呈直杆状或螺旋状,无横隔。符合戈登菌的形态特征。菌株的菌落形态及菌体、菌丝形态见图 1~3。

|
| 注:1. WA1-1AG、WA2-5AG、WA2-19AG的平板菌落; 2. WA4-31AG、WA4-43AG、WA8-44AG的平板菌落; 3~8. WA1-1AG、WA2-5AG、WA2-19AG、WA4-31AG、WA4-43AG、WA8-44AG的菌落试管斜面正反。 图 1 分离菌株的菌落形态 Figure 1 Isolatd bacteria’s colony morphology |
|
| 图 2 分离菌株的菌体形态(结晶紫染色,×100) Figure 2 Isolated bacteria’s morphology (crystal violet staining,×100) |

|
| 图 3 分离菌株的菌丝形态(革兰染色,×100) Figure 3 Isolated bacteria’s mycelial morphology (Gram staining,×100) |
16S rDNA 基因扩增后,1%琼脂糖凝胶电泳,6个样品均出现了目的条带(1.5 kb左右)。测序结果:6株分离菌株均为戈登菌,16S rDNA 基因高变区序列与NCBI上的基因序列比较,相似性均在98%以上。
2.4 系统发育树分析选用Mega 5.1软件,采用最大似然值法构建系统发育树,见图 4。从美洲大蠊肠道获得的6株菌均为戈登菌,与16S rDNA 测序结果一致。系统发育树分析表明,所分离到的菌株与分离自土壤、植物和海洋中的戈登菌亲缘关系较近。

|
| 图 4 最大似然法构建的分离菌株16S rDNA 与其同源基因的系统发育树 Figure 4 Maximum likelihood method phylogenetic tree of isolated bacteria’s 16S rDNA from related |
美洲大蠊主要出没于垃圾堆、落叶草丛以及石隙岩缝中,具有极强的适应能力。因出入于各种污垢场合会携带病菌、传播疾病,但其本身不会被传染病菌。有研究报道,美洲大蠊的这种特殊体质与其体内的共生菌有关[3]。目前,从其体内分离到的共生菌种类繁多,主要为放线菌。戈登菌作为放线菌的一种,因其特殊作用,在美洲大蠊抵抗外界恶劣环境的过程中发挥了不可忽视的作用。
戈登菌属是Stackebrandt等[11]于1997年确定新属,属于放线菌门(Actinobacteria),棒杆菌亚目(Corynebacterineae)。本实验从美洲大蠊肠道中分离出6株戈登菌,它们与从土壤、植物和海洋中发现的戈登菌亲缘关系较近,该菌的作用报道较多。首先,主要集中在生物脱硫方面。与传统方法比较,生物脱硫具有专一性,不破坏物质的基本性能等优点[10]。其脱硫的方式主要是4S途径:即亚砜(sulphoxide)-砜(sulphone)-磺酸盐(sulponate)-硫酸盐(sulphate)。在这一途径中,微生物只将分子中的S特异性的转化为SO42-,而不破坏芳环结构,并且不会引起物质本身性能的改变[12]。 其次,戈登菌体内存在多种与生物大分子降解有关的酶类,能够降解环境中的大分子物质、有机磷农药和芳香烃化合物等[13]。有文献报道,添加表面活性剂后,可通过增溶作用增强其降解能力[14]。这些酶类使得它们在环境的生物修复方面发挥着重要作用。其中,有些已经应用于污染土壤及水体的净化[15]。再次,戈登菌可通过减少重金属的移动、产生胞外分泌物对重金属进行固持和转化、吸附重金属离子和对重金属产生抗性遗传变异机制降解重金属的毒性[16, 17, 18]。另外,戈登菌可产一种类胡萝卜素-角黄素,拥有较好着色效果,同时具有抗癌防癌、抗氧化、提高免疫力、保护皮肤和骨骼等功能,可作为一种高品质的食品和饲料添加剂[19, 20]。最后,戈登菌可大量积累中链甘油三酯,这是因为其体内含有大量有利于脂肪酸和脂肪合成的基因[21]。大量研究表明,戈登菌具有降解生物大分子、降解重金属毒性、抗氧化、提高免疫力等作用。由此,猜测戈登菌在美洲大蠊肠道内可能也存在这些作用,使其能抵御外界的恶劣环境。
美洲大蠊能在恶劣的竞争环境中得以生存下来,影响因素众多。戈登菌的作用为研究其强大的生存能力提供了线索。戈登菌具有降解生物大分子、芳香烃化合物、吸附金属等作用,但在美洲大蠊中还未见报道,有待进一步研究及验证。
| [1] | 王宗庆,车艳丽. 世界蜚蠊系统学研究进展(蜚蠊目)[J]. 昆虫分类学报,2010,32增刊:23-33. |
| [2] | 冯琳琳,张钟宪. 美洲大蠊生物学特性及综合防治[J]. 首都师范大学学报:自然科学版,2007,28(5):37-39,51. |
| [3] | Tee HS,Lee CY. Water balance profiles,humidity preference and survival of two sympatric cockroach egg parasitoids Evania appendigaster and Aprostocetus hagenowii (Hymenoptera:Evaniidae;Eulophidae)[J]. J Insect Physiol,2015,77:45-54. |
| [4] | Pérez-Cobas AE,Maiques E,Angelova A,et al. Diet shapes the gut microbiota of the omnivorous cockroach Blattella germanica[J]. FEMS Microbiol Ecol,2015,91(4). DOI:10.1093/femsec/fiv022. |
| [5] | Li SH,Jin Y,Cheng J,et al. Gordonia jinhuaensis sp. nov.,a novel actinobacterium,isolated from a VBNC(viable but non-culturable)state in pharmaceutical wastewater[J]. Antonie van Leeuwenhoek,2014,106(2):347-356. |
| [6] | Lin CL,Shen FT,Tan CC,et al. Characterization of Gordonia sp. strain CC-NAPH129-6 capable of naphthalene degradation[J]. Microbiol Res,2012,167(7):395-404. |
| [7] | Hong SH,Ryu H,Kim J,et al. Rhizoremediation of diesel-contaminated soil using the plant growth-promoting rhizobacterium Gordonia sp. S2RP-17[J]. Biodegradation, 2011,22(3):593-601. |
| [8] | Quatrini P,Scaglione G,De Pasquale C,et al. Isolation of Gram-positive n-alkane degraders from a hydrocarbon-contaminated Mediterranean shoreline[J]. J Appl Microbiol, 2008,104(1):251-259. |
| [9] | 刘娟,刘晓飞,关统伟,等. 中华蜂体内放线菌的分离、多样性及抗菌活性研究[J]. 微生物学通报,2014,41(12):2410-2422. |
| [10] | 万涛. 戈登菌Gordonia sp. WQ-01对石油中二苯并噻吩(DBT)生物脱硫的研究[D]. 天津:天津大学,2011. |
| [11] | Stackebrandt E,Rainey FA,Ward-Rainey NL. Proposal for a new hierarchic classification system,actinobacteria classis nov[J]. Int J Syst Evol Microbiol,1997,47(2):479-491. |
| [12] | Ahmad A,Chauhan AK,Javed S,et al. Desulfurization of thianthrene by a Gordonia sp. IITR100[J]. Biotechnol Lett, 2014,36(11):2209-2214. |
| [13] | 罗红丽. 西藏地区土壤放线菌种群多样性及戈登菌的多相分类研究[D]. 重庆:西南大学,2006. |
| [14] | 傅海燕,柴天,高攀峰,等. RL发酵液对戈登菌降解含油废水的影响[J]. 厦门理工学院学报,2012,20(2):80-83. |
| [15] | Bell KS,Philp JC,Aw DW,et al. The genus Rhodococcus[J]. J Appl Microbiol,1998,85(2):195-210. |
| [16] | 叶锦韶,尹华,彭辉. 微生物抗重金属毒性研究进展[J]. 环境污染治理技术与设备,2002,3(4):1-4. |
| [17] | Alonso A,Sanchez P,Martínez JL. Stenotrophomonas maltophilia D457R contains a cluster of genes from gram-positive bacteria involved in antibiotic and heavy metal resistance[J]. Antimicrob Agents Chemother,2000,44(7):1778-1782. |
| [18] | 朱一民,周东琴,魏德洲. Norcardia amarae菌体对水相中Pb2+的吸附特性[J]. 东北大学学报:自然科学版,2003,24(10):978-981. |
| [19] | 李超. 一株产类胡萝卜素戈登菌的诱变及其色素产物的研究[D]. 武汉:湖北工业大学,2013. |
| [20] | 何然. 一株戈登菌的鉴定及其发酵产类胡萝卜素工艺优化[D]. 武汉:湖北工业大学,2011. |
| [21] | Eberly JO,Ringelberg DB,Indest KJ. Physiological characterization of lipid accumulation and in vivo ester formation in Gordonia sp. KTR9[J]. J Ind Microbiol Biotechnol,2013,40(2):201-208. |
 2016, Vol. 27
2016, Vol. 27


