扩展功能
文章信息
- 丰婧, 田凯, 侯鑫, 邱星辉
- FENG Jing, TIAN Kai, HOU Xin, QIU Xing-hui
- 家蝇细胞色素P450还原酶的原核表达与活性鉴定
- Functional expression of NADPH-cytochrome P450 reductase of the house fly (Musca domestica) in Escherichia coli
- 中国媒介生物学及控制杂志, 2016, 27(2): 121-123
- Chin J Vector Biol & Control, 2016, 27(2): 121-123
- 10.11853/j.issn.1003.8280.2016.02.007
-
文章历史
- 收稿日期: 2015-11-12
2 中国科学院动物研究所, 农业虫害鼠害综合治理研究国家重点实验室, 北京 100101;
3 中国科学院大学, 北京 100049
2 State Key Laboratory of Integrated Management of Pest Insects and Rodents, Institute of Zoology, Chinese Academy of Sciences;
3 University of Chinese Academy of Sciences
家蝇(Musca domestica)作为一种常见的疾病媒介,不仅危害人类健康,同时危害畜牧业的发展[1]。随着化学农药的广泛使用,家蝇普遍产生了抗药性[2],其中细胞色素P450(cytochrome P450 monooxygenases,P450s)的代谢解毒作用为家蝇产生抗药性的重要因素。P450s是一类含有血红蛋白的氧化酶类,在生物体内可催化许多初级和次级代谢反应,如蜕皮激素的合成和杀虫剂及植物次级代谢产物等外源物质的代谢等[3, 4]。P450酶系的催化反应是通过电子传递系统进行的,电子供体将NAD(P)H(nicotinamide adenine dinucleotide)的电子经过黄素腺嘌呤二核苷(FAD)和黄素单核苷(FMN)2个辅基传递给P450s,然后P450s与底物发生氧化还原反应[5]。在真核生物中,细胞色素P450 还原酶(cytochrome P450 reductase,CPR)是P450s的主要电子供体,并被认为是P450酶系催化反应中的限速酶[6]。
CPR作为结合在内质网上的黄素蛋白是1950年由Horecker和Heppel[7]发现的,当时它被认为是一个细胞色素C还原酶。至今,昆虫中有20多个CPR基因被描述[8, 9],其中编码家蝇细胞色素P450还原酶的(MdCPR)基因已被克隆和鉴定[10, 11]。大肠埃希菌原核表达因其产量高、成本低、操作简便、有多种载体和宿主菌可供选择等优点成为CPR基因功能表达和鉴定的一种常用的异源表达系统。本研究试图采用原核表达系统表达家蝇的MdCPR,为后续深入分析MdCPR的生物化学以及通过重组家蝇细胞色素P450酶系以鉴定细胞色素P450的代谢功能奠定基础。
1 材料与方法 1.1 家蝇供试家蝇于2009年采自山东省济南市并在实验室传代培养至今。
1.2 主要试剂总RNA提取所用试剂TRIzol® Reagent购自Invitrogen公司;Primescript RT reagent Kit(with gDNase)、T4连接酶、PrimeSTAR均购自TaKaRa公司;pEASY-blunt simple cloning Kit购自北京全式金生物技术有限公司;用于克隆的大肠埃希菌DH5α购自天根生物技术有限公司;限制性内切酶购自NEB公司;还原型细胞色素C购自罗氏公司;pCWori+质粒由Thomas Friedberg教授惠赠。
1.3 家蝇MdCPR基因的克隆选取3日龄家蝇成虫腹部使用TRIzol法提取家蝇总RNA,并反转录合成cDNA。以此cDNA为模板,使用PrimeSTAR高保真酶进行第一轮PCR扩增。使用CPR-Kpn-sF和CPR-Not-tR(表 1)作为引物:95 ℃ 3 min;95 ℃ 30 s,50 ℃ 30 s,72 ℃ 2 min,35个循环;最后72 ℃延伸10 min,PCR产物纯化回收后连接至pEASY载体构成MdCPR-pEasy质粒,MdCPR的PCR产物和重组质粒MdCPR-pEasy的序列均由华大基因公司测序验证。
pB508载体是在pCWori+质粒的NdeⅠ和KpnⅠ位点导入pelB序列的载体[9]。pB508载体与MdCPR-pEasy质粒共享KpnⅠ和NotⅠ两个酶切位点。将MdCPR-pEasy质粒双酶切后的MdCPR片段纯化回收后连接到经同样双酶切的pB508载体,构成MdCPR-pB508重组表达质粒。重组后的质粒转化到大肠埃希菌DH5α中,筛选阳性克隆,并由华大基因公司测序确认序列的正确性。
1.5 MdCPR-pB508(DH5α)的诱导表达与膜成分的制备MdCPR重组蛋白的表达参照文献[12]进行。挑取MdCPR-pB508(DH5α)的单克隆培养种子液,使其处于对数期。种子液按照1∶100比例加入TB培养基中培养,当菌液A600值在0.7~1.0时,使用1 mmol/L异丙基-β-d-硫代半乳糖苷(IPTG)诱导,置恒温摇床22 ℃,180 r/min培养60~72 h后收获菌体。
使用冰冷的TSE缓冲液(0.05 mmol/Tris-乙酸盐、250 mmol/L蔗糖、0.25 mmol/L EDTA,pH 7.6)重悬菌体沉淀,加入溶菌酶(终浓度为0.25 mg/ml)在冰上消化细胞壁1 h,然后在4 ℃,2 800×g离心25 min获得原生质球。用冰冷的重悬缓冲液(0.1 mol/L的磷酸钾缓冲液,pH 7.6)重悬原生质球沉淀,并加入DTT(终浓度0.1 mmol/L)和PMSF(终浓度1 mmol/L)充分混匀。使用SCIENTZ-IID超声波粉碎仪进行菌体细胞破碎,采用的超声功率依次为20% 2 min;25% 2 min;30% 2 min;35% 2 min;超声5 s,停10 s。将超声破碎产物经4 ℃ 12 000×g离心30 min后取上清液。将上清液在4 ℃ 180 000×g离心1 h 后获得膜组分的沉淀,保留去膜上清液并将膜组分沉淀用TSE缓冲液重悬备用。
1.6 MdCPR活性测定使用Bradford[13]法对原核表达的MdCPR去膜上清和膜成分进行蛋白浓度测定。MdCPR活性测定是通过还原型细胞色素C(Cyt C)在550 nm光吸收值的变化来测定的[14]。在2 ml离心管中含0.05 mmol/L Cyt C于0.05 mol/L Tris-HCl(pH 7.4)缓冲液中和2 μl的蛋白样品,混匀并分别加入参比杯和样品杯,待读数稳定后调零,然后在样品杯中加入2 μl 的0.1 mol/L 的NADPH启动反应,并记录至少3 min的A550 吸收值的动态变化。
2 结 果 2.1 MdCPR的诱导表达利用SDS-PAGE 凝胶电泳分析表明重组质粒MdCPR-pB508可以在宿主菌DH5α中表达产生MdCPR蛋白,见图 1。与含pB508质粒的对照组(泳道1)相比,含MdCPR-pB508重组质粒组(泳道2)的样品膜成分中分子质量约为76×103的蛋白的含量明显增加,该条带蛋白的大小与目标蛋白MdCPR的分子质量相符。对照组(泳道3)和样品组(泳道4)的去膜上清蛋白组分和含量无明显差异,由此说明蛋白MdCPR主要存在于膜组分中。
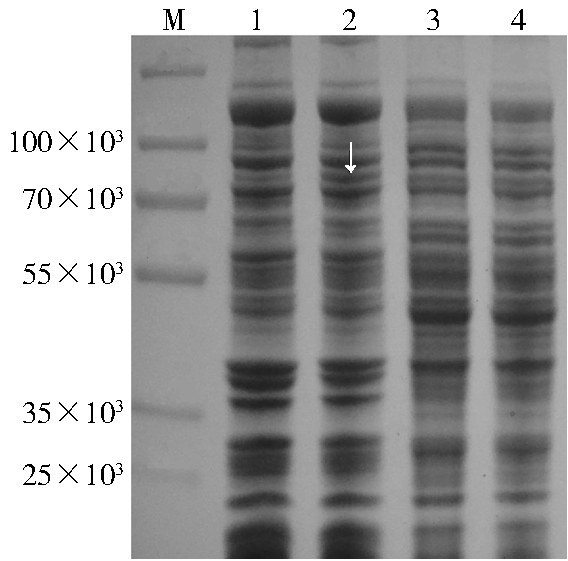
|
| 注:M. 蛋白质分子质量标记;1. 包含pB508空载体的细胞诱导后的膜组分;2. 包含MdCPR⁃pB508质粒的细胞诱导后的膜组分;3. 包含pB508空载体的细胞诱导后的上清组分;4. 包含MdCPR⁃pB508质粒的细胞诱导后的上清组分。箭头指示为重组MdCPR蛋白。 图 1 重组表达的MdCPR蛋白的SDS⁃PAGE检测结果 Figure 1 SDS⁃PAGE profiles of different fractions isolated from E. coli cells |
根据CPR可以还原Cyt C的化学属性,以Cyt C还原酶活性来检测MdCPR的表达与细胞定位。从表 2结果可见,在pB508对照质粒(对照组)的去膜上清和膜成分中均可检测到微弱的Cyt C还原活性〔(0.041±0.009)μmol还原态Cyt C/(min·mg)和(0.035±0.006)μmol还原态Cyt C/(min·mg)〕,这是由大肠埃希菌自身还原酶表现的活性(背景活性)。在重组质粒MdCPR-pB508经诱导表达的去膜上清成分和膜成分中可检测到更高的活性,其中膜成分对Cyt C的还原活性是对照组的40倍,表明mdCPR基因在大肠埃希菌得以表达,且重组表达的MdCPR蛋白具有预期的还原酶活性。膜成分的Cyt C还原酶活性为去膜上清液的3.7倍,表明诱导表达的MdCPR主要定位在细胞膜上。活性测定的结果与上述SDS-PAGE的检测结果相一致。
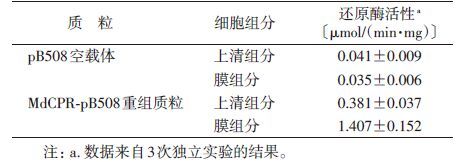 |
CPR作为一种黄素蛋白,在生物体代谢途径中发挥着重要的作用[15]。由于用传统的蛋白分离纯化方法获得昆虫CPR 蛋白非常繁琐和困难,有效的替代做法是采用重组表达系统[9, 11, 15, 16]。真核生物细胞P450酶系组分(细胞色素P450 单加氧酶、细胞色素P450 还原酶、细胞色素b5)是膜结合蛋白,需要膜环境以使蛋白质正确折叠并形成特定的空间构象,维持不同组分间的相互作用而完成催化反应过程。本研究建立的表达体系,发挥了原核表达系统产量更高、操作简单方便的优势,且表达的MdCPR主要定位在膜上,有利于MdCPR与细胞色素P450膜结合蛋白重组具有活性的细胞色素P450酶系,为进一步研究家蝇细胞色素P450蛋白的代谢底物奠定了基础。
| [1] | Scott JG, Liu N, Kristensen M, et al. A case for sequencing the genome of Musca domestica (Diptera:Muscidae)[J]. J Med Entomol,2009,46(2):175-182. |
| [2] | Wang QM, Li M, Pan J, et al. Diversity and frequencies of genetic mutations involved in insecticide resistance in field populations of the house fly (Musca domestica L.) from China[J]. Pestic Biochem Physiol,2012,102(2):153-159. |
| [3] | Feyereisen R. Insect CYP genes and P450 enzymes[M]//Gilbert L (Ed.). Insect Molecular Biology and Biochemistry. London:Elsevier B.V.,2012:236-316. |
| [4] | Li XC, Berenbaum MR, Schuler MA. Plant allelochemicals differentially regulate Helicoverpa zea cytochrome P450 genes[J]. Insect Mol Biol,2002,11(4):343-351. |
| [5] | Vermilion JL,Ballou DP,Massey V,et al. Separate roles for FMN and FAD in catalysis by liver microsomal NADPH-cytochrome P-450 reductase[J]. J Biol Chem,1981,256(1):266-277. |
| [6] | Cheng J, Wan DF, Gu JR,et al. Establishment of a yeast system that stably expresses human cytochrome P450 reductase:application for the study of drug metabolism of cytochrome P450s in vitro[J]. Protein Expr Purif,2006,47(2):467-476. |
| [7] | Horecker BL, Heppel LA. The reduction of cytochrome C by xanthine oxidase[J]. J Biol Chem,1949,178(2):683-690. |
| [8] | Zhu F, Sams S, Moural T, et al. RNA interference of NADPH-cytochrome P450 reductase results in reduced insecticide resistance in the bed bug, Cimex lectularius[J]. PLoS One,2012,7(2):e31037. |
| [9] | Liu D, Zhou XJ, Li M, et al. Characterization of NADPH-cytochrome P450 reductase gene from the cotton bollworm,Helicoverpa armigera[J]. Gene,2014,545(2):262-270. |
| [10] | Koener JF, Cariño FA, Feyereisen R. The cDNA and deduced protein sequence of house fly NADPH-cytochrome P450 reductase[J]. Insect Biochem Mol Biol,1993,23(4):439-447. |
| [11] | Andersen JF,Utermohlen JG,Feyereisen R. Expression of house fly CYP6A1 and NADPH-cytochrome P450 reductase in Escherichia coli and reconstitution of an insecticide-metabolizing P450 system[J]. Biochemistry,1994,33(8):2171-2177. |
| [12] | Yang JN, An JF, Li M, et al. Characterization of chicken cytochrome P4501A4 and 1A5:inter-paralog comparisons of substrate preference and inhibitor selectivity[J]. Comp Biochem Physiol C Toxicol Pharmacol,2013,157(4):337-343. |
| [13] | Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Anal Biochem,1976,72(1/2):248-254. |
| [14] | Guengerich F, Martin MV, Sohl CD, et al. Measurement of cytochrome P450 and NADPH-cytochrome P450 reductase[J]. Nat Protoc,2009,4(9):1245-1251. |
| [15] | Riddick DS, Ding XX, Wolf CR, et al. NADPH-Cytochrome P450 oxidoreductase:roles in physiology, pharmacology, and toxicology[J]. Drug Metab Dispos,2013, 41(1):12-23. |
| [16] | Sarapusit S, Pethuan S, Rongnoparut P. Mosquito NADPH-cytochrome P450 oxidoreductase:kinetics and role of phenylalanine amino acid substitutions at leu86 and leu219 in CYP6AA3-mediated deltamethrin metabolism[J]. Arch Insect Biochem Physiol,2010,73(4):232-244. |
 2016, Vol. 27
2016, Vol. 27



